prostaglandinele prezintă o gamă largă de efecte biologice, iar acțiunile lor sunt printre cele mai variate dintre compușii naturali. În ciuda acestei observații, acest grup de lipide prezintă o specificitate marcată de structură-activitate, care este determinată în principal de substituțiile inelului ciclopentanonei și de gradul de nesaturare a lanțurilor laterale ale acidului prostanoic. Răspunsul celular la prostaglandine este mediat de interacțiunea lor cu receptorii membranei plasmatice.
receptorii PG au fost clasificați inițial pe baza activităților funcționale ale agoniștilor naturali și sintetici, iar antagoniștii au fost clasificați în următoarele categorii: DP, EP, FP, IP și TP. Prima literă denotă tipul de prostaglandină, iar litera P înseamnă „prostanoid.”30 mai târziu, studiile prin analiza legării și clonarea moleculară au confirmat prezența unor tipuri distincte de receptori, precum și a trei sau patru subtipuri de EP (EP1–4). Receptorii de prostaglandină cu membrană plasmatică aparțin superfamiliei receptorilor cuplați cu proteina G caracterizați prin șapte regiuni transmembranare.31 mesageri intracelulari secundari ai receptorilor de prostaglandină includ cAMP, protein kinaza C și calciu.30,31 diferiții receptori prezintă o specificitate remarcabilă pentru eicosanoid, cu o preferință de cel puțin 100 de ori pentru ligand. La concentrații mari, PGE2 și PGF2a interacționează cu receptorul DP; în mod similar, PGF2a va activa receptorul EP, în timp ce PGD2 și PGE2 vor interacționa cu receptorul FP la concentrații mari. Majoritatea țesuturilor conțin un amestec de receptori, care pare a fi baza efectelor adesea opuse ale unei anumite prostaglandine la doze diferite.
rolul prostaglandinelor în secreția de gonadotropină
au fost publicate date recente care implică un rol fiziologic al prostaglandinelor în reglarea secreției hormonului de eliberare a gonadotropinei (GnRH).32,33 o serie de rapoarte sugerează acum că prostaglandinele, în special PGE2, exercită influențe stimulatoare asupra eliberării gonadotropinei, efect care pare a fi mediat de o acțiune la nivelul hipotalamusului. S-a demonstrat că PGE2 stimulează eliberarea GnRH din hipotalamus, iar pretratarea animalelor cu antiseruri pentru a neutraliza GnRH endogen previne eliberarea de LH indusă de PGE2.34 În plus, PGE1 și PGE2 par a fi cei mai puternici stimulatori ai eliberării hormonului de creștere din celulele adenohipofizice cultivate.35 PGB, PGA1, PGA2, PGB2, PGF1 și PGF2 sunt, de asemenea, stimulatori activi, dar efectele lor nu sunt observate la doze fiziologice. În general, prostaglandinele par să nu stimuleze secreția de gonadotropină printr-o acțiune directă asupra hipofizei.
dovezi suplimentare care sugerează că prostaglandinele ar putea afecta secreția de gonadotropină (acționând direct asupra hipotalamusului) sunt furnizate din studii care utilizează inhibitori de prostaglandină sintetază, cum ar fi indometacinul, care aparent reduc secreția de gonadotropină.36 faptul că prostaglandinele acționează prin factori de eliberare hipotalamică este evident pe baza a două observații:
- Pretratamentul șobolanilor femele și masculi cu antiser la hormonul de eliberare a LH (LHRH) a afectat capacitatea PGE2 (100 mg pe șobolan) de a crește secreția de LH.36
- administrarea directă a PGE2 în ventriculul creierului șobolanului a imitat efectul intravenos al prostaglandinelor asupra stimulării secreției de gonadotropină.36
constatările suplimentare oferă un sprijin convingător pentru conceptul că PGE2 acționează la nivelul eminenței mediane pentru a obține eliberarea LHRH. Această afirmație este coroborată în continuare de constatarea că țesutul eminență median conține cantități mai mari de prostaglandine endogene decât regiunile hipotalamice bazale. Datele obținute din incubațiile in vitro ale fragmentelor de eminență mediană obținute de la șobolani masculi au arătat că norepinefrina și dopamina stimulează eliberarea simultană de LHRH și PGF2a. Acest efect este blocat de indometacin, sugerând că prostaglandinele produse intraneuronal sunt mediatorii eliberării LHRH stimulate de catecolamină. Aceste constatări interesante sunt discutate mai detaliat într-o revizuire a Ojeda și a colegilor.36
ovulația și prostaglandinele
după descoperirea că indometacinul și aspirina (inhibitori ai sintezei prostaglandinelor) ar putea bloca ovulația,33,37 s-a sugerat că prostaglandinele au fost implicate în procesul de Ruptură foliculară ovariană. Această afirmație a fost consolidată și mai mult prin constatarea că injecția intraovariană de antiser PGF2a a inhibat, de asemenea, ovulația.38 în prezent există o cantitate substanțială de dovezi care indică faptul că formarea prostaglandinelor foliculare este îmbunătățită în timpul ovulației și că această creștere depinde de gonadotropine.39
creșterea ciclului mediu al gonadotropinelor stimulează biosinteza foliculară eicosanoidă printr-un proces mediat de cAMP care este dependent de activarea genei, dar independent de steroidogeneză. LH pare a fi gonadotropina pituitară fiziologică dominantă responsabilă de inducerea ovulației și se pare că efectele LH asupra rupturii foliculare pot fi mediate de leucocite care secretă enzime proteolitice, radicali de oxigen și prostaglandine. Indometacinul, de exemplu, va bloca ovulația indusă în mod normal de doze mari de gonadotropină corionică umană in vivo. Prostaglandinele pot Media efectele stimulatoare ale LH asupra „enzimelor ovulatorii”, cum ar fi proteaza sau colagenaza.40 există,de asemenea, posibilitatea ca prostaglandinele să provoace un răspuns contractil în peretele folicular, 41 despre care se știe acum că conține elemente contractile, cum ar fi miozina și actina. Activatorul plasminogenului sau o altă protează pare să fie intrinsec implicat în ruptura foliculului 42 și este evident că secreția acestei proteine este asociată cu creșterea indusă de LH a biosintezei prostaglandinelor foliculare, deși s-a subliniat că aceste două evenimente pot să nu fie interdependente. Un posibil mecanism de acțiune a prostaglandinei în ruptura foliculară este prezentat în Figura 6.
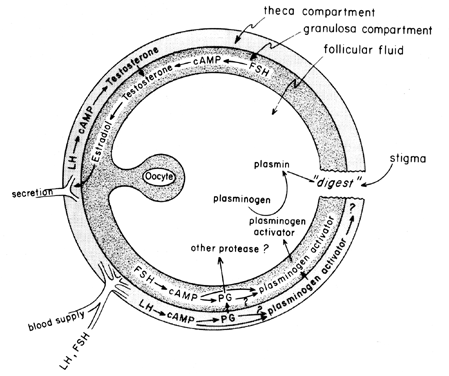 Fig. 6. Mecanismul posibil al acțiunii prostaglandinei în ruptura foliculară.(Behrman HR: prostaglandine în funcția hipotalamo-hipofizară și ovariană. Ann Rev Physiol 41:685, 1979)
Fig. 6. Mecanismul posibil al acțiunii prostaglandinei în ruptura foliculară.(Behrman HR: prostaglandine în funcția hipotalamo-hipofizară și ovariană. Ann Rev Physiol 41:685, 1979)
rolul prostaglandinelor în funcția luteală: Luteoliza și menstruația
mecanismul prin care corpul luteal uman regresează la 10 până la 12 zile după formarea sa este un mister. De la descoperirea timpurie că PGF2a a fost luteolitic la șobolan și la multe alte specii subprimate,43 s-a făcut un efort major de cercetare pentru a investiga posibilitatea reglării menstruale cu PGF2a.PGF2a induce regresia funcțională a corpului galben printr-un proces mediat de receptor, independent inițial de modificările fluxului sanguin ovarian sau luteal.32 în câteva minute, PGF2a epuizează acidul ascorbic, 44 decuplează receptorul LH ocupat din adenilat ciclază și scade transportul gonadotropinei de la capilare la celula luteală.
o revizuire a literaturii pertinente dezvăluie multe rapoarte contradictorii cu privire la efectele PGF2a la om. Unele studii au înregistrat scăderi tranzitorii ale nivelurilor circulante de progesteron de către PGF2a, 45 deși alte studii nu au reușit să demonstreze un astfel de efect la femeile cu ovulație normală.46,47 având în vedere existența unor presupuși receptori PGF2a în corpul luteal uman,48 S-a motivat că eșecul obținerii luteolizei cu perfuzii intravenoase de PGF2a s-a datorat probabil metabolismului pulmonar rapid. Studiile ulterioare care au implicat injectarea directă de PGF2a în corpul luteal uman au indus retragerea progesteronului, al cărui nadir a coincis cu debutul menstruației timpurii.49 aceste constatări sugerează că prostaglandinele ovariene endogene (sau un alt agent luteolitic) pot fi necesare pentru regresia luteală. Acest lucru pare fezabil având în vedere observația că funcția luteală umană pare să fie independentă de controlul uterin, deoarece nici histerectomia50, nici absența congenitală a uterului, vaginului sau trompelor uterine nu afectează ciclicitatea ovariană.51 țesutul luteal uman este cu siguranță capabil să producă prostaglandine, așa cum arată experimentele in vitro 52; cu toate acestea, încercările de corelare a nivelurilor crescute de PGF2a în ovar cu regresia luteală în faza luteală târzie nu au avut succes.53 se pare că singura dată când producția ovariană de PGF2a este îmbunătățită în ciclul menstrual uman este la scurt timp după ovulație.54 de asemenea, este evident, totuși, că concentrațiile de PGF2a sunt întotdeauna mai mari în țesutul stromal ovarian prin fazele luteale timpurii, medii și târzii.
spre deosebire de efectele in vivo ale PGF2a, studiile in vitro au demonstrat atât efecte luteolitice tranzitorii, cât și susținute în țesutul luteal uman.55,56,57 consensul general este că un eveniment timpuriu în luteoliza indusă de PGF2a este abrogarea producției de cAMP sensibile la gonadotropină derivată din studiile efectuate în corpul galben de șobolan.58,59 această abrogare este probabil să se producă printr-o inhibare directă a adenil ciclazei prin creșteri ale Ca2+intracelular.60 dovezi recente din domeniul neuroștiinței indică faptul că prostaglandinele stimulează eliberarea de Ca2+ intracelular prin creșterea hidrolizei fosfoinozitolului la diacilglicerol și inozitol trifosfat.61 în concordanță cu constatările efectuate la animalele de laborator, s-a demonstrat că regresia corpului galben uman este asociată și cu o pierdere a receptorilor LH.62
este bine cunoscut faptul că corpul luteal nou format al multor specii este refractar la acțiunea litică a PGF2a63; această observație pare să se extindă și la corpul luteal uman.64 Henderson și McNatty65 au sugerat că receptorii PGF2a din corpul luteal nou format pot fi cumva mascați de receptorii LH ocupați și că disocierea treptată a LH de receptorul său poate crește susceptibilitatea corpului luteal la PGF2a. O ipoteză alternativă a fost oferită de alți anchetatori,65 care sugerează că susceptibilitatea corpului luteal uman la PGF2a poate fi dependentă de nivelurile ovariene de noradrenalină, care cresc în timpul fazei luteale. Această creștere a catecolaminelor pare să permită efectul antigonadotropic al PGF2a asupra corpului galben uman.66
prostaglandine în uter
spre deosebire de miometru, care produce în principal IGP2, endometrul non-gravidă produce predominant PGF2a și PGE2. Sinteza prostaglandinelor este mai mare în epiteliul glandular decât în stroma endometrului și în timpul fazei secretoare decât în timpul fazei proliferative a ciclului.67,68 atât PGF2a, cât și PGE2, prin interacțiunea lor cu receptori specifici, sunt cunoscute pentru stimularea contractilității miometriale, ducând la o creștere a Ca2+intracelular. Un astfel de mecanism de hipercontractilitate uterină indusă de prostaglandină a fost implicat în patogeneza dismenoreei primare. Niveluri crescute de PGF2a și PGE2 au fost identificate în endometru și lichidul menstrual al femeilor cu dismenoree, iar medicamentele antiprostaglandine s-au dovedit a duce la o reducere semnificativă a durerii la acești pacienți.
diferite prostaglandine sunt, de asemenea, produse în colul uterin, iar site-urile receptorilor atât pentru PGE, cât și pentru PGF sunt prezente în colul uterin.69 creșterea producției de prostaglandine sau administrarea lor locală este asociată cu maturarea cervicală la femeile gravide.69
prostaglandine și parturiție
o serie de observații implică indirect implicarea prostaglandinelor în parturiție. Se știe, de exemplu, că administrarea de indometacin sau alte medicamente antiinflamatoare nesteroidiene, cum ar fi aspirina, prelungește gestația.69 în plus, prostaglandinele, în special PGF2a, sunt cunoscute ca stimulatoare puternice ale contractilității uterine și induc contracții ciclice ale uterului gravid. Concentrațiile crescute de prostaglandină sunt asociate cu debutul travaliului spontan la om. Mai mult, perioada de timp care precede debutul contracțiilor este caracterizată de niveluri plasmatice de PGF2a care sunt echivalente cu cele ale femeilor care nu sunt însărcinate. Imunizarea împotriva PGF2a întârzie, de asemenea, debutul parturiției.70 de prostaglandine sunt acum folosite pentru a induce travaliul timpuriu și avortul; într-adevăr, prostaglandina este medicamentul de alegere pentru realizarea avorturilor la mijlocul trimestrului.69,71
pe baza unor studii ample la ovine, se pare că prostaglandinele sintetizate local în uter inițiază travaliul acționând direct asupra miometrului pentru a promova contracțiile uterine. O scădere a progesteronului placentar local, combinată cu o creștere a estrogenului, are ca rezultat eliberarea de Ca2+ din lizozomii care au devenit fragili. Această eliberare de Ca2 + stimulează sinteza prostaglandinelor prin creșterea activității fosfolipazei. Oxitocina pare să faciliteze, mai degrabă decât să inițieze, efectele estrogenului și progesteronului.72 membranele fetale, decidua vera și miometrul pot participa la formarea prostaglandinelor.73,74
o propunere recentă este că producția de prostaglandine prin țesut intrauterin este inhibată tonic în timpul sarcinii umane și că o astfel de inhibare este eliminată progresiv pe măsură ce se apropie termenul. Deși mecanismele care efectuează inhibarea tonică a sintezei prostaglandinelor nu au fost stabilite, mai multe peptide antifosfolipazice au fost găsite în placenta umană, amnion,75 și corion.76 o altă posibilitate este ca sinteza prostaglandinelor să fie stimulată în paralel cu eliminarea inhibării sintezei. Semnalele potențiale pentru sinteza crescută a prostaglandinelor sunt mai mulți factori de creștere și factorul de activare a trombocitelor. Țesuturile pulmonare și renale fetale secretă factorul de activare a trombocitelor, care este capabil să stimuleze producția de prostaglandină de către amnionul uman.77
prostaglandine și canalul arterial
menținerea permeabilității (relaxarea vasodilatației) canalului arterial este esențială în controlul oxigenării țesuturilor la făt. După naștere, ductus arteriosus devine în mod normal constrâns sau își pierde permeabilitatea. Mecanismul prin care are loc această închidere este neclar, deși tensiunea oxigenului din sânge este considerată a fi un factor important (Fig. 7). Funcția primară a ductus arteriosus la făt este de a menține un anumit grad de manevră a sângelui arterial de la stânga la dreapta, controlând astfel cantitatea de revenire venoasă la plămâni. Închiderea canalului la termen este un proces fiziologic important care, dacă este incomplet, duce la detresă respiratorie și cianoză/hipoxie—sindroame care sunt responsabile de morbiditatea și mortalitatea ridicată la mulți sugari prematuri care suferă de canalul arterial patentat. Din acest motiv, există un mare interes în mecanismul(mecanismele) de control al funcției ductus arteriosus. Acest interes este deosebit de acut în domeniul cercetării prostaglandinelor, în care există acum o cantitate considerabilă de dovezi care sugerează implicarea prostaglandinelor în controlul permeabilității ductus arteriosus la termen.
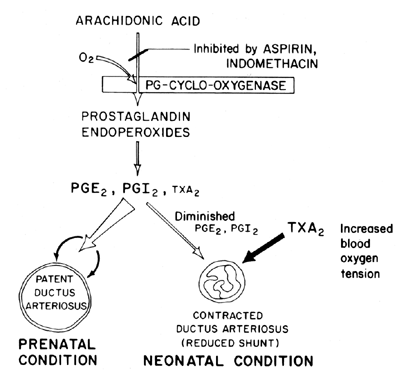 Fig. 7. Schema de modulare a prostaglandinei a permeabilității ductus arteriosus la făt și nou-născut în funcție de tensiunea oxigenului.
Fig. 7. Schema de modulare a prostaglandinei a permeabilității ductus arteriosus la făt și nou-născut în funcție de tensiunea oxigenului.
aceste dovezi se bazează pe următoarea serie de observații:
canalul arterial la făt cu deteriorare cardiopulmonară și boală a membranei hialine poate fi închis prin administrarea de inhibitori de prostaglandină sintetază.78
indometacinul poate induce contracția vasului hipoxic, după cum demonstrează efectele sale la animale pe termen scurt.79
administrarea de PGE2 (și PGE1) induce relaxarea (pierderea permeabilității) preparatelor izolate ale canalului arterial de miel fetal (benzi circulare) într-un mediu cu oxigen scăzut (PO2 mai mic de 14 mmHg).80
se pare că prostaglandinele din seria E, împreună cu antagoniștii prostaglandinelor și blocanții prostaglandin-sintetazei (aspirină), se pot dovedi a fi tratamente nechirurgicale de dorit pentru sugarii prematuri cu potențial letal canal arterial patentat. Dovezile recente sugerează un echilibru între permeabilitatea ductului și constricția care este menținută prin sinteza prostaglandinelor dilatante (PGI2 și PGE2) și a prostaglandinei constrictive (TXA2). La fătul mielului, atât ductus arteriosus, cât și plămânul sintetizează PGI2 și PGE2; apoi, pe măsură ce termenul se apropie, plămânul se deplasează spre sinteza TXA2.81 sunt disponibile informații suplimentare privind implicarea prostaglandinelor în controlul funcției canalului arterial.82