Le prostaglandine presentano una vasta gamma di effetti biologici e le loro azioni sono tra le più varie di tutti i composti presenti in natura. Nonostante questa osservazione, questo gruppo di lipidi mostra una marcata specificità struttura-attività, che è determinata principalmente dalle sostituzioni dell’anello ciclopentanone e dal grado di insaturazione delle catene laterali dell’acido prostanoico. La risposta cellulare alle prostaglandine è mediata dalla loro interazione con i recettori della membrana plasmatica.
I recettori PG sono stati inizialmente classificati sulla base delle attività funzionali degli agonisti naturali e sintetici e gli antagonisti sono stati classificati nelle seguenti categorie: DP, EP, FP, IP e TP. La prima lettera indica il tipo di prostaglandina e la lettera P sta per “prostanoide.”30 Successivamente, studi di analisi di legame e clonazione molecolare hanno confermato la presenza di tipi di recettori distinti e di tre o quattro sottotipi di EP (EP1–4). I recettori delle prostaglandine a membrana plasmatica appartengono alla superfamiglia dei recettori accoppiati alla proteina G caratterizzati da sette regioni transmembrana.31 I secondi messaggeri intracellulari dei recettori delle prostaglandine includono cAMP, protein chinasi C e calcio.30,31 I vari recettori mostrano una notevole specificità per l’eicosanoide, con almeno una preferenza 100 volte per il ligando. Ad alte concentrazioni, PGE2 e PGF2a interagiscono con il recettore DP; allo stesso modo, PGF2a attiverà il recettore EP, mentre PGD2 e PGE2 interagiranno con il recettore FP ad alte concentrazioni. La maggior parte dei tessuti contiene una miscela di recettori, che sembra essere la base per gli effetti spesso opposti di una particolare prostaglandina a dosi diverse.
Ruolo delle prostaglandine nella secrezione delle gonadotropine
Sono stati pubblicati dati recenti che implicano un ruolo fisiologico delle prostaglandine nella regolazione della secrezione dell’ormone di rilascio delle gonadotropine (GnRH).32,33 Numerosi rapporti suggeriscono ora che le prostaglandine, in particolare la PGE2, esercitano influenze stimolatorie sul rilascio di gonadotropine, un effetto che sembra essere mediato da un’azione a livello dell’ipotalamo. PGE2 ha dimostrato di stimolare il rilascio di GnRH dall’ipotalamo e il pretrattamento di animali con antisieri per neutralizzare il GnRH endogeno impedisce il rilascio indotto da PGE2 di LH.34 Inoltre, PGE1 e PGE2 sembrano essere i più potenti stimolatori del rilascio dell’ormone della crescita da cellule adenoipofisarie coltivate.35 PGB, PGA1, PGA2, PGB2, PGF1 e PGF2 sono anche stimolatori attivi, ma i loro effetti non si vedono a dosi fisiologiche. In generale, le prostaglandine sembrano non stimolare la secrezione di gonadotropina da un’azione diretta sull’ipofisi.
Ulteriori prove che suggeriscono che le prostaglandine potrebbero influenzare la secrezione di gonadotropina (agendo direttamente sull’ipotalamo) sono fornite da studi che utilizzano inibitori della prostaglandina sintetasi, come l’indometacina, che apparentemente riducono la secrezione di gonadotropina.36 Che le prostaglandine agiscono per mezzo di fattori di rilascio ipotalamico è evidente sulla base di due osservazioni:
- Il pretrattamento di ratti femmina e maschio con antisiero all’ormone di rilascio di LH (LHRH) ha compromesso la capacità di PGE2 (100 mg per ratto) di aumentare la secrezione di LH.36
- La somministrazione diretta di PGE2 nel ventricolo del cervello del ratto ha imitato l’effetto endovenoso delle prostaglandine sulla stimolazione della secrezione di gonadotropina.36
Ulteriori risultati forniscono un supporto convincente per il concetto che PGE2 agisce a livello dell’eminenza mediana per suscitare il rilascio di LHRH. Questa tesi è ulteriormente corroborata dalla constatazione che il tessuto mediano di eminenza contiene maggiori quantità di prostaglandine endogene rispetto alle regioni ipotalamiche basali. I dati ottenuti da incubazioni in vitro di frammenti di eminenza mediana ottenuti da ratti maschi hanno dimostrato che noradrenalina e dopamina stimolano il rilascio simultaneo di LHRH e PGF2a. Questo effetto è bloccato dall’indometacina, suggerendo che le prostaglandine prodotte intraneuronalmente sono i mediatori del rilascio di LHRH stimolato dalla catecolamina. Questi risultati interessanti sono discussi in modo più dettagliato in una recensione di Ojeda e collaboratori.36
Ovulazione e prostaglandine
Dopo la scoperta che l’indometacina e l’aspirina (inibitori della sintesi delle prostaglandine) potrebbero bloccare l’ovulazione,33,37 è stato suggerito che le prostaglandine fossero coinvolte nel processo di rottura follicolare ovarica. Questa tesi è stata ulteriormente rafforzata dalla scoperta che l’iniezione intraovariana di antisiero PGF2a ha anche inibito l’ovulazione.38 Vi è ora una notevole quantità di prove che indicano che la formazione di prostaglandine follicolari è migliorata durante l’ovulazione e che questa elevazione dipende dalle gonadotropine.39
L’ondata midcycle delle gonadotropine stimola la biosintesi follicolare degli eicosanoidi mediante un processo mediato da CAMP che dipende dall’attivazione genica, ma indipendente dalla steroidogenesi. LH sembra essere la gonadotropina pituitaria fisiologica dominante responsabile dell’induzione dell’ovulazione e sembra probabile che gli effetti di LH sulla rottura follicolare possano essere mediati dai leucociti che secernono enzimi proteolitici, radicali dell’ossigeno e prostaglandine. Indometacina, per esempio, bloccherà l’ovulazione normalmente indotta da grandi dosi di gonadotropina corionica umana in vivo. Le prostaglandine possono mediare gli effetti stimolatori di LH sugli “enzimi ovulatori”, come la proteasi o la collagenasi.40 Esiste anche la possibilità che le prostaglandine possano provocare una risposta contrattile nella parete del follicolo,41 che ora è noto per contenere elementi contrattili, come miosina e actina. L’attivatore del plasminogeno o qualche altra proteasi sembra essere intrinsecamente coinvolto nella rottura del follicolo,42 ed è evidente che la secrezione di questa proteina è associata all’aumento indotto da LH nella biosintesi delle prostaglandine follicolari, sebbene sia stato sottolineato che questi due eventi potrebbero non essere interdipendenti. Un possibile meccanismo di azione delle prostaglandine nella rottura follicolare è mostrato in Figura 6.
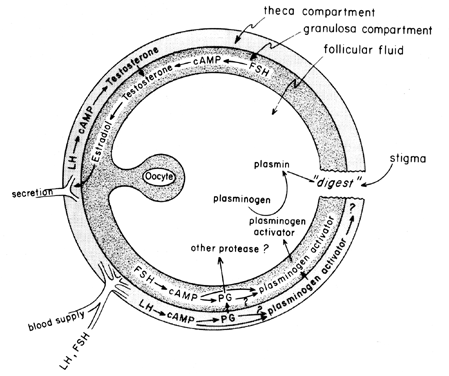 Fig. 6. Possibile meccanismo di azione delle prostaglandine nella rottura follicolare.(Behrman HR: prostaglandine nella funzione ipotalamo-ipofisaria e ovarica. Ann Rev Physiol 41:685, 1979)
Fig. 6. Possibile meccanismo di azione delle prostaglandine nella rottura follicolare.(Behrman HR: prostaglandine nella funzione ipotalamo-ipofisaria e ovarica. Ann Rev Physiol 41:685, 1979)
Ruolo delle prostaglandine nella funzione luteale: luteolisi e mestruazioni
Il meccanismo con cui il corpo luteo umano regredisce da 10 a 12 giorni dopo la sua formazione è un mistero. Dalla scoperta precoce che PGF2a era luteolitico nel ratto e in molte altre specie subprimate,43 è stato fatto un importante sforzo di ricerca per studiare la possibilità di regolazione mestruale con PGF2a.PGF2a induce la regressione funzionale del corpo luteo mediante un processo mediato dal recettore, indipendente inizialmente dai cambiamenti nel flusso sanguigno ovarico o luteale.32 In pochi minuti, PGF2a esaurisce l’acido ascorbico, 44 disaccoppia il recettore LH occupato dall’adenilato ciclasi e diminuisce il trasporto della gonadotropina dai capillari alla cellula luteale.
Una revisione della letteratura pertinente rivela molti rapporti contrastanti sugli effetti di PGF2a negli esseri umani. Alcuni studi hanno registrato cali transitori nei livelli circolanti di progesterone da parte di PGF2a, 45 sebbene altri studi non siano riusciti a dimostrare un tale effetto nelle donne normalmente ovulanti.46,47 In considerazione dell’esistenza di presunti recettori PGF2a nel corpo luteo umano,48 è stato motivato che il mancato raggiungimento della luteolisi con infusioni endovenose di PGF2a era forse dovuto al rapido metabolismo polmonare. Gli studi successivi che comprendono l’iniezione diretta di PGF2a nel corpo luteo umano hanno indotto il ritiro del progesterone, il nadir di cui ha coinciso con l’inizio delle prime mestruazioni.Questi risultati suggeriscono che le prostaglandine ovariche endogene (o qualche altro agente luteolitico) possono essere necessarie per la regressione luteale. Ciò sembra fattibile in considerazione dell’osservazione che la funzione luteale umana sembra essere indipendente dal controllo uterino, poiché né l’isterectomia50 né l’assenza congenita dell’utero, della vagina o delle tube di Falloppio influenzano la ciclicità ovarica.51 Il tessuto luteale umano è certamente in grado di produrre prostaglandine, come dimostrato da esperimenti in vitro52; tuttavia, i tentativi di correlare l’aumento dei livelli di PGF2a nell’ovaio con la regressione luteale nella fase luteale tardiva non hanno avuto successo.53 Sembra che l’unica volta che la produzione ovarica di PGF2a è migliorata nel ciclo mestruale umano è poco dopo l’ovulazione.È anche evidente, tuttavia, che le concentrazioni di PGF2a sono sempre più elevate nel tessuto stromale ovarico attraverso fasi luteali precoci, medie e tardive.
In contrasto con gli effetti in vivo di PGF2a, studi in vitro hanno dimostrato effetti luteolitici transitori e prolungati nel tessuto luteale umano.55,56,57 È il consenso generale che un evento precoce nella luteolisi indotta da PGF2a è l’abrogazione della produzione di CAMP sensibile alla gonadotropina derivata da studi nel corpo luteo del ratto.58,59 Questa abrogazione è probabilmente dovuta ad un’inibizione diretta dell’adenil ciclasi da parte di aumenti di Ca2+intracellulare.60 Prove recenti dal campo delle neuroscienze indicano che le prostaglandine stimolano il rilascio di Ca2+ intracellulare aumentando l’idrolisi del fosfoinositolo a diacilglicerolo e inositolo trifosfato.61 Coerentemente con i risultati in animali da laboratorio, è stato dimostrato che la regressione del corpo luteo umano è anche associata a una perdita di recettori LH.62
È ben noto che il corpo luteo di nuova formazione di molte specie è refrattario all’azione litica di PGF2a63; questa osservazione sembra estendersi anche al corpo luteo umano.64 Henderson e McNatty65 hanno suggerito che i recettori PGF2a nel corpo luteo appena formato possono in qualche modo essere mascherati da recettori LH occupati e che la graduale dissociazione di LH dal suo recettore può aumentare la suscettibilità del corpo luteo a PGF2a. Un’ipotesi alternativa è stata offerta da altri ricercatori,65 che suggeriscono che la suscettibilità del corpo luteo umano a PGF2a può dipendere dai livelli di noradrenalina ovarica, che aumentano durante la fase luteale. Questo aumento delle catecolamine sembra consentire l’effetto antigonadotropico di PGF2a sul corpo luteo umano.66
Prostaglandine nell’utero
A differenza del miometrio, che produce principalmente PGI2, l’endometrio non gravido produce prevalentemente PGF2a e PGE2. La sintesi delle prostaglandine è maggiore nell’epitelio ghiandolare rispetto allo stroma dell’endometrio e durante la fase secretoria rispetto alla fase proliferativa del ciclo.67,68 Sia PGF2a che PGE2, attraverso la loro interazione con recettori specifici, sono noti per stimolare la contrattilità miometriale, portando ad un aumento di Ca2+intracellulare. Un tale meccanismo di ipercontrattilità uterina indotta da prostaglandine è stato implicato nella patogenesi della dismenorrea primaria. Livelli elevati di PGF2a e PGE2 sono stati identificati nell’endometrio e nel liquido mestruale di donne con dismenorrea e gli agenti antiprostaglandinici hanno dimostrato di provocare una marcata riduzione del dolore in questi pazienti.
Varie prostaglandine sono prodotte anche nella cervice uterina e siti recettoriali per PGE e PGF sono presenti nella cervice.69 L’aumento della produzione di prostaglandine, o la loro somministrazione locale, è associato alla maturazione cervicale nelle donne in gravidanza.69
Prostaglandine e parto
Un certo numero di osservazioni implicano indirettamente il coinvolgimento delle prostaglandine nel parto. È noto, ad esempio, che la somministrazione di indometacina o altri farmaci antinfiammatori non steroidei, come l’aspirina, prolunga la gestazione.69 Inoltre, le prostaglandine, in particolare PGF2a, sono noti per essere potenti stimolatori della contrattilità uterina e indurre contrazioni cicliche dell’utero gravido. Concentrazioni elevate di prostaglandine sono associate all’inizio del travaglio spontaneo nell’uomo. Inoltre, il periodo di tempo che precede l’inizio delle contrazioni è caratterizzato da livelli plasmatici di PGF2a equivalenti a quelli delle donne non gravide. L’immunizzazione contro PGF2a ritarda anche l’inizio del parto.70 prostaglandine sono ora utilizzati per indurre il travaglio precoce e l’aborto; infatti, prostaglandina è il farmaco di scelta per realizzare aborti midtrimester.69,71
Sulla base di studi approfonditi sulle pecore, sembra che le prostaglandine sintetizzate localmente nell’utero inizino il travaglio agendo direttamente sul miometrio per promuovere le contrazioni uterine. Una diminuzione del progesterone placentare locale, combinata con un aumento degli estrogeni, provoca il rilascio di Ca2+ dai lisosomi che sono diventati fragili. Questo rilascio di Ca2 + stimola la sintesi delle prostaglandine aumentando l’attività della fosfolipasi. L’ossitocina sembra facilitare, piuttosto che iniziare, gli effetti dell’estrogeno e del progesterone.72 Membrane fetali, decidua vera e miometrio possono tutti partecipare alla formazione di prostaglandine.73,74
Una recente proposta è che la produzione di prostaglandine da parte del tessuto intrauterino sia inibita tonicamente durante la gravidanza umana e che tale inibizione venga progressivamente rimossa con l’avvicinarsi del termine. Anche se i meccanismi che effettuano l’inibizione tonica della sintesi delle prostaglandine non sono stati stabiliti, diversi peptidi antifosfolipasi sono stati trovati nella placenta umana, amnion,75 e corion.76 Un’altra possibilità è che la sintesi delle prostaglandine sia stimolata in parallelo con la rimozione dell’inibizione della sintesi. I potenziali segnali per una maggiore sintesi delle prostaglandine sono diversi fattori di crescita e fattore di attivazione piastrinica. I tessuti polmonari e renali fetali secernono il fattore di attivazione delle piastrine, che è in grado di stimolare la produzione di prostaglandine da parte dell’amnione umano.77
Prostaglandine e Dotto Arterioso
Il mantenimento della pervietà (rilassamento della vasodilatazione) del dotto arterioso è fondamentale nel controllo dell’ossigenazione dei tessuti nel feto. Dopo la nascita, il dotto arterioso normalmente diventa ristretto o perde la sua pervietà. Il meccanismo con cui si verifica questa chiusura non è chiaro, anche se si ritiene che la tensione dell’ossigeno nel sangue sia un fattore importante(Fig. 7). La funzione primaria del dotto arterioso nel feto è di mantenere un certo grado di smistamento del sangue arterioso da sinistra a destra, controllando così la quantità di ritorno venoso ai polmoni. La chiusura del dotto a termine è un importante processo fisiologico che, se incompleto, porta a distress respiratorio e cianosi / ipossia-sindromi che sono responsabili dell’elevata morbilità e mortalità in molti neonati prematuri affetti da dotto arterioso pervio. Per questo motivo, c’è molto interesse nei meccanismi di controllo della funzione del dotto arterioso. Questo interesse è particolarmente acuto nel campo della ricerca sulle prostaglandine, in cui vi è ora una notevole quantità di prove che suggeriscono il coinvolgimento delle prostaglandine nel controllo della pervietà del dotto arterioso a termine.
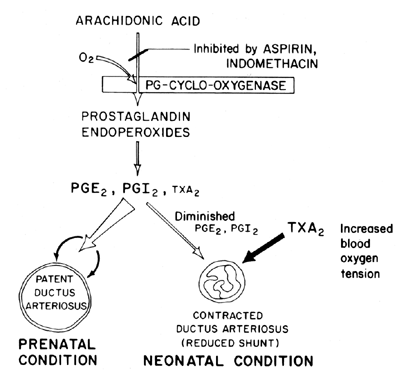 Fig. 7. Schema per la modulazione delle prostaglandine della pervietà del dotto arterioso nel feto e nel neonato in funzione della tensione dell’ossigeno.
Fig. 7. Schema per la modulazione delle prostaglandine della pervietà del dotto arterioso nel feto e nel neonato in funzione della tensione dell’ossigeno.
Questa evidenza si basa sulle seguenti serie di osservazioni:
Il dotto arterioso nel feto con deterioramento cardiopolmonare e malattia della membrana ialina può essere chiuso mediante somministrazione di inibitori della prostaglandina sintetasi.78
L’indometacina può indurre la contrazione del vaso ipossico, come dimostrato dai suoi effetti negli animali a breve termine.79
La somministrazione di PGE2 (e PGE1) induce il rilassamento (perdita di pervietà) di preparati isolati di dotto arterioso fetale di agnello (strisce circolari) in un ambiente a basso contenuto di ossigeno (PO2 inferiore a 14 mmHg).80
Sembra probabile che le prostaglandine della serie E, insieme agli antagonisti delle prostaglandine e ai bloccanti della prostaglandina-sintetasi (aspirina), possano rivelarsi trattamenti non chirurgici desiderabili per i neonati pretermine con dotto arterioso brevettato potenzialmente fatale. Prove recenti suggeriscono un equilibrio tra pervietà del dotto e costrizione che viene mantenuto dalla sintesi di prostaglandine dilatanti (PGI2 e PGE2) e prostaglandine costrittive (TXA2). Nel feto di agnello, sia il dotto arterioso che il polmone sintetizzano PGI2 e PGE2; quindi, man mano che il termine si avvicina, il polmone si sposta verso la sintesi di TXA2.Sono disponibili ulteriori informazioni sul coinvolgimento delle prostaglandine nel controllo della funzione del dotto arterioso.82