prostaglandiner uppvisar ett brett spektrum av biologiska effekter, och deras verkan är bland de mest varierade av alla naturligt förekommande föreningar. Trots denna observation visar denna grupp av lipider en markerad struktur-aktivitetsspecificitet, vilken bestäms huvudsakligen av cyklopentanonringssubstitutioner och graden av omättnad av prostansyrasidokedjorna. Det cellulära svaret på prostaglandiner medieras av deras interaktion med plasmamembranreceptorer.
PG-receptorer klassificerades initialt på grundval av funktionella aktiviteter hos naturliga och syntetiska agonister, och antagonister klassificerades i följande kategorier: DP, EP, FP, IP och TP. Den första bokstaven betecknar prostaglandintypen, och bokstaven P står för ”prostanoid.”30 senare bekräftade studier genom bindningsanalys och molekylär kloning närvaron av distinkta receptortyper såväl som tre eller fyra subtyper av EP (EP1–4). Plasmamembranprostaglandinreceptorer tillhör superfamiljen av G-proteinkopplade receptorer som kännetecknas av sju transmembranöverskridande regioner.31 intracellulära andra budbärare av prostaglandinreceptorer inkluderar cAMP, proteinkinas C och kalcium.30,31 de olika receptorerna visar anmärkningsvärd specificitet för eikosanoid, med minst en 100-faldig preferens för liganden. Vid höga koncentrationer interagerar PGE2 och PGF2a med DP-receptorn; på samma sätt aktiverar PGF2a EP-receptorn, medan PGD2 och PGE2 kommer att interagera med FP-receptorn vid höga koncentrationer. De flesta vävnader innehåller en blandning av receptorer, som verkar ligga till grund för de ofta motsatta effekterna av ett visst prostaglandin i olika doser.
prostaglandins roll i gonadotropinsekretion
nya data som implicerar en fysiologisk roll av prostaglandiner i regleringen av gonadotropinfrisättande hormon (GnRH) utsöndring har publicerats.32,33 ett antal rapporter tyder nu på att prostaglandiner, särskilt PGE2, utövar stimulerande påverkan på gonadotropinfrisättning, en effekt som verkar förmedlas av en verkan på hypotalamusnivån. PGE2 har visat sig stimulera frisättningen av GnRH från hypotalamus, och förbehandling av djur med antisera för att neutralisera endogen GnRH förhindrar PGE2-inducerad frisättning av LH.34 dessutom verkar PGE1 och PGE2 vara de mest potenta stimulatorerna för tillväxthormonfrisättning från odlade adenohypofyseala celler.35 PGB, PGA1, PGA2, PGB2, PGF1 och PGF2 är också aktiva stimulatorer, men deras effekter ses inte vid fysiologiska doser. I allmänhet verkar prostaglandiner inte stimulera gonadotropinsekretion genom en direkt verkan på hypofysen.
ytterligare bevis som tyder på att prostaglandiner kan påverka gonadotropinsekretion (genom att verka direkt på hypotalamus) tillhandahålls från studier med prostaglandinsyntetashämmare, såsom indometacin, som tydligen minskar gonadotropinsekretionen.36 att prostaglandiner verkar genom hypotalamisk frisättande faktorer är uppenbart på grundval av två observationer:
- förbehandling av hon-och hanråttor med antiserum mot LH-frisättande hormon (LHRH) försämrade förmågan hos PGE2 (100 mg per råtta) att öka LH-sekretionen.36
- direkt administrering av PGE2 i hjärnan hos råttan efterliknade den intravenösa effekten av prostaglandiner på stimuleringen av gonadotropinsekretion.36
ytterligare resultat ger övertygande stöd för konceptet att PGE2 verkar på nivån av median eminens för att framkalla frisättning av LHRH. Denna påstående bekräftas ytterligare av upptäckten att median eminensvävnad innehåller större mängder endogena prostaglandiner än basala hypotalamiska regioner. Data erhållna från in vitro-inkubationer av median eminensfragment erhållna från hanråttor har visat att noradrenalin och dopamin stimulerar samtidig frisättning av LHRH och PGF2a. Denna effekt blockeras av indometacin, vilket tyder på att intraneuronalt producerade prostaglandiner är mediatorer av katekolaminstimulerad LHRH-frisättning. Dessa intressanta resultat diskuteras mer detaljerat i en recension av Ojeda och medarbetare.36
ägglossning och prostaglandiner
efter upptäckten att indometacin och aspirin (hämmare av prostaglandinsyntes) kunde blockera ägglossningen,33,37 föreslogs att prostaglandiner var involverade i äggstocksfollikulärbrottsprocessen. Denna påstående förstärktes ytterligare av upptäckten att intraovarian injektion av PGF2a antiserum också hämmade ägglossningen.38 Det finns nu en betydande mängd bevis som tyder på att follikulär prostaglandinbildning förbättras under ägglossningen och att denna höjning är beroende av gonadotropiner.39
midcycle-ökningen av gonadotropiner stimulerar follikulär eikosanoidbiosyntes genom en cAMP-medierad process som är beroende av genaktivering, men oberoende av steroidogenes. LH verkar vara den dominerande fysiologiska hypofysgonadotropin som är ansvarig för induktion av ägglossning, och det verkar troligt att effekterna av LH på follikulär bristning kan förmedlas av leukocyter som utsöndrar proteolytiska enzymer, syreradikaler och prostaglandiner. Indometacin, till exempel, kommer att blockera ägglossning normalt induceras av stora doser av humant koriongonadotropin in vivo. Prostaglandiner kan förmedla de stimulerande effekterna av LH på” ovulatoriska enzymer”, såsom proteas eller kollagenas.40 Det finns också möjligheten att prostaglandiner kan framkalla ett kontraktilt svar i follikelväggen,41 som nu är känt för att innehålla kontraktila element, såsom myosin och aktin. Plasminogenaktivator eller något annat proteas verkar vara inneboende involverat i follikelbrott,42 och det är uppenbart att utsöndring av detta protein är associerat med LH-inducerad ökning av follikulär prostaglandinbiosyntes, även om det har påpekats att dessa två händelser kanske inte är beroende av varandra. En möjlig mekanism för prostaglandinverkan vid follikulär bristning visas i Figur 6.
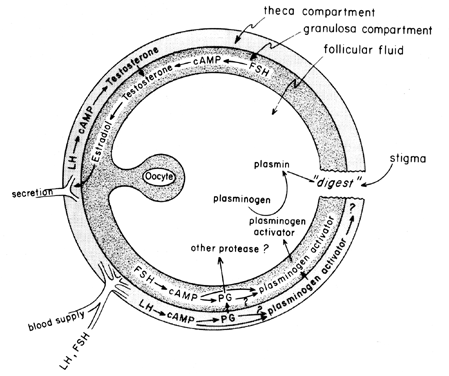 Fig. 6. Möjlig mekanism för prostaglandinverkan vid follikulär bristning.(Behrman HR: prostaglandiner i hypotalamus-hypofys och äggstocksfunktion. Ann Rev Physiol 41:685, 1979)
Fig. 6. Möjlig mekanism för prostaglandinverkan vid follikulär bristning.(Behrman HR: prostaglandiner i hypotalamus-hypofys och äggstocksfunktion. Ann Rev Physiol 41:685, 1979)
prostaglandins roll i Lutealfunktion: Luteolys och Menstruation
mekanismen genom vilken den mänskliga corpus luteum regresserar 10 till 12 dagar efter bildandet är ett mysterium. Sedan den tidiga upptäckten att PGF2a var luteolytisk hos råtta och många andra subprimatarter,43 en stor forskningsinsats har gjorts för att undersöka möjligheten till menstruationsreglering med PGF2a.PGF2a inducerar funktionell regression av corpus luteum genom en receptormedierad process, oberoende initialt av förändringar i äggstocks-eller lutealt blodflöde.32 inom några minuter tömmer PGF2a askorbinsyra, 44 kopplar bort den ockuperade LH-receptorn från adenylatcyklas och minskar transporten av gonadotropin från kapillärer till lutealcellen.
en genomgång av relevant litteratur avslöjar många motstridiga rapporter om effekterna av PGF2a hos människor. Vissa studier har registrerat övergående nedgångar i cirkulerande nivåer av progesteron av PGF2a,45 även om andra studier har misslyckats med att visa en sådan effekt hos normalt ägglossande kvinnor.46,47 med tanke på förekomsten av förmodade PGF2a-receptorer i humant corpus luteum,48 det motiverades att misslyckandet med att uppnå luteolys med intravenösa infusioner av PGF2a kanske berodde på snabb lungmetabolism. Efterföljande studier med direkt injektion av PGF2a i humant corpus luteum inducerade progesteronuttag, vars nadir sammanföll med början av tidiga menstruationer.49 dessa fynd tyder på att endogena äggstocksprostaglandiner (eller något annat luteolytiskt medel) kan krävas för luteal regression. Detta verkar genomförbart med tanke på observationen att mänsklig lutealfunktion verkar vara oberoende av livmoderkontroll, eftersom varken hysterektomi50 eller medfödd frånvaro av livmodern, vagina eller äggledarna påverkar ovariecykliciteten.51 Human luteal vävnad kan säkert producera prostaglandiner, vilket visas av in vitro-experiment52; försök att korrelera ökade PGF2a-nivåer i äggstocken med luteal regression i sen lutealfas har emellertid inte lyckats.53 det verkar som om den enda gången äggstocksproduktionen av PGF2a förbättras i den mänskliga menstruationscykeln är strax efter ägglossningen.54 det är emellertid också uppenbart att koncentrationerna av PGF2a alltid är högre i äggstocksstromvävnad genom tidiga, mitten och sena luteala faser.
till skillnad från in vivo-effekterna av PGF2a har in vitro-studier visat både övergående och ihållande luteolytiska effekter i human lutealvävnad.55,56,57 det är den allmänna uppfattningen att en tidig händelse i PGF2a-inducerad luteolys är upphävandet av gonadotropinkänslig cAMP-produktion härledd från studier i råttkorpus luteum.58,59 detta upphävande kommer sannolikt att ske genom en direkt hämning av adenylcyklas genom ökningar av intracellulär Ca2+.60 nya bevis från neurovetenskapsområdet indikerar att prostaglandiner stimulerar frisättningen av intracellulär Ca2+ genom att öka hydrolysen av fosfoinositol till diacylglycerol och inositoltrifosfat.61 i överensstämmelse med fynd hos laboratoriedjur visades det att regression av humant corpus luteum också är förknippat med en förlust av LH-receptorer.62
det är välkänt att det nybildade corpus luteum hos många arter är eldfast mot den lytiska verkan av PGF2a63; denna observation verkar också sträcka sig till det mänskliga corpus luteum.64 Henderson och McNatty65 föreslog att PGF2a-receptorer i det nybildade corpus luteum på något sätt kan maskeras av ockuperade LH-receptorer, och att gradvis dissociation av LH från dess receptor kan öka känsligheten hos corpus luteum till PGF2a. En alternativ hypotes erbjöds av andra utredare, 65 som föreslår att mottagligheten av humant corpus luteum till PGF2a kan vara beroende av ovarian noradrenalin nivåer, som ökar under lutealfasen. Denna ökning av katekolaminer verkar tillåta den antigonadotropa effekten av PGF2a på humant corpus luteum.66
prostaglandiner i livmodern
till skillnad från myometrium, som huvudsakligen producerar PGI2, producerar det icke-gravida endometriumet huvudsakligen PGF2a och PGE2. Syntesen av prostaglandiner är större i det glandulära epitelet än i endometriumstrom och under sekretionsfasen än under den proliferativa fasen av cykeln.67,68 både PGF2a och PGE2, genom deras interaktion med specifika receptorer, är kända för att stimulera myometrisk kontraktilitet, vilket leder till en ökning av intracellulär Ca2+. En sådan mekanism för prostaglandininducerad livmoderhyperkontraktilitet har varit inblandad i patogenesen av primär dysmenorrhea. Förhöjda nivåer av PGF2a och PGE2 har identifierats i endometrium och menstruationsvätska hos kvinnor med dysmenorrhea, och antiprostaglandinmedel har visat sig resultera i en markant minskning av smärta hos dessa patienter.
olika prostaglandiner produceras också i livmoderhalsen, och receptorställen för både PGE och PGF finns i livmoderhalsen.69 den ökade produktionen av prostaglandiner, eller deras lokala administrering, är förknippad med livmoderhalsmognad hos gravida kvinnor.69
prostaglandiner och förlossning
ett antal observationer indirekt implicerar involvering av prostaglandiner i förlossning. Det är till exempel känt att administrering av indometacin eller andra icke-steroida antiinflammatoriska läkemedel, såsom aspirin, förlänger graviditeten.69 dessutom är prostaglandiner, särskilt PGF2a, kända för att vara potenta stimulatorer av livmoderkontraktilitet och inducerar cykliska sammandragningar av livmodern. Förhöjda prostaglandinkoncentrationer är associerade med uppkomsten av spontan arbetskraft hos människor. Vidare kännetecknas tidsperioden före uppkomsten av sammandragningar av PGF2a-nivåer i plasma som motsvarar de hos icke-gravida kvinnor. Immunisering mot PGF2a försenar också uppkomsten av förlossning.70 prostaglandiner används nu för att inducera tidigt arbete och abort; prostaglandin är faktiskt det valfria läkemedlet för att utföra midtrimester aborter.69,71
baserat på omfattande studier på får verkar det som om prostaglandiner syntetiserade lokalt i livmodern initierar arbete genom att direkt verka på myometrium för att främja livmoderkontraktioner. En minskning av lokal, placental progesteron, i kombination med en ökning av östrogen, resulterar i frisättning av Ca2+ från lysosomer som har blivit bräckliga. Denna Ca2 + – frisättning stimulerar prostaglandinsyntes genom att öka fosfolipasaktiviteten. Oxytocin verkar underlätta, snarare än initiera, östrogen-och progesteroneffekterna.72 fostermembran, decidua vera och myometrium kan alla delta i bildandet av prostaglandiner.73,74
ett nytt förslag är att prostaglandinproduktion av intrauterin vävnad toniskt hämmas under mänsklig graviditet, och att sådan hämning gradvis avlägsnas när termen närmar sig. Även om mekanismerna som påverkar tonisk hämning av prostaglandinsyntes inte har fastställts har flera antifosfolipaspeptider hittats i human placenta, amnion, 75 och korion.76 En annan möjlighet är att prostaglandinsyntes stimuleras parallellt med avlägsnande av synteshämning. Potentiella signaler för ökad syntes av prostaglandiner är flera tillväxtfaktorer och trombocytaktiverande faktor. Fetal lung-och njurvävnader utsöndrar trombocytaktiverande faktor, som kan stimulera prostaglandinproduktion genom human amnion.77
prostaglandiner och Ductus Arteriosus
upprätthållandet av patency (avslappning av vasodilation) av ductus arteriosus är avgörande för att kontrollera syresättningen av vävnader i fostret. Efter födseln blir ductus arteriosus normalt inskränkt eller förlorar sin patency. Mekanismen genom vilken denna stängning sker är oklar, även om syrespänningen i blodet tros vara en viktig faktor (Fig. 7). Den primära funktionen hos ductus arteriosus hos fostret är att upprätthålla en viss grad av vänster-till-höger arteriell blodbyte och därigenom kontrollera mängden venös återgång till lungorna. Stängning av ductus vid termen är en viktig fysiologisk process som, om den är ofullständig, leder till andningsbesvär och cyanos/hypoxi—syndrom som är ansvariga för den höga sjukligheten och dödligheten hos många prematura barn som lider av patent ductus arteriosus. Av denna anledning finns det ett stort intresse för mekanismen(erna) för att kontrollera ductus arteriosus-funktionen. Detta intresse är särskilt akut inom området prostaglandinforskning, där det nu finns en avsevärd mängd bevis som tyder på involvering av prostaglandiner vid kontroll av ductus arteriosus-patency vid termin.
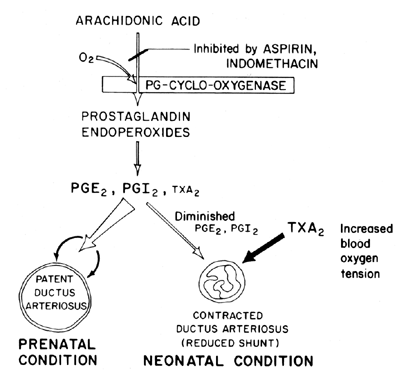 Fig. 7. Schema för prostaglandinmodulering av patency av ductus arteriosus hos foster och nyfödda som en funktion av syrespänning.
Fig. 7. Schema för prostaglandinmodulering av patency av ductus arteriosus hos foster och nyfödda som en funktion av syrespänning.
detta bevis är baserat på följande serie observationer:
ductus arteriosus hos fostret med kardiopulmonell försämring och hyalinmembransjukdom kan stängas genom administrering av prostaglandinsyntetashämmare.78
indometacin kan inducera sammandragning av det hypoxiska kärlet, vilket demonstreras av dess effekter hos djur på kort sikt.79
administrering av PGE2 (och PGE1) inducerar avslappning (förlust av patency) av isolerade fetala lammductus arteriosus-preparat (cirkulära remsor) i en låg syremiljö (PO2 mindre än 14 mmHg).80
det verkar troligt att prostaglandiner i E-serien, tillsammans med prostaglandinantagonister och prostaglandinsyntetasblockerare (aspirin), kan visa sig vara önskvärda icke-kirurgiska behandlingar för prematura barn med potentiellt dödlig patent ductus arteriosus. Nya bevis tyder på en balans mellan ductus patency och förträngning som upprätthålls genom syntes av dilaterande prostaglandiner (PGI2 och PGE2) och förträngande prostaglandin (TXA2). I lammfostret syntetiserar både ductus arteriosus och lungan PGI2 och PGE2; sedan, när termen närmar sig, skiftar lungan mot txa2-syntes.81 ytterligare information om prostaglandin involvering i kontrollen av ductus arteriosus funktion finns tillgänglig.82