Prostaglandine zeigen eine breite Palette biologischer Wirkungen, und ihre Wirkungen gehören zu den vielfältigsten aller natürlich vorkommenden Verbindungen. Trotz dieser Beobachtung zeigt diese Gruppe von Lipiden eine ausgeprägte Strukturaktivitätsspezifität, die hauptsächlich durch Cyclopentanonringsubstitutionen und den Grad der Ungesättigtheit der Prostansäureseitenketten bestimmt wird. Die zelluläre Reaktion auf Prostaglandine wird durch ihre Wechselwirkung mit Plasmamembranrezeptoren vermittelt.
PG-Rezeptoren wurden zunächst auf der Grundlage funktioneller Aktivitäten natürlicher und synthetischer Agonisten klassifiziert, und Antagonisten wurden in die folgenden Kategorien eingeteilt: DP, EP, FP, IP und TP. Der erste Buchstabe bezeichnet den Prostaglandin-Typ und der Buchstabe P steht für „Prostanoid.“30 Später bestätigten Studien durch Bindungsanalyse und molekulare Klonierung das Vorhandensein verschiedener Rezeptor–Typen sowie drei oder vier Subtypen von EP (EP1-4). Plasmamembran-Prostaglandinrezeptoren gehören zur Superfamilie der G-Protein-gekoppelten Rezeptoren, die durch sieben transmembranübergreifende Regionen gekennzeichnet sind.31 Intrazelluläre zweite Botenstoffe von Prostaglandinrezeptoren umfassen cAMP, Proteinkinase C und Calcium.30,31 Die verschiedenen Rezeptoren zeigen eine bemerkenswerte Spezifität für das Eicosanoid, wobei der Ligand mindestens 100-fach bevorzugt ist. Bei hohen Konzentrationen interagieren PGE2 und PGF2a mit dem DP-Rezeptor; In ähnlicher Weise aktiviert PGF2a den EP-Rezeptor, während PGD2 und PGE2 bei hohen Konzentrationen mit dem FP-Rezeptor interagieren. Die meisten Gewebe enthalten eine Mischung von Rezeptoren, die die Grundlage für die oft entgegengesetzten Wirkungen eines bestimmten Prostaglandin in verschiedenen Dosen zu sein scheint.
Rolle von Prostaglandinen bei der Gonadotropinsekretion
Neuere Daten, die eine physiologische Rolle von Prostaglandinen bei der Regulation der Gonadotropin-Releasing-Hormon-Sekretion (GnRH) implizieren, wurden veröffentlicht.32,33 Eine Reihe von Berichten deuten nun darauf hin, dass Prostaglandine, insbesondere PGE2, stimulierende Einflüsse auf die Gonadotropinfreisetzung ausüben, eine Wirkung, die durch eine Wirkung auf der Ebene des Hypothalamus vermittelt zu werden scheint. Es wurde gezeigt, dass PGE2 die Freisetzung von GnRH aus dem Hypothalamus stimuliert, und die Vorbehandlung von Tieren mit Antiseren zur Neutralisierung von endogenem GnRH verhindert die PGE2-induzierte Freisetzung von LH.34 Darüber hinaus scheinen PGE1 und PGE2 die stärksten Stimulatoren der Wachstumshormonfreisetzung aus kultivierten Adenohypophysenzellen zu sein.35 PGB, PGA1, PGA2, PGB2, PGF1 und PGF2 sind ebenfalls aktive Stimulatoren, aber ihre Wirkungen werden bei physiologischen Dosen nicht beobachtet. Im Allgemeinen scheinen Prostaglandine die Gonadotropinsekretion nicht durch eine direkte Wirkung auf die Hypophyse zu stimulieren.
Weitere Hinweise darauf, dass Prostaglandine die Gonadotropinsekretion beeinflussen könnten (indem sie direkt auf den Hypothalamus einwirken), stammen aus Studien mit Prostaglandinsynthetasehemmern wie Indomethacin, die anscheinend die Gonadotropinsekretion reduzieren.36 Dass Prostaglandine über hypothalamus-freisetzende Faktoren wirken, zeigt sich anhand zweier Beobachtungen:
- Die Vorbehandlung von weiblichen und männlichen Ratten mit Antiserum gegen LH-Releasing-Hormon (LHRH) beeinträchtigte die Fähigkeit von PGE2 (100 mg pro Ratte), die LH-Sekretion zu erhöhen.36
- Die direkte Verabreichung von PGE2 in den Ventrikel des Gehirns der Ratte ahmte die intravenöse Wirkung von Prostaglandinen auf die Stimulation der Gonadotropinsekretion nach.36
Zusätzliche Ergebnisse liefern überzeugende Unterstützung für das Konzept, dass PGE2 auf der Ebene der medianen Eminenz wirkt, um die Freisetzung von LHRH hervorzurufen. Diese Behauptung wird weiter durch die Feststellung bestätigt, dass medianes Eminenzgewebe größere Mengen an endogenen Prostaglandinen enthält als basale Hypothalamusregionen. Daten aus In-vitro-Inkubationen von medianen Eminenzfragmenten männlicher Ratten haben gezeigt, dass Noradrenalin und Dopamin die gleichzeitige Freisetzung von LHRH und PGF2a stimulieren. Dieser Effekt wird durch Indomethacin blockiert, was darauf hindeutet, dass intraneuronal produzierte Prostaglandine die Mediatoren der Katecholamin-stimulierten LHRH-Freisetzung sind. Diese interessanten Ergebnisse werden in einem Review von Ojeda und Mitarbeitern ausführlicher diskutiert.36
Ovulation und Prostaglandine
Nach der Entdeckung, dass Indomethacin und Aspirin (Inhibitoren der Prostaglandinsynthese) den Eisprung blockieren könnten,33,37 Es wurde vorgeschlagen, dass Prostaglandine am Ovarialfollikelrupturprozess beteiligt sind. Diese Behauptung wurde durch die Feststellung, dass die intraovarielle Injektion von PGF2a-Antiserum auch den Eisprung hemmte, weiter verstärkt.38 Es gibt nun eine beträchtliche Menge an Beweisen, die darauf hindeuten, dass die follikuläre Prostaglandinbildung während des Eisprungs verstärkt wird und dass diese Erhöhung von Gonadotropinen abhängt.39
Der Midcycle-Anstieg von Gonadotropinen stimuliert die follikuläre Eicosanoid-Biosynthese durch einen cAMP-vermittelten Prozess, der von der Genaktivierung abhängig, aber unabhängig von der Steroidogenese ist. LH scheint das dominierende physiologische Hypophysen-Gonadotropin zu sein, das für die Induktion des Eisprungs verantwortlich ist, und es scheint wahrscheinlich, dass die Auswirkungen von LH auf die Follikelruptur durch Leukozyten vermittelt werden können, die proteolytische Enzyme, Sauerstoffradikale und Prostaglandine absondern. Indomethacin zum Beispiel blockiert den Eisprung, der normalerweise durch hohe Dosen von humanem Choriongonadotropin in vivo induziert wird. Prostaglandine können die stimulierenden Wirkungen von LH auf „ovulatorische Enzyme“ wie Protease oder Kollagenase vermitteln.40 Es besteht auch die Möglichkeit, dass Prostaglandine eine kontraktile Reaktion in der Follikelwand hervorrufen,41 von der bekannt ist, dass sie kontraktile Elemente wie Myosin und Aktin enthält. Plasminogenaktivator oder eine andere Protease scheint intrinsisch an der Follikelruptur beteiligt zu sein,42 und es ist offensichtlich, dass die Sekretion dieses Proteins mit dem LH-induzierten Anstieg der follikulären Prostaglandin-Biosynthese assoziiert ist, obwohl darauf hingewiesen wurde, dass diese beiden Ereignisse möglicherweise nicht voneinander abhängig sind. Ein möglicher Mechanismus der Prostaglandinwirkung bei Follikelrupturen ist in Abbildung 6 dargestellt.
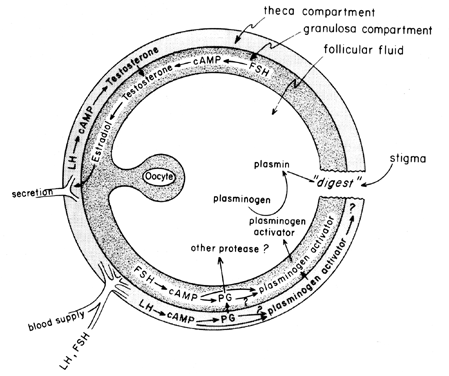 Abb. 6. Möglicher Mechanismus der Prostaglandinwirkung bei Follikelruptur.(Behrman HR: Prostaglandine in Hypothalamus-Hypophysen- und Eierstockfunktion. Annika Physiol 41:685, 1979)
Abb. 6. Möglicher Mechanismus der Prostaglandinwirkung bei Follikelruptur.(Behrman HR: Prostaglandine in Hypothalamus-Hypophysen- und Eierstockfunktion. Annika Physiol 41:685, 1979)
Rolle von Prostaglandinen in der Lutealfunktion: Luteolyse und Menstruation
Der Mechanismus, durch den sich das menschliche Corpus luteum 10 bis 12 Tage nach seiner Bildung zurückbildet, ist ein Rätsel. Seit dem frühen Befund, dass PGF2a bei der Ratte und vielen anderen Subprimatenarten luteolytisch war,43 Es wurden große Forschungsanstrengungen unternommen, um die Möglichkeit einer Menstruationsregulation mit PGF2a zu untersuchen.PGF2a induziert eine funktionelle Regression des Corpus luteum durch einen rezeptorvermittelten Prozess, unabhängig zunächst von Veränderungen des ovariellen oder lutealen Blutflusses.32 Innerhalb von Minuten erschöpft PGF2a Ascorbinsäure, 44 entkoppelt den besetzten LH-Rezeptor von der Adenylatcyclase und verringert den Transport von Gonadotropin von den Kapillaren zur Lutealzelle.
Eine Überprüfung der einschlägigen Literatur zeigt viele widersprüchliche Berichte über die Auswirkungen von PGF2a beim Menschen. Einige Studien haben vorübergehende Rückgänge der zirkulierenden Progesteronspiegel durch PGF2a aufgezeichnet,45 obwohl andere Studien eine solche Wirkung bei normal ovulierenden Frauen nicht nachweisen konnten.46,47 In Anbetracht der Existenz mutmaßlicher PGF2a-Rezeptoren im menschlichen Corpus luteum 48 wurde argumentiert, dass das Versagen, eine Luteolyse mit intravenösen Infusionen von PGF2a zu erreichen, möglicherweise auf einen schnellen Lungenstoffwechsel zurückzuführen sei. Nachfolgende Studien mit der direkten Injektion von PGF2a in das menschliche Corpus luteum induzierten einen Progesteronentzug, dessen Nadir mit dem Beginn der frühen Menstruation zusammenfiel.49 Diese Befunde legen nahe, dass endogene Ovarialprostaglandine (oder ein anderes Luteolytikum) für die Lutealregression erforderlich sein können. Dies scheint angesichts der Beobachtung machbar, dass die menschliche Lutealfunktion unabhängig von der Uteruskontrolle zu sein scheint, da weder die Hysterektomie 50 noch das angeborene Fehlen der Gebärmutter, der Vagina oder der Eileiter die Ovarialzyklizität beeinflussen.51 Menschliches Lutealgewebe ist sicherlich in der Lage, Prostaglandine zu produzieren, wie In vitro-Experimenten gezeigt wurde52; Versuche, erhöhte PGF2a-Spiegel im Eierstock mit einer lutealen Regression in der späten Lutealphase zu korrelieren, waren jedoch nicht erfolgreich.53 Es scheint, dass die ovarielle PGF2a-Produktion im menschlichen Menstruationszyklus nur kurz nach dem Eisprung gesteigert wird.54 Es ist jedoch auch ersichtlich, dass die Konzentrationen von PGF2a im Ovarialstromagewebe während der frühen, mittleren und späten Lutealphase immer höher sind.
Im Gegensatz zu den In-vivo-Wirkungen von PGF2a haben In-vitro-Studien sowohl vorübergehende als auch anhaltende luteolytische Wirkungen im menschlichen Lutealgewebe gezeigt.55,56,57 Es besteht allgemeiner Konsens, dass ein frühes Ereignis bei der PGF2a-induzierten Luteolyse die Aufhebung der Gonadotropin-sensitiven cAMP-Produktion ist, die aus Studien am Corpus luteum der Ratte stammt.58,59 Diese Aufhebung beruht wahrscheinlich auf einer direkten Hemmung der Adenylcyclase durch Erhöhung des intrazellulären Ca2+.60 Neuere Erkenntnisse aus den Neurowissenschaften deuten darauf hin, dass Prostaglandine die Freisetzung von intrazellulärem Ca2 + stimulieren, indem sie die Hydrolyse von Phosphoinositol zu Diacylglycerin und Inositoltriphosphat erhöhen.61 In Übereinstimmung mit Befunden an Labortieren wurde gezeigt, dass die Regression des menschlichen Corpus luteum auch mit einem Verlust von LH-Rezeptoren verbunden ist.62
Es ist bekannt, dass das neu gebildete Corpus luteum vieler Arten gegenüber der lytischen Wirkung von PGF2A63 refraktär ist; Diese Beobachtung scheint sich auch auf das menschliche Corpus luteum auszudehnen.64 Henderson und McNatty65 schlugen vor, dass PGF2a-Rezeptoren im neu gebildeten Corpus luteum irgendwie durch besetzte LH-Rezeptoren maskiert werden könnten, und dass eine allmähliche Dissoziation von LH von seinem Rezeptor die Anfälligkeit des Corpus luteum für PGF2a erhöhen könnte. Eine alternative Hypothese wurde von anderen Forschern angeboten,65 die darauf hindeuten, dass die Anfälligkeit des menschlichen Corpus luteum für PGF2a möglicherweise von den Noradrenalinspiegeln der Eierstöcke abhängt, die während der Lutealphase ansteigen. Dieser Anstieg der Katecholamine scheint die antigonadotrope Wirkung von PGF2a auf das menschliche Corpus luteum zu ermöglichen.66
Prostaglandine im Uterus
Im Gegensatz zum Myometrium, das hauptsächlich PGI2 produziert, produziert das nicht schwangere Endometrium überwiegend PGF2a und PGE2. Die Synthese von Prostaglandinen ist im Drüsenepithel größer als im Stroma des Endometriums und während der sekretorischen Phase als während der proliferativen Phase des Zyklus.67,68 Es ist bekannt, dass sowohl PGF2a als auch PGE2 durch ihre Wechselwirkung mit spezifischen Rezeptoren die myometriale Kontraktilität stimulieren, was zu einem Anstieg des intrazellulären Ca2 + führt. Ein solcher Mechanismus der Prostaglandin-induzierten Uterushyperkontraktilität wurde mit der Pathogenese der primären Dysmenorrhoe in Verbindung gebracht. Erhöhte PGF2a- und PGE2-Spiegel wurden im Endometrium und in der Menstruationsflüssigkeit von Frauen mit Dysmenorrhoe festgestellt, und es wurde gezeigt, dass Antiprostaglandin-Mittel bei diesen Patienten zu einer deutlichen Schmerzlinderung führen.
Verschiedene Prostaglandine werden auch im Gebärmutterhals produziert, und Rezeptorstellen für PGE und PGF sind im Gebärmutterhals vorhanden.69 Die erhöhte Produktion von Prostaglandinen oder deren lokale Verabreichung ist mit der Zervixreifung bei Schwangeren verbunden.69
Prostaglandine und Geburt
Eine Reihe von Beobachtungen impliziert indirekt die Beteiligung von Prostaglandinen an der Geburt. Es ist beispielsweise bekannt, dass die Verabreichung von Indomethacin oder anderen nichtsteroidalen entzündungshemmenden Arzneimitteln wie Aspirin die Schwangerschaft verlängert.69 Darüber hinaus sind Prostaglandine, insbesondere PGF2a, als starke Stimulatoren der Uteruskontraktilität bekannt und induzieren zyklische Kontraktionen des graviden Uterus. Erhöhte Prostaglandinkonzentrationen sind mit dem Einsetzen spontaner Wehen beim Menschen verbunden. Darüber hinaus ist der Zeitraum vor Beginn der Kontraktionen durch Plasma-PGF2a-Spiegel gekennzeichnet, die denen von nicht schwangeren Frauen entsprechen. Die Immunisierung gegen PGF2a verzögert auch den Beginn der Geburt.70 Prostaglandine werden jetzt verwendet, um frühe Arbeit und Abtreibung zu induzieren; In der Tat ist Prostaglandin das Medikament der Wahl für die Durchführung von Midtrimester Abtreibungen.69,71
Basierend auf umfangreichen Studien an Schafen scheint es, dass lokal in der Gebärmutter synthetisierte Prostaglandine die Wehen auslösen, indem sie direkt auf das Myometrium einwirken, um Uteruskontraktionen zu fördern. Eine Abnahme des lokalen plazentaren Progesterons in Kombination mit einem Anstieg des Östrogens führt zur Freisetzung von Ca2+ aus zerbrechlich gewordenen Lysosomen. Diese Ca2 + -Freisetzung stimuliert die Prostaglandinsynthese durch Erhöhung der Phospholipaseaktivität. Oxytocin scheint die Östrogen- und Progesteroneffekte eher zu erleichtern als zu initiieren.72 Fetale Membranen, Decidua vera und Myometrium können alle an der Bildung von Prostaglandinen beteiligt sein.73,74
Ein neuer Vorschlag ist, dass die Prostaglandinproduktion durch intrauterines Gewebe während der menschlichen Schwangerschaft tonisch gehemmt wird und dass eine solche Hemmung progressiv entfernt wird, wenn sich die Zeit nähert. Obwohl die Mechanismen, die die tonische Hemmung der Prostaglandinsynthese bewirken, nicht nachgewiesen wurden, wurden mehrere Antiphospholipasepeptide in menschlicher Plazenta, Amnion, 75 und Chorion gefunden.76 Eine andere Möglichkeit besteht darin, dass die Prostaglandinsynthese parallel zur Entfernung der Synthesehemmung stimuliert wird. Mögliche Signale für eine erhöhte Synthese von Prostaglandinen sind mehrere Wachstumsfaktoren und plättchenaktivierender Faktor. Fetale Lungen- und Nierengewebe scheiden einen thrombozytenaktivierenden Faktor aus, der die Prostaglandinproduktion durch menschliches Amnion stimulieren kann.77
Prostaglandine und der Ductus Arteriosus
Die Aufrechterhaltung der Durchgängigkeit (Entspannung der Vasodilatation) des Ductus arteriosus ist entscheidend für die Kontrolle der Sauerstoffversorgung von Geweben im Fötus. Nach der Geburt wird der Ductus arteriosus normalerweise verengt oder verliert seine Durchgängigkeit. Der Mechanismus, durch den dieser Verschluss auftritt, ist unklar, obwohl angenommen wird, dass die Blutsauerstoffspannung ein wichtiger Faktor ist (Abb. 7). Die Hauptfunktion des Ductus arteriosus beim Fötus besteht darin, ein gewisses Maß an arteriellem Blut-Shunt von links nach rechts aufrechtzuerhalten, wodurch der venöse Rückfluss in die Lunge gesteuert wird. Der Verschluss des Ductus at term ist ein wichtiger physiologischer Prozess, der, wenn er unvollständig ist, zu Atemnot und Zyanose / Hypoxie führt – Syndrome, die für die hohe Morbidität und Mortalität bei vielen Frühgeborenen mit patentiertem Ductus arteriosus verantwortlich sind. Aus diesem Grund besteht ein großes Interesse an den Mechanismen zur Steuerung der Ductus Arteriosus-Funktion. Dieses Interesse ist besonders akut auf dem Gebiet der Prostaglandinforschung, in der es jetzt eine beträchtliche Menge an Beweisen gibt, die auf die Beteiligung von Prostaglandinen bei der Kontrolle der Durchgängigkeit des Ductus arteriosus bei Term hindeuten.
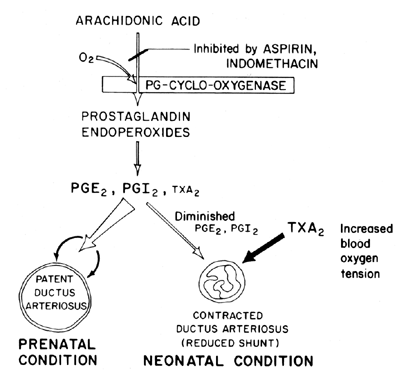 Abb. 7. Schema für die Prostaglandinmodulation der Durchgängigkeit des Ductus arteriosus bei Fötus und Neugeborenem als Funktion der Sauerstoffspannung.
Abb. 7. Schema für die Prostaglandinmodulation der Durchgängigkeit des Ductus arteriosus bei Fötus und Neugeborenem als Funktion der Sauerstoffspannung.
Diese Beweise basieren auf der folgenden Reihe von Beobachtungen:
Der Ductus arteriosus beim Fötus mit kardiopulmonaler Verschlechterung und Hyalinmembranerkrankung kann durch Verabreichung von Prostaglandinsynthetasehemmern geschlossen werden.78
Indomethacin kann eine Kontraktion des hypoxischen Gefäßes induzieren, wie seine Wirkungen bei Tieren kurzfristig zeigen.79
Die Verabreichung von PGE2 (und PGE1) induziert eine Relaxation (Verlust der Durchgängigkeit) von isolierten fetalen Lamm-Ductus-Arteriosus-Präparaten (kreisförmige Streifen) in einer sauerstoffarmen Umgebung (PO2 weniger als 14 mmHg).80
Es scheint wahrscheinlich, dass sich Prostaglandine der E-Serie zusammen mit Prostaglandinantagonisten und Prostaglandinsynthetaseblockern (Aspirin) als wünschenswerte nichtchirurgische Behandlungen für Frühgeborene mit potenziell tödlichem Patent erweisen können Ductus arteriosus. Neuere Erkenntnisse deuten auf ein Gleichgewicht zwischen Duktusdurchgängigkeit und Verengung hin, das durch Synthese von dilatativen Prostaglandinen (PGI2 und PGE2) und verengendem Prostaglandin (TXA2) aufrechterhalten wird. Im Lammfötus synthetisieren sowohl der Ductus arteriosus als auch die Lunge PGI2 und PGE2; wenn sich die Zeit nähert, verschiebt sich die Lunge in Richtung TXA2-Synthese.81 Weitere Informationen zur Beteiligung von Prostaglandin an der Kontrolle der Ductus arteriosus-Funktion sind verfügbar.82