Las prostaglandinas exhiben una amplia gama de efectos biológicos, y sus acciones se encuentran entre los compuestos naturales más variados. A pesar de esta observación, este grupo de lípidos muestra una marcada especificidad estructura-actividad, que está determinada principalmente por sustituciones de anillos de ciclopentanona y el grado de insaturación de las cadenas laterales del ácido prostanoico. La respuesta celular a las prostaglandinas está mediada por su interacción con los receptores de la membrana plasmática.
Los receptores de PG se clasificaron inicialmente sobre la base de las actividades funcionales de los agonistas naturales y sintéticos, y los antagonistas se clasificaron en las siguientes categorías: DP, EP, FP, IP y TP. La primera letra denota el tipo de prostaglandina, y la letra P significa «prostanoide».»30 Más tarde, estudios mediante análisis de unión y clonación molecular confirmaron la presencia de distintos tipos de receptores, así como tres o cuatro subtipos de EP (EP1–4). Los receptores de prostaglandinas de membrana plasmática pertenecen a la superfamilia de receptores acoplados a proteínas G caracterizados por siete regiones que abarcan la transmembrana.Los segundos mensajeros intracelulares de los receptores de prostaglandinas incluyen cAMP, proteína quinasa C y calcio.30,31 Los diversos receptores muestran una notable especificidad para el eicosanoide, con al menos una preferencia de 100 veces por el ligando. A altas concentraciones, PGE2 y PGF2a interactúan con el receptor DP; de manera similar, PGF2a activará el receptor EP, mientras que PGD2 y PGE2 interactuarán con el receptor FP a altas concentraciones. La mayoría de los tejidos contienen una mezcla de receptores, que parece ser la base de los efectos a menudo opuestos de una prostaglandina en particular a dosis diferentes.
Papel de las prostaglandinas en la secreción de gonadotropinas
Se han publicado datos recientes que implican un papel fisiológico de las prostaglandinas en la regulación de la secreción de la hormona liberadora de gonadotropinas (GnRH).32,33 En la actualidad, varios informes sugieren que las prostaglandinas, en particular la PGE2, ejercen influencias estimulantes sobre la liberación de gonadotropinas, un efecto que parece estar mediado por una acción a nivel del hipotálamo. Se ha demostrado que la PGE2 estimula la liberación de GnRH del hipotálamo, y el pretratamiento de animales con antisueros para neutralizar la GnRH endógena previene la liberación de LH inducida por la PGE2.34 Además, PGE1 y PGE2 parecen ser los estimuladores más potentes de la liberación de hormona de crecimiento de células adenohipofisarias cultivadas.35 PGB, PGA1, PGA2, PGB2, PGF1 y PGF2 también son estimuladores activos, pero sus efectos no se observan a dosis fisiológicas. En general, las prostaglandinas parecen no estimular la secreción de gonadotropinas por una acción directa sobre la hipófisis.
Estudios en los que se utilizaron inhibidores de la prostaglandina sintetasa, como la indometacina, que aparentemente reducen la secreción de gonadotropinas, proporcionan pruebas adicionales que sugieren que las prostaglandinas podrían afectar a la secreción de gonadotropinas (actuando directamente sobre el hipotálamo).36 Que las prostaglandinas actúan por medio de factores de liberación hipotalámica es evidente sobre la base de dos observaciones:
- El tratamiento previo de ratas hembra y macho con antisuero a hormona liberadora de LH (LHRH) afectó la capacidad de PGE2 (100 mg por rata) para aumentar la secreción de LH.36
- La administración directa de PGE2 en el ventrículo del cerebro de la rata imitaba el efecto intravenoso de las prostaglandinas sobre la estimulación de la secreción de gonadotropinas.36
Otros hallazgos proporcionan un apoyo convincente para el concepto de que la PGE2 actúa a nivel de la eminencia mediana para provocar la liberación de LHRH. Esta afirmación se corrobora aún más por el hallazgo de que el tejido de eminencia mediana contiene mayores cantidades de prostaglandinas endógenas que las regiones hipotalámicas basales. Los datos obtenidos de incubaciones in vitro de fragmentos de eminencia mediana obtenidos de ratas macho han demostrado que la norepinefrina y la dopamina estimulan la liberación simultánea de LHRH y PGF2a. Este efecto es bloqueado por la indometacina, lo que sugiere que las prostaglandinas producidas intraneurónicamente son los mediadores de la liberación de LHRH estimulada por catecolaminas. Estos interesantes hallazgos se discuten con mayor detalle en una revisión realizada por Ojeda y sus compañeros de trabajo.36
Ovulación y Prostaglandinas
Después del descubrimiento de que la indometacina y la aspirina (inhibidores de la síntesis de prostaglandinas) podrían bloquear la ovulación33,37,se sugirió que las prostaglandinas estaban involucradas en el proceso de ruptura folicular ovárica. Esta afirmación se fortaleció aún más por el hallazgo de que la inyección intraovariana de antisuero PGF2a también inhibió la ovulación.38 Ahora hay una cantidad sustancial de evidencia que indica que la formación de prostaglandinas foliculares aumenta durante la ovulación y que esta elevación depende de las gonadotropinas.39
El aumento de gonadotropinas en el ciclo medio estimula la biosíntesis de eicosanoides foliculares mediante un proceso mediado por cAMP que depende de la activación génica, pero es independiente de la esteroidogénesis. La LH parece ser la gonadotropina hipofisaria fisiológica dominante responsable de la inducción de la ovulación, y parece probable que los efectos de la LH en la ruptura folicular estén mediados por leucocitos que secretan enzimas proteolíticas, radicales de oxígeno y prostaglandinas. La indometacina, por ejemplo, bloqueará la ovulación inducida normalmente por grandes dosis de gonadotropina coriónica humana in vivo. Las prostaglandinas pueden mediar en los efectos estimulantes de la LH sobre las «enzimas ovulatorias», como la proteasa o la colagenasa.40 También existe la posibilidad de que las prostaglandinas puedan provocar una respuesta contráctil en la pared folicular,41 que ahora se sabe que contiene elementos contráctiles, como la miosina y la actina. El activador del plasminógeno o alguna otra proteasa parece estar intrínsecamente involucrado en la ruptura folicular 42,y es evidente que la secreción de esta proteína está asociada con el aumento inducido por la LH en la biosíntesis de prostaglandinas foliculares, aunque se ha señalado que estos dos eventos pueden no ser interdependientes. En la Figura 6 se muestra un posible mecanismo de acción de la prostaglandina en la ruptura folicular.
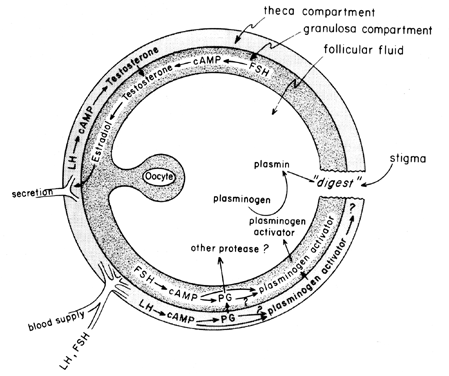 Fig. 6. Posible mecanismo de acción de la prostaglandina en la ruptura folicular.(Behrman HR: Prostaglandinas en la función hipotálamo-hipofisaria y ovárica. Fisiol de Ann Rev 41:685, 1979)
Fig. 6. Posible mecanismo de acción de la prostaglandina en la ruptura folicular.(Behrman HR: Prostaglandinas en la función hipotálamo-hipofisaria y ovárica. Fisiol de Ann Rev 41:685, 1979)
Papel de las Prostaglandinas en la Función Lútea: Luteólisis y Menstruación
El mecanismo por el cual el cuerpo lúteo humano retrocede 10 a 12 días después de su formación es un misterio. Desde el hallazgo temprano de que el PGF2a era luteolítico en la rata y en muchas otras especies subprímatas43,se ha hecho un gran esfuerzo de investigación para investigar la posibilidad de regulación menstrual con el PGF2a.El PGF2a induce la regresión funcional del cuerpo lúteo mediante un proceso mediado por receptores, independiente inicialmente de los cambios en el flujo sanguíneo ovárico o lúteo.32 En cuestión de minutos, el PGF2a agota el ácido ascórbico, 44 desacopla el receptor de LH ocupado de la adenilato ciclasa y disminuye el transporte de gonadotropina de los capilares a la célula lútea.
Una revisión de la literatura pertinente revela muchos informes contradictorios sobre los efectos de PGF2a en humanos. Algunos estudios han registrado descensos transitorios en los niveles circulantes de progesterona por PGF2A45, aunque otros estudios no han demostrado tal efecto en mujeres que ovulan normalmente.46,47 En vista de la existencia de supuestos receptores de PGF2a en el cuerpo lúteo humano48,se razonó que el fracaso en lograr luteólisis con infusiones intravenosas de PGF2a se debió quizás al rápido metabolismo pulmonar. Estudios posteriores que involucraron la inyección directa de PGF2a en el cuerpo lúteo humano indujeron la retirada de progesterona, cuyo nadir coincidió con el inicio de la menstruación temprana.Estos hallazgos sugieren que las prostaglandinas ováricas endógenas (u otro agente luteolítico) pueden ser necesarias para la regresión lútea. Esto parece factible en vista de la observación de que la función lútea humana parece ser independiente del control uterino, ya que ni la histerectomía50 ni la ausencia congénita del útero, la vagina o las trompas de falopio afectan la ciclicidad ovárica.51 El tejido lúteo humano es ciertamente capaz de producir prostaglandinas, como lo demuestran los experimentos in vitro 52; sin embargo, los intentos de correlacionar los niveles aumentados de PGF2a en el ovario con la regresión lútea en la fase lútea tardía no han tenido éxito.53 Parece que la única vez que se mejora la producción ovárica de PGF2a en el ciclo menstrual humano es poco después de la ovulación.Sin embargo, también es evidente que las concentraciones de PGF2a son siempre más altas en el tejido estromal ovárico a través de las fases lúteas temprana, media y tardía.
En contraste con los efectos in vivo de PGF2a, los estudios in vitro han demostrado efectos luteolíticos tanto transitorios como sostenidos en el tejido lúteo humano.55,56,57 Es el consenso general que un evento temprano en la luteólisis inducida por PGF2a es la abrogación de la producción de AMPc sensible a gonadotropinas derivada de estudios en el cuerpo lúteo de ratas.58,59 Es probable que esta abrogación se deba a una inhibición directa de la adenil ciclasa por aumentos de Ca2+intracelular.60 Evidencia reciente del campo de la neurociencia indica que las prostaglandinas estimulan la liberación de Ca2 + intracelular al aumentar la hidrólisis del fosfoinositol a diacilglicerol y trifosfato de inositol.61 De acuerdo con los hallazgos en animales de laboratorio, se demostró que la regresión del cuerpo lúteo humano también se asocia con una pérdida de receptores de LH.62
Es bien sabido que el cuerpo lúteo recién formado de muchas especies es refractario a la acción lítica de PGF2a63; esta observación también parece extenderse al cuerpo lúteo humano.64 Henderson y McNatty65 sugirieron que los receptores de PGF2a en el cuerpo lúteo recién formado pueden de alguna manera estar enmascarados por receptores de LH ocupados, y que la disociación gradual de la LH de su receptor puede aumentar la susceptibilidad del cuerpo lúteo a PGF2a. Una hipótesis alternativa fue ofrecida por otros investigadores65, que sugieren que la susceptibilidad del cuerpo lúteo humano a PGF2a puede depender de los niveles de noradrenalina ovárica, que aumentan durante la fase lútea. Este aumento de catecolaminas parece permitir el efecto antigonadotrópico de PGF2a en el cuerpo lúteo humano.66
Prostaglandinas en el útero
A diferencia del miometrio, que produce principalmente PGI2, el endometrio no embarazada produce predominantemente PGF2a y PGE2. La síntesis de prostaglandinas es mayor en el epitelio glandular que en el estroma del endometrio, y durante la fase secretora que durante la fase proliferativa del ciclo.67,68 Se sabe que tanto el PGF2a como el PGE2, a través de su interacción con receptores específicos, estimulan la contractilidad miometrial, lo que lleva a un aumento de Ca2+intracelular. Tal mecanismo de hipercontractilidad uterina inducida por prostaglandinas ha sido implicado en la patogénesis de la dismenorrea primaria. Se han identificado niveles elevados de PGF2a y PGE2 en el endometrio y el líquido menstrual de mujeres con dismenorrea, y se ha demostrado que los fármacos antiprostaglandínicos producen una reducción marcada del dolor en estas pacientes.
También se producen varias prostaglandinas en el cuello uterino, y los sitios receptores de PGE y PGF están presentes en el cuello uterino.69 El aumento de la producción de prostaglandinas, o su administración local, se asocia con la maduración cervical en mujeres embarazadas.69
Prostaglandinas y Parto
Varias observaciones implican indirectamente la participación de prostaglandinas en el parto. Se sabe, por ejemplo, que la administración de indometacina u otros antiinflamatorios no esteroideos, como la aspirina, prolonga la gestación.69 Además, se sabe que las prostaglandinas, en particular la PGF2a, son potentes estimuladores de la contractilidad uterina e inducen contracciones cíclicas del útero grávido. Las concentraciones elevadas de prostaglandinas se asocian con el inicio del parto espontáneo en humanos. Además, el período de tiempo que precede al inicio de las contracciones se caracteriza por niveles plasmáticos de PGF2a equivalentes a los de las mujeres no embarazadas. La inmunización contra PGF2a también retrasa el inicio del parto.70 Prostaglandinas se utilizan ahora para inducir el parto temprano y el aborto; de hecho, la prostaglandina es la droga de elección para realizar abortos de tercer trimestre.69,71
Basado en estudios extensos en ovejas, parece que las prostaglandinas sintetizadas localmente en el útero inician el trabajo de parto al actuar directamente sobre el miometrio para promover las contracciones uterinas. Una disminución de la progesterona placentaria local, combinada con un aumento del estrógeno, produce la liberación de Ca2+ de los lisosomas que se han vuelto frágiles. Esta liberación de Ca2 + estimula la síntesis de prostaglandinas al aumentar la actividad de la fosfolipasa. La oxitocina parece facilitar, en lugar de iniciar, los efectos del estrógeno y la progesterona.Las membranas fetales, la decidua vera y el miometrio pueden participar en la formación de prostaglandinas.73,74
Una propuesta reciente es que la producción de prostaglandinas por el tejido intrauterino se inhiba tónicamente durante el embarazo humano, y que dicha inhibición se elimine progresivamente a medida que se aproxima el término. Aunque no se han establecido los mecanismos que afectan la inhibición tónica de la síntesis de prostaglandinas, se han encontrado varios péptidos antifosfolipasa en la placenta humana, el amnión75 y el corión.76 Otra posibilidad es que la síntesis de prostaglandinas se estimule en paralelo con la eliminación de la inhibición de la síntesis. Las señales potenciales para el aumento de la síntesis de prostaglandinas son varios factores de crecimiento y factor activador de plaquetas. Los tejidos pulmonares y renales del feto secretan un factor activador de plaquetas, que es capaz de estimular la producción de prostaglandinas por el amnión humano.77
Prostaglandinas y el conducto arterioso
El mantenimiento de la permeabilidad (relajación de la vasodilatación) del conducto arterioso es fundamental para controlar la oxigenación de los tejidos en el feto. Después del nacimiento, el conducto arterioso normalmente se contrae o pierde su permeabilidad. El mecanismo por el que se produce este cierre no está claro, aunque se cree que la tensión de oxígeno en la sangre es un factor importante (Fig. 7). La función principal del conducto arterioso en el feto es mantener un cierto grado de derivación de sangre arterial de izquierda a derecha, controlando así la cantidad de retorno venoso a los pulmones. El cierre del conducto a término es un proceso fisiológico importante que, si es incompleto, conduce a dificultad respiratoria y síndromes de cianosis/hipoxia que son responsables de la alta morbilidad y mortalidad en muchos bebés prematuros que sufren de conducto arterioso persistente. Por esta razón, hay mucho interés en el mecanismo(s) de control de la función del conducto arterioso. Este interés es particularmente agudo en el campo de la investigación de prostaglandinas, en el que ahora hay una cantidad considerable de evidencia que sugiere la participación de prostaglandinas en el control de la permeabilidad del conducto arterioso a término.
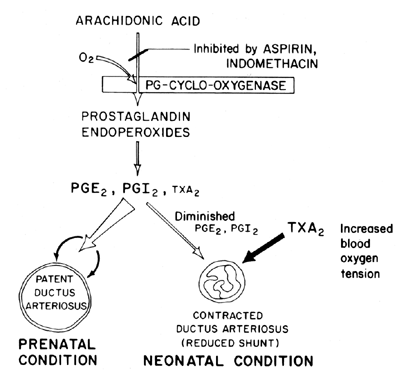 Fig. 7. Esquema de modulación de la permeabilidad del conducto arterioso de prostaglandinas en feto y neonato en función de la tensión de oxígeno.
Fig. 7. Esquema de modulación de la permeabilidad del conducto arterioso de prostaglandinas en feto y neonato en función de la tensión de oxígeno.
Esta evidencia se basa en la siguiente serie de observaciones:
El conducto arterioso en el feto con deterioro cardiopulmonar y enfermedad de la membrana hialina se puede cerrar mediante la administración de inhibidores de la prostaglandina sintetasa.78
La indometacina puede inducir la contracción del vaso hipóxico, como lo demuestran sus efectos en animales a corto plazo.79
La administración de PGE2 (y PGE1) induce relajación (pérdida de permeabilidad) de preparaciones aisladas de conducto arterioso fetal de cordero (tiras circulares) en un ambiente de bajo oxígeno (PO2 inferior a 14 mmHg).80
Parece probable que las prostaglandinas de la serie E, junto con antagonistas de prostaglandinas y bloqueadores de prostaglandina-sintetasa (aspirina), sean tratamientos no quirúrgicos deseables para bebés prematuros con conducto arterioso persistente potencialmente mortal. Evidencia reciente sugiere un equilibrio entre la permeabilidad del conducto y la constricción que se mantiene mediante la síntesis de prostaglandinas dilatadoras (PGI2 y PGE2) y prostaglandinas constrictoras (TXA2). En el feto de cordero, tanto el conducto arterioso como el pulmón sintetizan PGI2 y PGE2; luego, a medida que se acerca el término, el pulmón se desplaza hacia la síntesis de TXA2.81 Se dispone de más información sobre la afectación de las prostaglandinas en el control de la función del conducto arterioso.82