us Pharm. 2014; 39 (4):HS2-HS7.
ABSTRACT: The management of hydrocephalus, the accumulation of cerebrospinal fluid (CSF) in the ventricles of the brain, often includes shunt implantation to prevent long-term effects. Shunts são dispositivos de drenagem projetados para manter a pressão intracraniana e prevenir a acumulação adicional do LCR, mas eles podem introduzir patógenos no sistema nervoso central. Isto pode levar a infecções e sequelas, tais como convulsões, falha do shunt, meningite, sépsis e encefalite. As infecções podem ser prevenidas utilizando técnicas assépticas, quimioprofilaxia e/ou shunts de eluição de antibióticos. O tratamento de uma infecção de shunt pode incluir a remoção do hardware infectado, a colocação de um dispositivo de drenagem, e o uso de IV ou antibióticos intraventriculares.
hidrocefalia é uma condição caracterizada por acumulação de líquido cefalorraquidiano (LCR) nos ventrículos ou espaço subaracnóide no cérebro, levando a um aumento da pressão intraventricular e dilatação ventricular. Uma etiologia comum de hidrocefalia é a diminuição da drenagem do LCR.1,2 a ocorrência de hidrocefalia nos Estados Unidos e na Europa foi estimada em 0,5 a 0,8 por 1.000 nascimentos e é muitas vezes secundária à espinha bífida, hemorragia intracraniana, ou etiologia congênita.1,3 outras causas potenciais de hidrocefalia incluem mielodisplasia, tumores, meningite, quisto fossa posterior, malformação Dandy-Walker ou estenose aqueductal.4
manobras mecânicas é o tratamento primário para hidrocefalia. As colocações de shunt relacionadas com hidrocefalia são o procedimento neurocirúrgico mais comum realizado em crianças, mas também têm a maior taxa de falha.5 mais de 40.000 estágios de shunt são realizados anualmente nos Estados Unidos, com uma taxa de mortalidade inpatient estimada de 2,7%.5,6 a introdução da flora da pele comum e de outros patógenos, tanto perioperativamente como pós-operatório, pode levar a infecções do shunt e resultar em falha do shunt.
a taxa de infecções do shunt é estimada em 1, 6% a 16, 7% em doentes adultos, mas até 20% em doentes pediátricos.Pensa-se que este aumento da ocorrência na população pediátrica se deve à ausência de imunidade (particularmente <1 ano de idade), à prematuridade (<35 semanas de idade gestacional), à exposição a potenciais agentes patogénicos, às morbilidades concomitantes e a outros factores fisiológicos.3,4 doentes pediátricos tendem a desenvolver infecções do shunt mais cedo do que os adultos, com a maioria das infecções ocorrendo nos primeiros 30 a 60 dias após a colocação.1
os doentes com < 5 anos de idade e os adultos com idades compreendidas entre os 50 e os 59 anos parecem ter a maior incidência de infecções pelo shunt.1 Os factores de risco para a infecção pelo shunt podem incluir idade mais jovem, fuga no líquido cefalorraquidiano pós-operatório, hemorragia intraventricular, múltiplos shunts, cirurgia de revisão do shunt nos últimos 90 dias, shunts colocados imediatamente após a meningite, estadia hospitalar prolongada (>1 mês), e infecção anterior pelo shunt.2. 4. 7,8 complicações relacionadas com infecções do shunt incluem avarias do shunt, deficiência cognitiva de curto ou longo prazo, sépsis, meningite e internamento hospitalar prolongado.14,8
tipos de Shunt
os tipos mais comuns de shunts estão resumidos no quadro 1. Este artigo focará os dois shunts mais utilizados: ventriculoperitoneal (VP) e ventriculoatrial (VA) shunts. VP shunts, o mais comum dos dois, trabalhar desviando o LCR para o peritoneu, enquanto VA shunts deslocar o LCR para o átrio do coração.2,9,10

patogênese das infecções do Shunt
a contaminação do Shunt é muitas vezes causada quando a extremidade proximal do shunt entra em contato com a flora normal da pele. Isto pode ocorrer no pós-operatório devido a uma infecção da ferida ou perioperativamente durante a implantação cirúrgica.11 bactérias Gram-positivas, tais como Staphylococcus epidermidis coagulase-negativas e Staphylococcus aureus,são responsáveis por 45% a 60% 1-3, 12 e 20% a 33% 2,3 (com um relatório até 80% 4) de infecções pelo shunt, respectivamente. Estes agentes patogénicos estão estreitamente associados a infecções precoces do shunt (ocorrendo nas 4 semanas seguintes à cirurgia do shunt).2
podem ocorrer infecções tardias do shunt vários meses após a cirurgia do shunt e representam aproximadamente 15% das infecções relacionadas com o shunt.3 Em muitos casos, estas final de infecções podem ser causadas por bactérias gram-positivas, como o Streptococcus ou Enterococcus espécies, ou as bactérias gram-negativas, mais comumente Pseudomonas aeruginosa, se o paciente sofreu uma perfuração intestinal ou peritonite (principalmente visto em VP shunts).Os agentes patogénicos mais comuns associados às infecções do shunt estão resumidos na tabela 2.1-4. 11 infecções aumentam a probabilidade de complicações e falhas relacionadas com o shunt.

a prevenção de infecções pelo Shunt
os métodos utilizados para prevenir uma infecção pelo shunt incluem a utilização de técnica estéril, antibióticos sistémicos e cateteres impregnados de antibióticos. Demonstrou-se que a técnica cirúrgica asséptica ajuda a reduzir o risco de infecções do shunt. Um padrão de protocolo cirúrgico, incluindo pré lavagem do cabelo do paciente com clorexidina shampoo, duplo gloving por todos os membros da equipe cirúrgica e o uso de antibiótico impregnados de shunts (AIS), que foi implementado por quatro hospitais infantis demonstrado uma infecção que a taxa de redução de 8,8% para 5,7%.13
antibióticos profilácticos sistémicos podem ser utilizados durante o procedimento e nas primeiras 24 horas após a colocação do shunt. De acordo com uma meta-análise, a utilização de antibióticos sistémicos, profilácticos e cateteres impregnados de antibióticos reduziu a taxa de infecções do shunt.Este mesmo estudo comparou o uso de antibióticos sistémicos profilácticos versus placebo para a redução da infecção pelo shunt e concluiu que os antibióticos diminuíram as taxas de infecções pelo shunt (razão de probabilidade , 0, 52).Embora o antibiótico profilático mais apropriado para a colocação do shunt não tenha sido bem definido no passado, a maioria dos médicos usa cefazolina ou vancomicina IV para a profilaxia cirúrgica.2,14 diretrizes recentes recomendam cefazolina para procedimentos neurocirúrgicos de manobras com fluido, com clindamicina e vancomicina como alternativas para pacientes alérgicos.15
cateteres AIS têm sido comumente usados para prevenir infecções do shunt desde a sua introdução em 2002.16 a maioria dos dispositivos são impregnados com uma combinação de rifampicina e clindamicina.4, 16, 17 Eles são projetados para atingir a colonização de bactérias gram-positivas que produzem uma glicoproteína biofilme que adere à superfície do cateter.Uma meta-análise analisou o uso de cateteres impregnados de antibióticos versus cateteres padrão e descobriu que o uso de cateteres impregnados de antibióticos estava associado com taxas reduzidas de infecção pelo shunt (ou, 0.21). Concluiu-se nesta meta-análise que o uso de profilaxia antibiótica sistémica e de cateteres impregnados de antibióticos pode ser benéfico na redução de infecções do shunt.9
foi também realizado um ensaio retrospectivo em doentes pediátricos que tinham sido submetidos a inserção do shunt durante um período de 3 anos. Nos primeiros 18 meses, os pacientes receberam cateteres não impregnados de antibióticos; nos próximos 18 meses, qualquer novo paciente que necessitasse de colocação de shunt recebeu cateteres impregnados de antibióticos. Todas as crianças foram seguidas durante 6 meses após a colocação do shunt. As crianças com cateteres não impregnados de antibióticos tinham uma taxa de infecção de 12%, enquanto que a infecção foi observada em apenas 1,4% das crianças com cateteres impregnados de antibióticos.Uma revisão mais recente de 15 ensaios também concluiu que os cateteres revestidos a antibióticos reduzem a taxa de infecção clínica, particularmente em pacientes com cateteres de longo prazo, o que foi diferente de algumas análises anteriores.19
prevenir infecções do shunt através da profilaxia e a utilização de cateteres AIS demonstrou reduzir o custo dos cuidados prestados aos doentes.20 estima-se que o custo para tratar uma infecção de shunt pode variar de US $17,300 a US $48,454 por paciente, levando a um custo anual estimado hospital nos EUA de US $2 bilhões.16,17 embora cada cateter AIS custa uma média de US $400, a quantidade de dinheiro economizado pela prevenção de infecção e / ou reinfecção pode proporcionar economias significativas a longo prazo.Estas poupanças devem-se a uma diminuição de 2, 4 vezes da probabilidade de infecção e a uma diminuição do Tempo no hospital como resultado da infecção. Foi relatado que essas economias ascenderiam a mais de US $440 mil por 100 pacientes evitados.17
diagnosticar infecções do Shunt
os sintomas gerais de infecção do shunt incluem dor de cabeça, náuseas, vómitos, inflamação do local cirúrgico, alterações neurológicas, febre e convulsões.2, 3 manifestações clínicas específicas para o doente de infecções pelo shunt dependem do tipo de shunt implantado. Os shunts de VP podem estar associados a peritonite, anorexia, irritabilidade e dor abdominal, 8 enquanto os shunts de VA podem estar associados a septicemia e endocardite.2,3 se forem observadas manifestações clínicas tais como Alteração do estado mental, eritema em torno do local do shunt, fluido ao longo da trajectória do shunt, descarga purulenta, papiledema, fontanel saliente, rigidez nuca ou fuga evidente do LCR, o doente deve ser avaliado com análise do LCR, culturas de sangue e imagiologia cerebral.8
a análise do LCR preditiva para a infecção inclui aumento do número de glóbulos brancos, aumento das concentrações de proteínas e diminuição dos níveis de glucose; o LCR também deve ser cultivado e corado em grama. As culturas de sangue são indicadores mais úteis das infecções do VPA shunt, em oposição às infecções do VP shunt.A imagiologia Cerebral pode ser usada para identificar ventriculite ou evidência de obstrução do LCR. A imagem Abdominal também pode ser usada para identificar mau funcionamento do shunt de VP.
Opções de Tratamento
Atualmente, não existem diretrizes de prática para o tratamento de shunt infecções; no entanto, a remoção dos infectados hardware, a colocação de um ventricular externa de cérebros, culturas, e o tratamento com IV ou intraventricular antibióticos são mostrados para ser parte de um eficaz processo de gestão.2
recomendações actuais para o tratamento empírico da infecção do sistema nervoso central (SNC) na presença de um shunt recomenda a utilização de vancomicina IV em combinação com um agente com cobertura gram-negativa adequada, tais como cefepima, ceftazidima, cefotaxima ou meropenem. A capacidade de um medicamento para penetrar no LCR, bem como a atividade do antibiótico contra o biofilme bacteriano também são importantes a considerar para a escolha do antibiótico.Estes agentes devem ser administrados até que seja identificado o agente patogénico e determinado o tratamento definitivo.22,23 em um shunt VP, a ponta distal do shunt está dentro da cavidade peritoneal e é mais suscetível a bactérias gram-negativo; gentamicina pode ser adicionada para sinergia.2 a terapêutica antimicrobiana empírica e as recomendações posológicas para infecções pelo shunt estão resumidas no quadro seguinte. 3.2,18,22,23
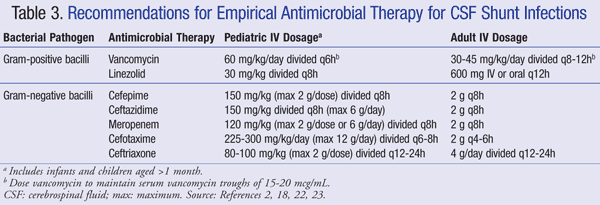
nos doentes refractários à terapêutica com vancomicina, a linezolida 10 mg/kg de 8 em 8 horas demonstrou ser eficaz como monoterapia em doentes pediátricos.A adição de rifampicina como terapêutica adjuvante também pode ser considerada devido à sua penetração no SNC.A duração da terapia antibiótica depende em grande parte da abordagem cirúrgica utilizada, do tipo de shunt e do agente patogénico envolvido, com um estudo relatando uma duração da terapia de 4 a 47 dias.25, 26 mais especificamente, foram sugeridos 7 a 10 dias para a duração do tratamento,23 com um ciclo mais longo (10-14 dias) recomendado para infecções gram-negativas.2
no caso de infecções complicadas ou resistentes ao tratamento do shunt, os clínicos devem considerar a administração intratecal ou intraventricular de antibióticos como um aumento da eficácia devido à sua capacidade para atingir concentrações bactericidas mais elevadas no SNC.23 vancomicina e gentamicina são comumente usados nesta situação; no entanto, não há recomendações definitivas sobre o seu uso.22, 23
infecções fúngicas do Shunt
uma infecção fúngica do shunt é considerada rara, sendo que um estudo relatou uma taxa de incidência de 0, 01%.Os agentes patogénicos mais comuns responsáveis por uma infecção fúngica pelo shunt são espécies Candida (incluindo albicanos C, parapsilose C e tropicalis C), que causam 75% dos casos fúngicos. Outros organismos incluem espécies de histoplasmose, Cryptococcus neoformans e Aspergillus. O tratamento primário para infecções fúngicas do shunt é a anfotericina B lipossómica 3 a 5 mg/kg/dia durante pelo menos 12 semanas.Para doentes intolerantes à anfotericina B, a 5-flucitosina pode ser uma alternativa.Este tratamento é frequentemente seguido por tratamento com fluconazol 600 a 800 mg/dia ou itraconazol 200 mg duas a três vezes por dia durante até 1 ano em doentes imunocompetentes e terapêutica potencialmente prolongada em doentes imunocomprometidos.27
conclusão
as infecções do Shunt são um factor de risco associado ao tratamento com hidrocefalia. A prevenção de infecções foi demonstrada com antibióticos empíricos e o uso de cateteres AIS, combinados com uma técnica asséptica adequada, para diminuir significativamente a taxa de infecção e reduzir o risco de sequelas comorbidas. Actualmente, não existem orientações para o tratamento de infecções do shunt; no entanto, recomenda-se uma terapêutica empírica IV envolvendo tanto a cobertura gram-positiva como a gram-negativa, como a vancomicina e uma cefalosporina de terceira geração. Os antibióticos intraventriculares também podem ser necessários para a concentração máxima do SNC bactericida.
1. Langley JM, Gravel D, Moore D, et al. Estudo de infecções associadas ao shunt do líquido cefalorraquidiano no primeiro ano após a colocação, pela Vigilância da infecção Nosocomial Canadiana. Infectar O Hospital De Controlo Epidemiol. 2009;30:285-288.
2. Wells DL, Allen JM. Infecções do shunt Ventriculoperitoneal em doentes adultos. AACN Adv Crit Care. 2013;24:6-12.
3. Lee JK, Seok JY, Lee JH, et al. Incidência e factores de risco de infecções do shunt ventriculoperitoneal em crianças: um estudo de 333 shunts consecutivos em 6 anos. J Medicina Coreana. 2012;27:1563-1568.
4. Parker SL, Attenello FJ, Sciubba DM, et al. Comparação da incidência da infecção pelo shunt em subgrupos de alto risco a receber shunts impregnados de antibióticos versus shunts padrão. Childs Nerv Syst. 2009;25:77-83.
5. Tratamento da hidrocefalia. Associação Hidrocefalia. www.hydroassoc.org/hidrocefalia-educação-e-apoio/aprendizagem-sobre-hidrocefalia/treatment-of-hidrocefalia/. Acessado Em 11 De Fevereiro De 2014.
6. Patwardhan RV, Nanda A. implantou shunts ventriculares nos Estados Unidos: o custo de bilhões de dólares por ano do tratamento com hidrocefalia. Neurocirurgiao. 2005;56:139-144.
7. Dallacasa P, Dappozzo a, Galassi E, et al. Infecções do shunt do líquido cefalorraquidiano em crianças. Childs Nerv Syst. 1995;11:643-648.
8. Rogers EA, Kimia a, Madsen JR, et al. Preditores de infecção do shunt ventricular entre crianças apresentando-se a um serviço de emergência pediátrico. Pediatra Emerg Care. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. profilaxia antibiótica para introdução cirúrgica de shunts ventriculares intracranianos. Cochrane Database Syst Rev. 2006; (3):CD005365.
10. Sistemas de derivação. Associação Hidrocefalia. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts. Accessed February 12, 2014.
11. KR para a frente, menos HD, Stiver HG. Infecção do shunt do líquido cefalorraquidiano. Uma revisão de 35 infecções em 32 doentes. J Neurocirurgia. 1983;59:389-394.
12. Lan CC, Wong TT, Chen SJ, et al. Diagnóstico precoce de infecções do shunt ventriculoperitoneal e anomalias em crianças com hidrocefalia. J Microbiol Immunol Infect. 2003;36:47-50.
13. Kestle JR, Riva-Cambrin J, Wellons JC, et al. Um protocolo padronizado para reduzir a infecção do shunt do líquido cefalorraquidiano: The Hydrocephalus Clinical Research Network Quality Improvement Initiative. Pediatra NeurocirurgiÃ. 2011;8:22-29.
14. Shah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Uso de vancomicina em pacientes pediátricos de Neurocirurgia. Controlo Da Infecção Am J 1999;27:482-487.
15. Bratzler DW, Dellinger EP, Olsen KM, et al. Clinical practice guidelines for antimicrobial profilaxis in surgery. Am J Health-Syst Pharm. 2013;70:195-283.
16. Parker SL, Anderson WN, Lilienfeld S, et al. Infecção do shunt Cerebrospinal em doentes a receber shunts impregnados de antibióticos versus shunts padrão. Pediatra NeurocirurgiÃ. 2011;8:259-265.
17. Attenello F, Garces-Ambrossi G, Zaidi H, et al. Custos hospitalares associados a infecções por shunt em doentes a receber cateteres de shunt impregnados de antibióticos versus cateteres de shunt padrão. Neurocirurgiao. 2010;66:284-289.
18. Sciubba DM, Stuart RM, McGirt MJ, et al. Efeito dos cateteres de shunt impregnados de antibióticos na diminuição da incidência da infecção de shunt no tratamento da hidrocefalia. J Neurocirurgia. 2005; 103 (suppl):131-136.
19. Babu MA, Patel R, Marsh WR, et al. Estratégias para diminuir o risco de infecções do cateter ventricular: uma revisão da evidência. Neurocrit Care. 2012;16:194-202.
20. Bratzler DW, Dellinger EP, Olsen KM, et al. Clinical practice guidelines for antimicrobial profilaxis in surgery. Infeção De Surg (Larchmt). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, et al. Tratamento com linezolida de infecções do líquido cefalorraquidiano relacionadas com o shunt em crianças. Pediatra NeurocirurgiÃ. 2010;5:443-448.
22. Tunkel AR, Hartman BJ, Kaplan SL, et al. Pratique orientações para a gestão da meningite bacteriana. Clin Infect Dis. 2004;39:1267-1284.
23. Van De Beek D, Drake JM, Tunkel AR. Meningite bacteriana Nosocomial. N Engl J Med. 2010;362:146-154.
24. Hedberg A, Hardemark HG, Olsson-Liljequist B, et al. Penetração do ácido fusídico e da rifampicina no líquido cefalorraquidiano em meningite inflamatória de baixo grau causada por Staphylococcus epidermidis. Infectar Clin Microbiol. 2004;10:765-768.
25. Profilaxia antimicrobiana para cirurgia. Treat Guidel Med Lett. 2004;2:27-32.
26. Simon TD, Hall M, Dean JM, et al. Reinfecção após infecção inicial do shunt do líquido cefalorraquidiano. Pediatra NeurocirurgiÃ. 2010;6:277-285.
27. Veeravagu A, Ludwig C, Camara-Quintana JQ, et al. Infecção fúngica do shunt ventriculoperitoneal: diagnóstico e tratamento da histoplasmose. World Neurosurg. 2013;80:222.e5-e13.
28. Chiou CC, Wong TT, Lin HH, et al. Infecção fúngica de shunts ventriculoperitoneal em crianças. Clin Infect Dis. 1994;19:1049-1053.