ackumulerande bevis tyder på att störningar i fosforylering/defosforyleringssignalering är associerade med patologiskt beteende hos celler. Fosfoproteomprojekt har identifierat nästan 300 000 fosforylerade Ser/Thr/Tyr-rester i cellulära proteiner . Parallellt avslöjade det mänskliga genomprojektet cirka 500 proteinkinaser. Ändå har ett begränsat antal proteinkinaser tilldelats varje fosforyleringsställe.
fosforyleringsanalysen i gel har varit en bekväm metod för att detektera proteinkinasaktiviteter i prover solubiliserade med SDS. Denna metod användes för identifiering av CaMKII, MYPT1-K (eller ZIPK) och andra . I detta analysprotokoll laddas proteinkinaser på en SDS-polyakrylamidgel inbäddad med en substratpolypeptid och utsattes sedan för renaturering, fosforylering med användning av radioaktivt ATP, följt av autoradiografi för att detektera fosforylerat substrat. Dessutom har autofosforylering av kinaser detekterats på nitrocellulosa eller polyvinylidenfluorid (PVDF) membran med användning av radioaktivt ATP . Det radioaktiva materialet kan vara en begränsning för användarna på grund av säkerhetsföreskrifter. Dessutom saknar autoradiogram av fosforylerade proteiner någon information om fosforyleringsställen.
här optimerade vi en icke-radioaktiv alternativ analys till den traditionella fosforyleringsanalysen i gel. Benämnd kinasaktivitet-taggad western blotting (KAT-WB), detekterar detta framgångsrikt Tyr-kinaser som autofosforylerar sig själva såväl som Ser/Thr-kinaser som fosforylerar ett substratprotein av intresse på en specifik plats med fosfo (P)-specifika antikroppar.
Figur 1 visar KAT-WB-data för Tyr-Kinas autofosforyleringsanalys. För att göra dubbla blottar laddades två alikvoter av ett extrakt på en SDS-polyakrylamidgel, utsattes för elektrofores, och sedan överfördes proteiner till ett ark av PVDF-membran (0,2 kcal). Membranet behandlades sekventiellt med buffrad 2-propanol, 6,0 m guanidinhydroklorid (Gu-HCl), 3,0 M Gu-HCl, 0,1 M Gu-HCl och renatureringsbuffert (se tilläggsprotokoll). Efter ett över natten renatureringssteg vid 4 c c skars membranet i längdriktningen för att generera två dubbla bitar (Figur 1). Ett stycke membran inkuberades för 60 min med 1 mM MgATP. Den andra delen av membranet inkuberades utan MgATP, som en kontroll. Båda arken utsattes samtidigt för immundetektion med anti-P-Tyr-antikropp (klon PY20 vid 1:5000 utspädning). Som visas i Figur 1 detekterades flera P-Tyr-band vid 100, 70, 45 och 35 kDa i kontrollmembranet (uppe till vänster). Dessa p-Tyr-proteiner var förmodligen redan fosforylerade före extraktion. Inkubationen med MgATP efter separation förhöjd Tyr-fosforylering av ett protein vid 45 kDa i hjärtmuskellysater (Figur 1, uppe till höger, körfält 2), vilket indikerar autofosforylering av Tyr-rester i detta Kinas på membranet efter renaturering. Figur 1 visar densitogram av körfält 2 (- /+MgATP). För att verifiera ekvivalent belastning av protein på de två blottarna utsattes filtren för coomassie-färgning (Figur 1, botten). En teknisk anmärkning är att vi under utvecklingen av metoden fann att behandlingarna med buffrad 2-propanol och 6M Gu-HCl båda var nödvändiga för detektering av kinasaktiviteter. Därför upptäckte KAT-WB ett 45-kDa Tyr-Kinas.

totala proteiner av musskeletmuskel (31 kg), hjärtmuskel (28 kg) och Neuro2a-celler (27 kg) utsattes för KAT-western blotting. Efter renaturering skars membranet i längdriktningen i två, och varje del inkuberades i 60 min vid 37 kcal C i frånvaro (vänster) eller närvaro (höger) av 1 mM ATP. Tyr-fosforylering detekterades med en konventionell elektrokemiluminescerande metod med användning av anti-P-Tyr-antikropp (top). Efter immunoblottingen visualiserades totala proteiner på varje fläck genom Coomassie-färgning (botten). Siffror till höger indikerar molekylvikter av markörproteiner (i kDa). En ruta till höger indikerar densitogram av körfält 2 i vänster och höger paneler. Nivåer av ljusstyrka och kontrast av blottar är identiska.
en annan version av KAT-WB använder platsspecifik fosforylering av ett substratprotein absorberat på PVDF-membran i närheten av Kinas. Vi använde fosfatas holoenzyme inhibitor – 1 (PHI-1) som ett protein av intresse, vars fosforylering vid Thr57 omvandlar detta cellulära protein till en hämmare av typ-1 Ser/Thr-fosfatas . Figur 2a visar KAT-WB-data med användning som en positiv kontrollrekombinant ZIPK, ett Ser/Thr-Kinas som är känt för att fosforylera rekombinant PHI-1 Vid Thr57 . Efter denatureringen och den stegvisa renatureringsprocessen blöts membranet över natten vid 4 kcal C i renatureringsbufferten kompletterad med rekombinant PHI-1 vildtyp (WT) eller en icke-fosforylerbar version (T57H) vid 0,2 mg/ml, och sedan kördes fosforyleringsreaktionen med MgATP. Fosforylerad PHI-1 på membranet detekterades med användning av anti-P-PHI-1 (Thr57) antikropp , och detta avslöjade ett band av den rekombinanta ZIPK. Emellertid detekterades endast en svag signal på kontrollmembranen utan PHI-1 eller med t57h-versionen av PHI-1. Dessa data tyder på att omättade kinaser på membranet kan fosforylera substrat som också absorberas på membranet. KAT-WB applicerades för att detektera flera PHI-1-kinaser i vävnader och celler (Figur 2B). Extrakt från råttskelett, hjärtmuskler och Neuro2a-celler utsattes för Kat-WB-analys. Jämfört med No-ATP-kontroll (vänster, topp) uppträdde signaler av P-PHI-1 på fläcken inkuberad med 1 mM MgATP (höger, topp). Framstående band av P-PHI-1 detekterades i Neuro2a-celllysater vid 100, 60 och 49 kDa (körfält 3, Öppet pilhuvud). Inga band för P-PHI-1 var emellertid uppenbara i körfältet med extrakten av skelett-och hjärtmuskler (körfält 1 och 2). P-PHI-1-signalen förstärktes inte av fosforyleringssteget utan PHI-1 (Figur 2, botten, blank: BLK). Dessa resultat visar att det finns flera PHI-1-kinaser uttryckta i neuronala celler men inte i skelett-eller hjärtmuskler. Detta ger oss ett kraftfullt verktyg för att detektera flera substratspecifika kinaser i celler och vävnader. En teknisk anmärkning är att renatureringen över natten med PHI-1 var nödvändig för detektering av fosforyleringssignalerna och att en högre koncentration av PHI-1 inte ökade färgningsintensiteten (visas inte).
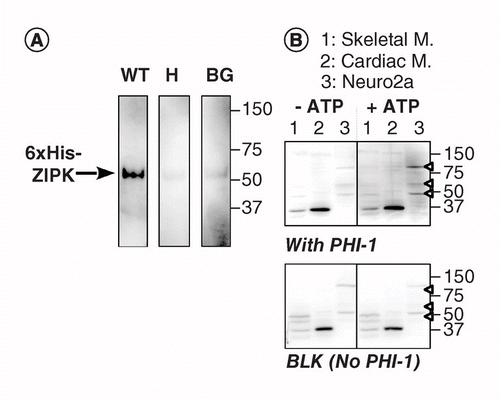
(A) tredubbla blottar framställdes med användning av rekombinant ZIPK delvis renad från lysater av celler som uttrycker en 6 msk His-taggad version. Efter elektroblottning och denaturerings–renatureringsprocessen inkuberades membranet över natten med rekombinanta PHI-1-proteiner (WT: vänster; T57H: centrum) vid 0,2 mg/ml eller utan PHI-1 (BG). Varje membran inkuberades sedan med 1 mM ATP vid 37 CCG och utsattes för immundetektion med användning av anti-P-PHI-1 (T57) antikropp. (B) två dubbla blottar (topp och botten) framställdes med användning av totala proteinprover, såsom beskrivs i Figur 1. Rekombinant PHI-1 (0,2 mg/ml) tillsattes till renatureringsbufferten för en fläck (topp). BLK indikerar blot utan rekombinant PHI-1-Behandling. Efter inkubation i frånvaro (vänster) och närvaro (höger) av 1 mM ATP utsattes blottarna för immundetektion med användning av anti-P-PHI-1 (Thr57). Pilspetsar till höger anger placeringen av P-PHI-1 i övre högra panelen. Nivåer av ljusstyrka och kontrast av blottar är identiska.
BG: Bakgrund; WT: vildtyp.
baserat på dessa data föreslår vi att KAT-WB kan detektera autofosforylering av Tyr-kinaser och platsspecifik fosforylering av selektiva substratproteiner av intresse av flera proteinkinaser närvarande i vävnader och celler. KAT-WB delar i huvudsak fördelar med den traditionella fosforyleringsanalysen i gel, som detekterar kinasaktiviteter i en råblandning, såsom cellextrakt, som exponerar deras molekylära storlekar . En annan fördel med dessa två analyser är att post-translationella modifieringar (PTM) av kinaser i celler kan bevaras vid en önskad tidpunkt under specifika betingelser, eftersom proverna för dessa analyser snabbt denatureras med bufferten, inklusive SDS, vilket eliminerar fosforylering och defosforylering i extrakten . De flesta proteinkinaser regleras genom PTM. KAT-WB kan övervaka fluktuationer i kinasaktiviteter, även om regulatoriska PTM: er ännu inte har karakteriserats. KAT-WB kan inte detektera varje Kinas i cellextrakt eftersom endast monomera enzymer som renaturerar effektivt under de förhållanden som används visar aktivitet. Modifieringar av KAT-WB bör emellertid kunna detektera kinaser reglerade av kalmodulin och cykliner, eftersom det har gjorts genom fosforyleringsanalys i gel . Förbättring av renatureringseffektivitet och en kombination med immunutfällning/immunodepletion med antikroppar för kinaser kan utöka nyttan av tillvägagångssättet.
det är anmärkningsvärt att förutom fosforylering kan principen för KAT-WB-protokollet tillämpas för detektion av andra PTM-enzymer, såsom acetylaser, metylaser och ubiquitinligaser, när PTM-specifika antikroppar är tillgängliga. Tillsammans med utvecklingen av antikroppar som känner igen platsspecifika PTM, kommer forskningsmål som omfattas av aktivitetsmärkt western blotting att utökas.
Författarbidrag
M eto, s Katsuki, y Tanaka och K Takeya utformade och utformade experimenten. S Katsuki, y Tanaka och K Takeya genomförde analyserna. M eto, s Katsuki, y Tanaka och K Takeya utförde dataanalysen. M eto, s Katsuki, y Tanaka och K Takeya skrev tidningen.
bekräftelser
författarna vill tacka DL Brautigan för korrekturläsning av manuskriptet och för värdefulla förslag.
Financial & konkurrerande intressen disclosure
detta arbete stöds av JSPS KAKENHI (JP19K06573 och JP19H03125) och samhället för forskning om Umami smak, medel från Imabari city och Ehime prefecture, och en gåva från H Awagi. Författarna har inga andra relevanta anslutningar eller ekonomiskt engagemang med någon organisation eller enhet med ekonomiskt intresse i eller ekonomisk konflikt med ämnet eller materialet som diskuteras i manuskriptet bortsett från de som avslöjas.
ingen skrivhjälp användes i produktionen av detta manuskript.
Open access
detta verk är licensierat enligt Attribution-NonCommercial-NoDerivatives 4.0 Unported licens. För att se en kopia av denna licens, besök http://creativecommons.org/licenses/by-nc-nd/4.0/
- 1. Han är en av de mest kända. PhosphoSitePlus, 2014: mutationer, PTM och omkalibreringar. Nukleinsyror Res. 43, D512–D520 (2015).Crossref, Medline, CAS, Google Scholar
- 2. Celenza JL, Carlson M. Renaturering av proteinkinasaktivitet på proteinblottar. Metoder Enzymol. Akademisk Press, Cambridge Massachusetts, 34, 423-430 (1991).Crossref, Google Scholar
- 3. Hutchcroft JE, Anostario M, Harrison ML et al. Renaturation and assay of protein kinases after electrophoresis in sodium dodecyl sulfate–polyacrylamide gels. Methods Enzymol. Academic Press,Cambridge Massachusetts, 33, 417–423 (1991).Crossref, Google Scholar
- 4. Kameshita I, Fujisawa H. A sensitive method for detection of calmodulin-dependent protein kinase II activity in sodium dodecyl sulfate-polyacrylamide gel. Anal. Biochem. 183(1), 139–143 (1989).Crossref, Medline, CAS, Google Scholar
- 5. Shackelford DA, Zivin JA. Renaturering av kalcium / kalmodulinberoende proteinkinasaktivitet efter elektroforetisk överföring från natriumdodecylsulfat-polyakrylamidgeler till membran. Anal. Biochem. 211(1), 131–138 (1993).Crossref, Medline, CAS, Google Scholar
- 6. Macdonald JA, Borman MA, Muranyi A et al. Identifiering av det endogena myosinfosfatasassocierade kinaset med glatt muskulatur. Proc. Natl Acad. Sci. USA 98(5), 2419-2424 (2001).Crossref, Medline, CAS, Google Scholar
- 7. Wooten MW. In-gel-kinasanalys som en metod för att identifiera kinasubstrat. Sci. STKE 2002 (153), pl15 (2002).Medline, Google Scholar
- 8. Celenza J, Carlson M. en jästgen som är nödvändig för frisättning från glukosrepression kodar för ett proteinkinas. Vetenskap 233(4769), 1175-1180 (1986).Crossref, Medline, CAS, Google Scholar
- 9. Eto M, Karginov A, Brautigan DL. En ny fosfoproteinhämmare av proteintyp-1-fosfatas holoenzymer. Biokemi 38(51), 16952-16957 (1999).Crossref, Medline, CAS, Google Scholar
- 10. Macdonald JA, Eto M, Borman MA et al. Dubbel ser-och thr-fosforylering av KPI-17, en hämmare av myosinfosfatas, av MYPT-associerat Kinas. FEBS Lett. 493(2–3), 91–94 (2001).Crossref, Medline, CAS, Google Scholar
- 11. Eto M, Leach C, Tountas NA et al. Fosfoproteinhämmare av proteinfosfatas-1. Metoder Enzymol. 366, 243–260 (2003).Medline, CAS, Google Scholar
- 12. Han är en av de mest kända. Reglering av M2 muskarinreceptorgenuttryck med trombocyt-härledd tillväxtfaktor: involvering av extracellulära signalreglerade proteinkinaser i nedregleringsprocessen. Mol. Pharmacol. 52(6), 966–973 (1997).Crossref, Medline, CAS, Google Scholar