Les prostaglandines présentent un large éventail d’effets biologiques et leurs actions sont parmi les plus variées de tous les composés naturels. Malgré cette observation, ce groupe de lipides présente une spécificité structure-activité marquée, qui est déterminée principalement par les substitutions du cycle cyclopentanone et le degré d’insaturation des chaînes latérales de l’acide prostanoïque. La réponse cellulaire aux prostaglandines est médiée par leur interaction avec les récepteurs de la membrane plasmique.Les récepteurs PG
ont été initialement classés sur la base des activités fonctionnelles des agonistes naturels et synthétiques, et les antagonistes ont été classés dans les catégories suivantes: DP, EP, FP, IP et TP. La première lettre désigne le type de prostaglandine, et la lettre P signifie « prostanoïde. »30 Plus tard, des études par analyse de liaison et clonage moléculaire ont confirmé la présence de types de récepteurs distincts ainsi que de trois ou quatre sous–types d’EP (EP1-4). Les récepteurs des prostaglandines de la membrane plasmique appartiennent à la superfamille des récepteurs couplés aux protéines G caractérisés par sept régions transmembranaires.31 Les seconds messagers intracellulaires des récepteurs des prostaglandines comprennent l’AMPc, la protéine kinase C et le calcium.30,31 Les différents récepteurs présentent une spécificité remarquable pour l’eicosanoïde, avec une préférence au moins 100 fois pour le ligand. À des concentrations élevées, PGE2 et PGF2a interagissent avec le récepteur DP; de même, PGF2a activera le récepteur EP, tandis que PGD2 et PGE2 interagiront avec le récepteur FP à des concentrations élevées. La plupart des tissus contiennent un mélange de récepteurs, qui semble être à la base des effets souvent opposés d’une prostaglandine particulière à différentes doses.
Rôle des prostaglandines dans la sécrétion des gonadotrophines
Des données récentes impliquant un rôle physiologique des prostaglandines dans la régulation de la sécrétion de l’hormone de libération des gonadotrophines (GnRH) ont été publiées.32,33 Un certain nombre de rapports suggèrent maintenant que les prostaglandines, en particulier la PGE2, exercent une influence stimulatrice sur la libération de gonadotrophines, un effet qui semble être médié par une action au niveau de l’hypothalamus. Il a été démontré que la PGE2 stimule la libération de GnRH par l’hypothalamus, et un prétraitement des animaux avec des antisérums pour neutraliser la GnRH endogène empêche la libération de LH induite par la PGE2.34 De plus, la PGE1 et la PGE2 semblent être les stimulateurs les plus puissants de la libération d’hormone de croissance par les cellules adénohypophysaires cultivées.35 PGB, PGA1, PGA2, PGB2, PGF1 et PGF2 sont également des stimulateurs actifs, mais leurs effets ne sont pas observés aux doses physiologiques. En général, les prostaglandines ne semblent pas stimuler la sécrétion de gonadotrophines par une action directe sur l’hypophyse.
D’autres preuves suggérant que les prostaglandines pourraient affecter la sécrétion de gonadotrophines (en agissant directement sur l’hypothalamus) sont fournies par des études utilisant des inhibiteurs de la prostaglandine synthétase, tels que l’indométacine, qui réduisent apparemment la sécrétion de gonadotrophines.36 Le fait que les prostaglandines agissent au moyen de facteurs de libération hypothalamique est évident sur la base de deux observations:
- Le prétraitement de rats femelles et mâles avec de l’antisérum à l’hormone libérant la LH (LHRH) a altéré la capacité de la PGE2 (100 mg par rat) à augmenter la sécrétion de LH.36
- L’administration directe de PGE2 dans le ventricule du cerveau du rat a imité l’effet intraveineux des prostaglandines sur la stimulation de la sécrétion de gonadotrophines.36
D’autres résultats fournissent un appui convaincant au concept selon lequel la PGE2 agit au niveau de l’éminence médiane pour provoquer la libération de LHRH. Cette affirmation est encore corroborée par la découverte que le tissu d’éminence médiane contient de plus grandes quantités de prostaglandines endogènes que les régions hypothalamiques basales. Les données obtenues à partir d’incubations in vitro de fragments d’éminence médiane obtenus à partir de rats mâles ont montré que la noradrénaline et la dopamine stimulent la libération simultanée de LHRH et de PGF2a. Cet effet est bloqué par l’indométacine, ce qui suggère que les prostaglandines produites par voie intraneuronale sont les médiateurs de la libération de LHRH stimulée par la catécholamine. Ces résultats intéressants sont discutés plus en détail dans une revue par Ojeda et ses collègues.36
Ovulation et prostaglandines
Après la découverte que l’indométacine et l’aspirine (inhibiteurs de la synthèse des prostaglandines) pouvaient bloquer l’ovulation,33,37 il a été suggéré que les prostaglandines étaient impliquées dans le processus de rupture folliculaire ovarienne. Cette affirmation a été renforcée par la découverte que l’injection intra-ovarienne d’antisérum PGF2a inhibait également l’ovulation.38 Il existe maintenant une quantité substantielle de preuves indiquant que la formation de prostaglandines folliculaires est améliorée pendant l’ovulation et que cette élévation dépend des gonadotrophines.39
La poussée de gonadotrophines à mi-cycle stimule la biosynthèse des eicosanoïdes folliculaires par un processus médié par l’AMPc qui dépend de l’activation des gènes, mais indépendant de la stéroïdogenèse. La LH semble être la gonadotrophine hypophysaire physiologique dominante responsable de l’induction de l’ovulation, et il semble probable que les effets de la LH sur la rupture folliculaire puissent être médiés par les leucocytes qui sécrètent des enzymes protéolytiques, des radicaux oxygénés et des prostaglandines. L’indométacine, par exemple, bloquera l’ovulation normalement induite par de fortes doses de gonadotrophine chorionique humaine in vivo. Les prostaglandines peuvent médier les effets stimulateurs de la LH sur les « enzymes ovulatoires », telles que la protéase ou la collagénase.40 Il est également possible que les prostaglandines provoquent une réponse contractile dans la paroi du follicule, 41 qui est maintenant connue pour contenir des éléments contractiles, tels que la myosine et l’actine. L’activateur du plasminogène ou une autre protéase semble être intrinsèquement impliqué dans la rupture du follicule,42 et il est évident que la sécrétion de cette protéine est associée à l’augmentation induite par la LH de la biosynthèse des prostaglandines folliculaires, bien qu’il ait été souligné que ces deux événements peuvent ne pas être interdépendants. Un mécanisme possible d’action des prostaglandines dans la rupture folliculaire est illustré à la figure 6.
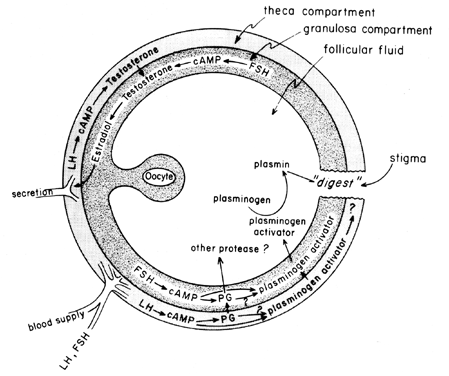 Fig. 6. Mécanisme possible d’action de la prostaglandine dans la rupture folliculaire.(Behrman HR: Prostaglandines dans la fonction hypothalamo-hypophysaire et ovarienne. Ann Rev Physiol 41:685, 1979)
Fig. 6. Mécanisme possible d’action de la prostaglandine dans la rupture folliculaire.(Behrman HR: Prostaglandines dans la fonction hypothalamo-hypophysaire et ovarienne. Ann Rev Physiol 41:685, 1979)
Rôle des prostaglandines dans la fonction lutéale: Lutéolyse et Menstruations
Le mécanisme par lequel le corps jaune humain régresse 10 à 12 jours après sa formation est un mystère. Depuis la découverte précoce que PGF2a était lutéolytique chez le rat et de nombreuses autres espèces subprimées,43 un effort de recherche majeur a été fait pour étudier la possibilité d’une régulation menstruelle avec PGF2a.PGF2a induit une régression fonctionnelle du corps jaune par un processus médié par les récepteurs, indépendant initialement des modifications du flux sanguin ovarien ou lutéal.32 En quelques minutes, PGF2a épuise l’acide ascorbique, 44 découple le récepteur de la LH occupé de l’adénylate cyclase et diminue le transport de la gonadotrophine des capillaires vers la cellule lutéale.
Un examen de la littérature pertinente révèle de nombreux rapports contradictoires sur les effets de PGF2a chez l’homme. Certaines études ont enregistré des baisses transitoires des taux circulants de progestérone par PGF2A45, bien que d’autres études n’aient pas démontré un tel effet chez les femmes qui ovulent normalement.46,47 Compte tenu de l’existence de récepteurs présumés de PGF2a dans le corps jaune humain,48 on a estimé que l’échec de la lutéolyse avec des perfusions intraveineuses de PGF2a était peut-être dû à un métabolisme pulmonaire rapide. Des études ultérieures impliquant l’injection directe de PGF2a dans le corps jaune humain ont induit un retrait de la progestérone, dont le nadir a coïncidé avec l’apparition des règles précoces.49 Ces résultats suggèrent que des prostaglandines ovariennes endogènes (ou un autre agent lutéolytique) peuvent être nécessaires à la régression lutéale. Cela semble réalisable compte tenu de l’observation que la fonction lutéale humaine semble indépendante du contrôle utérin, car ni l’hystérectomie 50 ni l’absence congénitale de l’utérus, du vagin ou des trompes de Fallope n’affectent la cyclicité ovarienne.51 Le tissu lutéal humain est certainement capable de produire des prostaglandines, comme le montrent les expériences in vitro 52; cependant, les tentatives visant à corréler l’augmentation des taux de PGF2a dans l’ovaire avec la régression lutéale en phase lutéale tardive n’ont pas abouti.53 Il semble que le seul moment où la production ovarienne de PGF2a est améliorée dans le cycle menstruel humain est peu de temps après l’ovulation.54 Il est également évident, cependant, que les concentrations de PGF2a sont toujours plus élevées dans le tissu stromal ovarien pendant les phases lutéales précoces, médianes et tardives.
Contrairement aux effets in vivo de PGF2a, des études in vitro ont démontré des effets lutéolytiques transitoires et durables dans le tissu lutéal humain.55,56,57 Il est généralement admis qu’un événement précoce de la lutéolyse induite par PGF2a est l’abrogation de la production d’AMPc sensible aux gonadotrophines provenant d’études dans le corps jaune du rat.58,59 Cette abrogation est susceptible de se faire par une inhibition directe de l’adényl cyclase par augmentation du Ca2+ intracellulaire.60 Des preuves récentes du domaine des neurosciences indiquent que les prostaglandines stimulent la libération de Ca2 + intracellulaire en augmentant l’hydrolyse du phosphoinositol en diacylglycérol et en triphosphate d’inositol.61 Conformément aux résultats obtenus chez des animaux de laboratoire, il a été démontré que la régression du corps jaune humain est également associée à une perte des récepteurs de la LH.62
Il est bien connu que le corps jaune nouvellement formé de nombreuses espèces est réfractaire à l’action lytique de PGF2a63; cette observation semble également s’étendre au corps jaune humain.64 Henderson et McNatty65 ont suggéré que les récepteurs PGF2a du corps jaune nouvellement formé pourraient être masqués par des récepteurs de LH occupés, et que la dissociation progressive de la LH de son récepteur pourrait augmenter la sensibilité du corps jaune à PGF2a. Une hypothèse alternative a été proposée par d’autres investigateurs,65 qui suggèrent que la sensibilité du corps jaune humain à PGF2a peut dépendre des niveaux de noradrénaline ovarienne, qui augmentent pendant la phase lutéale. Cette augmentation des catécholamines semble permettre l’effet antigonadotrope de PGF2a sur le corps jaune humain.66
Prostaglandines dans l’utérus
Contrairement au myomètre, qui produit principalement PGI2, l’endomètre non enceinte produit principalement PGF2a et PGE2. La synthèse des prostaglandines est plus importante dans l’épithélium glandulaire que dans le stroma de l’endomètre et pendant la phase sécrétoire que pendant la phase proliférative du cycle.67,68 PGF2a et PGE2, par leur interaction avec des récepteurs spécifiques, sont connues pour stimuler la contractilité myométriale, entraînant une augmentation du Ca2+ intracellulaire. Un tel mécanisme d’hypercontractilité utérine induite par les prostaglandines a été impliqué dans la pathogenèse de la dysménorrhée primaire. Des taux élevés de PGF2a et de PGE2 ont été identifiés dans l’endomètre et le liquide menstruel des femmes atteintes de dysménorrhée, et il a été démontré que les agents antiprostaglandines entraînaient une réduction marquée de la douleur chez ces patientes.
Diverses prostaglandines sont également produites dans le col utérin, et des sites récepteurs de la PGE et de la PGF sont présents dans le col utérin.69 L’augmentation de la production de prostaglandines, ou leur administration locale, est associée à la maturation cervicale chez la femme enceinte.69
Prostaglandines et parturition
Un certain nombre d’observations impliquent indirectement l’implication des prostaglandines dans la parturition. On sait, par exemple, que l’administration d’indométacine ou d’autres anti-inflammatoires non stéroïdiens, tels que l’aspirine, prolonge la gestation.69 De plus, les prostaglandines, en particulier la PGF2a, sont connues pour être de puissants stimulateurs de la contractilité utérine et induire des contractions cycliques de l’utérus gravide. Des concentrations élevées de prostaglandines sont associées à l’apparition d’un travail spontané chez l’homme. De plus, la période précédant le début des contractions est caractérisée par des taux plasmatiques de PGF2a équivalents à ceux des femmes non enceintes. La vaccination contre PGF2a retarde également le début de la parturition.70 prostaglandines sont maintenant utilisées pour induire le travail précoce et l’avortement; en effet, la prostaglandine est le médicament de choix pour la réalisation d’avortements à mi-trimestre.69,71
D’après des études approfondies chez le mouton, il apparaît que les prostaglandines synthétisées localement dans l’utérus initient le travail en agissant directement sur le myomètre pour favoriser les contractions utérines. Une diminution de la progestérone placentaire locale, combinée à une augmentation des œstrogènes, entraîne la libération de Ca2 + à partir de lysosomes devenus fragiles. Cette libération de Ca2+ stimule la synthèse des prostaglandines en augmentant l’activité des phospholipases. L’ocytocine semble faciliter, plutôt que d’initier, les effets des œstrogènes et de la progestérone.72 Membranes fœtales, decidua vera et myomètre peuvent toutes participer à la formation des prostaglandines.73,74
Une proposition récente est que la production de prostaglandines par le tissu intra-utérin est inhibée toniquement pendant la grossesse humaine et que cette inhibition est progressivement supprimée à l’approche du terme. Bien que les mécanismes d’inhibition tonique de la synthèse des prostaglandines n’aient pas été établis, plusieurs peptides antiphospholipases ont été trouvés dans le placenta humain, l’amnion, le 75 et le chorion.76 Une autre possibilité est que la synthèse des prostaglandines soit stimulée parallèlement à l’élimination de l’inhibition de la synthèse. Les signaux potentiels pour une synthèse accrue des prostaglandines sont plusieurs facteurs de croissance et un facteur d’activation plaquettaire. Les tissus pulmonaires et rénaux fœtaux sécrètent un facteur d’activation des plaquettes, capable de stimuler la production de prostaglandines par l’amnios humain.77
Prostaglandines et le canal artériel
Le maintien de la perméabilité (relaxation de la vasodilatation) du canal artériel est essentiel pour contrôler l’oxygénation des tissus chez le fœtus. Après la naissance, le canal artériel se rétrécit normalement ou perd sa perméabilité. Le mécanisme par lequel cette fermeture se produit n’est pas clair, bien que la tension de l’oxygène dans le sang soit considérée comme un facteur important (Fig. 7). La fonction principale du canal artériel chez le fœtus est de maintenir un certain degré de dérivation du sang artériel de gauche à droite, contrôlant ainsi la quantité de retour veineux vers les poumons. La fermeture du canal à terme est un processus physiologique important qui, s’il est incomplet, entraîne une détresse respiratoire et des syndromes de cyanose / hypoxie responsables de la morbidité et de la mortalité élevées chez de nombreux prématurés souffrant de canal artériel patent. Pour cette raison, il y a beaucoup d’intérêt pour le ou les mécanismes de contrôle de la fonction du canal artériel. Cet intérêt est particulièrement aigu dans le domaine de la recherche sur les prostaglandines, dans lequel il existe maintenant une quantité considérable de preuves suggérant l’implication des prostaglandines dans le contrôle de la perméabilité du canal artériel à terme.
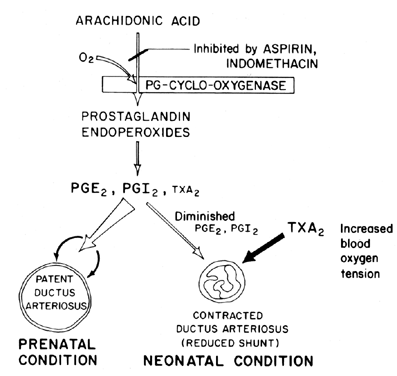 Fig. 7. Schéma de modulation des prostaglandines de la perméabilité du canal artériel chez le fœtus et le nouveau-né en fonction de la tension de l’oxygène.
Fig. 7. Schéma de modulation des prostaglandines de la perméabilité du canal artériel chez le fœtus et le nouveau-né en fonction de la tension de l’oxygène.
Cette preuve est basée sur la série d’observations suivantes:
Le canal artériel chez le fœtus présentant une détérioration cardiopulmonaire et une maladie de la membrane hyaline peut être fermé par l’administration d’inhibiteurs de la prostaglandine synthétase.78
L’indométacine peut induire une contraction du vaisseau hypoxique, comme en témoignent ses effets sur les animaux à court terme.79
L’administration de PGE2 (et de PGE1) induit une relaxation (perte de perméabilité) des préparations isolées du canal artériel de l’agneau foetal (bandes circulaires) dans un environnement pauvre en oxygène (PO2 inférieur à 14 mmHg).80
Il semble probable que les prostaglandines de la série E, ainsi que les antagonistes des prostaglandines et les bloqueurs de la prostaglandine-synthétase (aspirine), puissent s’avérer être des traitements non chirurgicaux souhaitables pour les prématurés présentant un canal artériel patent potentiellement mortel. Des preuves récentes suggèrent un équilibre entre la perméabilité du canal et la constriction qui est maintenu par la synthèse de prostaglandines dilatantes (PGI2 et PGE2) et de prostaglandines constrictrices (TXA2). Chez le fœtus d’agneau, le canal artériel et le poumon synthétisent PGI2 et PGE2; puis, à l’approche du terme, le poumon se déplace vers la synthèse de TXA2.81 De plus amples informations sur l’implication des prostaglandines dans le contrôle de la fonction du canal artériel sont disponibles.82