US Pharm. 2006;7:58-68.
a szívelégtelenség súlyos egészségügyi probléma az Egyesült Államokban. Körülbelül ötmillió embernek van szívelégtelensége, és évente 550 000 beteget diagnosztizálnak szívelégtelenséggel.1,2 a szívelégtelenséget általában az idősek betegségeként jellemzik; a szívelégtelenségben kórházba került betegek körülbelül 80% – a 65 évesnél idősebb. Így a szívelégtelenség előfordulása várhatóan növekszik a népesség öregedésével.2 a szívelégtelenséggel összefüggő kórházi kezelések száma körülbelül 25% – kal, több mint egymillióra nőtt 1990 és 1999 között. 2001-ben a szívelégtelenség közvetlenül 53 000 halált okozott. A szívelégtelenséggel összefüggő halálesetek száma az elmúlt években emelkedett,ami a korábbi kardiovaszkuláris események túlélésének növekedésének tulajdonítható.
a szívelégtelenség olyan klinikai szindróma, amelyben funkcionális vagy szerkezeti változások következnek be a szívben, ami olyan klinikai tüneteket eredményez, mint a dyspnoe, a fáradtság, a korlátozott terhelési tolerancia, a pulmonalis torlódás és a perifériás ödéma.1-3 számos ismert kockázati tényező, mint például a koszorúér-betegség (CAD), a cukorbetegség, az elhízás, a magas vérnyomás és a cardiomyopathiák családi anamnézisében a szívelégtelenség kialakulása és progressziója társul (1.táblázat).4 ezenkívül a szívbillentyű-betegség továbbra is a szívelégtelenség gyakori oka. A magas vérnyomás az idő körülbelül 90% – ában megelőzi a szívelégtelenséget, és háromszorosára növeli a beteg szívelégtelenség kockázatát.5 a CAD a szisztolés szívelégtelenség leggyakoribb oka. A miokardiális infarktus (MI) a szisztolés szívelégtelenséget a betegek közel 70% – ában okozza. A szisztolés diszfunkcióval és a szívelégtelenséggel kapcsolatos további etiológiák közé tartozik a dilatált cardiomyopathiák és a kamrai hipertrófia.2,4

patofiziológia
a szisztolés szívelégtelenség a bal kamrai kontraktilitás károsodásával jár, amely nem hatékony szívteljesítményt eredményez, különösen terhelés alatt. A szívelégtelenség általában a szívizom valamilyen sérülésével vagy stresszével kezdődik, amely a szív szerkezetének megváltozását eredményezi; ezt szívátalakításnak nevezik. A szív átalakulása hónapokkal vagy akár évekkel megelőzi a tünetek megjelenését. Mivel a tágulás megváltoztatja a kamrát egy gömb alakú alakra, a hemodinamikai feszültségek elkezdenek megterhelni a hibás kamra falát, ami depressziós mechanikai funkcióhoz és fokozott regurgitáns áramláshoz vezet a mitrális szelepen keresztül.1-3
a neurohormonális rendszer aktív szerepet játszik a szív átalakulásának felgyorsításában. Szívelégtelenségben szenvedő betegeknél emelkedett a noradrenalin, az angiotenzin II, az aldoszteron, az endotelin, a vazopresszin és a citokinek szintje. A renin-angiotenzin-aldoszteron rendszer aktiválása fokozza a perifériás érszűkületet, ami fokozott utóterhelést és szívátalakulást eredményez. Ezenkívül a szimpatikus idegrendszer aktiválása tachycardiát okoz, ami fokozott szívizom oxigénigényhez vezet. A megnövekedett szív oxigénigény a kínálat változása nélkül fokozott myocardialis ischaemiát és további szívátalakulást okozhat. A neurohormonok kardiotoxikus hatást fejthetnek ki a sejtekre, ami tovább változtathatja a szív felépítését és teljesítményét.2
klinikai megjelenés
a szisztolés szívelégtelenség egy olyan szindróma, amelyet a beteg anamnéziséből gyűjtött adatok alapján diagnosztizálnak, beleértve a tünetek értékelését és a fizikai leleteket. A legtöbb beteg háromféle módon jelenik meg: csökkent testmozgási toleranciával, folyadékretencióval vagy tünetek nélkül.2,6 a szívelégtelenség kardinális tünetei az erőkifejtés és a légszomj. Fizikális vizsgálat esetén perifériás ödéma, pulmonalis torlódás vagy mindkét tünet jelen lehet.2
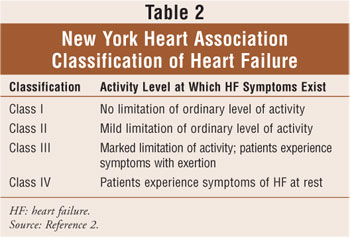
a szívelégtelenség osztályozása az American College of Cardiology/American Heart Association szívelégtelenség négy szakaszának kombinációján alapul (1.táblázat), amelyek a szívműködési zavar kockázatától (a stádium) a refrakter szívelégtelenségig (d stádium), valamint a New York Heart Association (NYHA) irányelvein alapulnak.2,6 a NYHA osztályozás a leggyakrabban használt módszer a szívelégtelenség által okozott funkcionális korlátozás mértékének számszerűsítésére (2.táblázat). Összességében a szívelégtelenség funkcionális osztályozása az idő múlásával csökken a szív átalakulásának progressziója miatt.2
az egyetlen leghasznosabb diagnosztikai teszt az átfogó kétdimenziós echokardiogram, amelyet a Doppler áramlási vizsgálatokkal együtt használnak annak meghatározására, hogy vannak-e szerkezeti és funkcionális rendellenességek a szívben. A transthoracikus echokardiogram (TTE) egy nem invazív ultrahangvizsgálat, amely hanghullámok segítségével képeket készít a szívről. Információt nyújt a bal kamrai ejekciós frakció (LVEF) becsléséről, a kamrai méretekről és térfogatokról, a faltérfogatokról, a szívkamra geometriájáról és a regionális falmozgásról. Szisztolés szívelégtelenségben szenvedő betegeknél az LVEF általában kevesebb, mint 40%.2 a TTE-vel együtt a szívelégtelenség etiológiájának, súlyosságának és lehetséges gyógyszeres kezeléssel összefüggő hatásainak felmérésére alkalmazott egyéb vizsgálatok közé tartozik a kiindulási mellkasröntgen, a 12-ólom elektrokardiográfia, valamint az agyi natriuretikus peptid, a szérum elektrolitok és a vesefunkció mérése. Ezek a vizsgálatok azért fontosak, mert az egészségügyi szakemberek kiindulási alapként használhatják őket annak meghatározására, hogy a beteg megváltozott-e a klinikai állapotban.2,6
szisztolés szívelégtelenség kezelése
nem farmakológiai
a kockázati tényezők, mint például a magas vérnyomás, diabetes mellitus, dyslipidemiák, ateroszklerotikus Érbetegségek és a pajzsmirigy rendellenességek kontrollálása lelassíthatja a szívelégtelenség és a szív remodeling progresszióját.2, 4, 6 szívelégtelenségben szenvedő betegnek influenza és pneumococcus vakcinát kell kapnia a társbetegségek, például a légzőszervi fertőzések kockázatának csökkentése érdekében.2. a legjelentősebb módosítható kockázati tényező a magas kockázatú magatartás, például a dohányzás, az alkohol és a tiltott kábítószer-használat.2,7
nátrium korlátozás (?2 gramm/nap) segíti a térfogat-túlterhelés csökkentését és csökkentheti a diuretikumok használatát. Ezenkívül a napi mérés lehetővé teszi a betegek számára a térfogat állapotának felmérését, amelyen a diuretikus dózis módosítása alapulhat. Azonban egyetlen tanulmány sem vizsgálta az étrendi nátrium-korlátozás hatását a morbiditásra vagy mortalitásra.7,8 kimutatták, hogy a fizikai aktivitás csökkenti a stabil szívelégtelenségben szenvedő betegek mortalitását és kórházi ellátását. A testmozgás korlátozása elősegíti a fizikai dekondícionálást, ami hozzájárulhat a beteg testmozgási intoleranciájához. Végül az étrend és a terápiás gyógyszeres kezelés betartása jelentős szerepet játszik az akut kórházi kezelések megelőzésében.2,7
farmakológiai
a szívelégtelenségben szenvedő betegek többségét standard kombinációs három gyógyszeres kezeléssel kezelik: hurok diuretikum, angiotenzin-konvertáló enzim (ACE) gátló vagy angiotenzin II receptor blokkoló (ARB), valamint béta-adrenerg receptor blokkoló.1,2 szívelégtelenségben a vizelethajtók jelentik a térfogattúlterhelés tüneteinek csökkentésének alapját, míg az ACE-gátlók, ARB-k és béta-blokkolók bizonyítottan csökkentik a morbiditást és mortalitást.2 az aldoszteron antagonisták kiegészítő terápiaként javallottak tünetekkel járó NYHA III. vagy IV. osztályú szívelégtelenségben szenvedő betegeknél, vagy korai akut MI után csökkent bal kamrai funkciójú és szívelégtelenség klinikai bizonyítékával rendelkező betegeknél. Ha a betegek továbbra is tüneti jellegűek, a digoxin hozzáadható a szokásos gyógyszeres kezeléshez a tünetek csökkentése, a kórházi kezelések csökkentése és a testmozgás toleranciájának növelése érdekében. A szívelégtelenség kezelésére használt gyógyszereket a 3. táblázat tárgyalja. A szisztolés szívelégtelenség életmódbeli módosításait és gyógyszeres terápiáit úgy tervezték, hogy csökkentsék a morbiditást és a mortalitást, megakadályozzák a szív átalakulásának előrehaladását és javítsák a betegek életminőségét.2
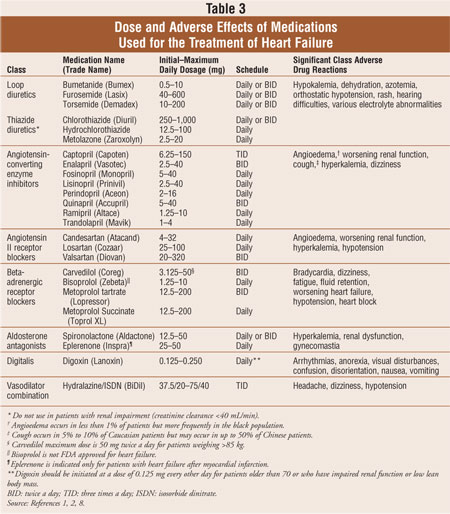
diuretikumok:A szívelégtelenségben a térfogat-túlterhelés tüneti kezelésének alappillére, a diuretikumok csökkentik a folyadékretenciót, amely pulmonalis torlódást, perifériás ödémát, jugularis vénás puffadást és/vagy megnövekedett testtömeget okoz. A Henle hurkában ható kacsdiuretikumok 20-25% – kal növelik a szérum nátrium kiválasztását, fokozzák a szabad vízzel történő eliminációt, és fenntartják hatásosságukat vesekárosodásban szenvedő betegeknél.1,2 ezzel szemben a tiazid diuretikumok 5-10% – kal csökkentik a nátrium kiválasztását, fokozzák a szabad vízzel történő eliminációt, és elveszítik hatásosságukat krónikus vesebetegségben szenvedő betegeknél (kreatinin-clearance <40 mL/perc). A szívelégtelenség kezelésében a kacsdiuretikumok az előnyben részesített gyógyszerek, de a tiazidok alkalmazhatók enyhe folyadékretencióban és magas vérnyomásban szenvedő betegeknél. A diuretikumok, valamint az ACE-gátlók és a béta-blokkolók alkalmazása minden C stádiumú szívelégtelenségben szenvedő beteg számára ajánlott.2 tanulmányok kimutatták, hogy a diuretikumok javítják a szívműködést, a tüneteket és a testmozgás intoleranciáját szívelégtelenségben szenvedő betegeknél. A diuretikumok mortalitásra gyakorolt hosszú távú hatása azonban nem ismert.1,2,8
ACE-gátlók: az ACE-gátlók csökkentik a renin-angiotenzin-aldoszteron rendszer aktivitását azáltal, hogy gátolják az angiotenzin I átalakulását angiotenzin II–vé, megakadályozva az angiotenzin II által kiváltott érszűkületet. Gátolják az aldoszteron felszabadulását is, ami a nátrium és a folyadékretenció csökkenéséhez vezet. Ezek a kombinált hatások csökkentik mind az előterhelést, mind az utóterhelést, és lassítják a szív átalakulásának előrehaladását.1,2 az ACE-gátlók fokozott kinin-és kinin-mediált prosztaglandintermeléssel is járhatnak.Az ACE-gátlók hatékonyságát értékelő 2 több mint 30 klinikai kontrollált vizsgálat kimutatta, hogy az ACE-gátlók csökkentik a halálozás kockázatát, valamint a halálozás és a kórházi kezelések együttes kockázatát. Minden bal kamrai szisztolés szívelégtelenségben szenvedő betegnek ACE-gátlót kell adni, kivéve, ha ez ellenjavallt (angioödéma, kétoldali arteria renalis stenosis, szérum kálium >5, 5 mEq/L, terhesség, tünetekkel járó hypotonia vagy instabil veseelégtelenség). Az ACE-gátlókat alacsony dózisokkal kell kezdeni, és a mellékhatások tolerálhatósága alapján lassan titrálni kell.1,2,8
ARB-k: az ACE-gátlók vizsgálataihoz képest kevesebb klinikai vizsgálat vizsgálta az ARB-k alkalmazását szívelégtelenségben szenvedő betegeknél; így ezek a szerek az ACE-gátlók intoleranciájával rendelkező betegek számára vannak fenntartva. Az ARB-k szelektíven blokkolják az angiotenzin II-t az angiotenzin receptorhoz kötődve. Az ARB-k csökkentik a kinin mellékhatások, például a köhögés és az angioödéma súlyosságát, bár ezekkel a szerekkel kapcsolatban angioödémát jelentettek. Az ARB hozzáadása a standard terápiához, beleértve az ACE-gátlót is, csökkentheti a bal kamra méretét és a kórházi kezelések számát, de a bizonyíték nem elegendő a mortalitás csökkentésében.2,8 egy tanulmány kimutatta, hogy az ACE-gátlóhoz hozzáadott kandezartán csökkentette a kardiovaszkuláris haláleseteket.9 azonban egy másik, MIand szívelégtelenségben szenvedő betegeken végzett valzartán-vizsgálat azt mutatta, hogy a valzartán és az ACE-gátló együttes alkalmazása nem előnyös az önmagában adott ACE-gátlókhoz képest.10 az ACE-gátlók, ARB-k és aldoszteron antagonisták kombinációjának felírása nem ajánlott a hyperkalaemia kockázata miatt. Az ARB-k az ACE-gátlók alternatívája maradnak a szívelégtelenség kezelésében.2
béta-adrenerg Receptor blokkolók: kimutatták, hogy a béta-blokkolók három típusa csökkenti a mortalitást: nyújtott felszabadulású metoprolol és bisoprolol, amelyek szelektíven blokkolják a béta-1 receptorokat, és a karvedilol, amely blokkolja az alfa-1, béta-1 és béta-2 receptorokat.1,2,8 összehasonlításképpen egy tanulmány kimutatta, hogy a rövid hatású metoprolol kevésbé volt hatással a karvedilolhoz képest, de az alkalmazott metoprolol dózisa alacsonyabb volt, mint az ajánlott céldózis.11 a standard terápia mellett a béta-blokkolók a halálozás és a szívelégtelenség kórházi kezelésének kombinált csökkenését mutatták. A béta-blokkolók gátolják a szimpatikus idegrendszer káros hatásait, felülmúlva a negatív inotrop hatásokat.2 összességében a béta-blokkolókat nagyon alacsony dózisokkal kell kezdeni, lassan, legalább kéthetes időközönként kell titrálni, és nem szabad hirtelen abbahagyni a kezelést a szívelégtelenség súlyosbodásának és az akut dekompenzáció kockázatának köszönhetően.1,2
aldoszteron antagonisták: az aldoszteron antagonisták blokkolják az aldoszteron receptort a nephron disztális tubulusában, ami kálium-visszatartást, nátrium-kiválasztást és enyhe diurézist eredményez. Az aldoszteron antagonisták alkalmazása közepesen súlyos vagy súlyos szívelégtelenségben és nemrégiben dekompenzációban szenvedő betegeknél, illetve bal kamrai diszfunkcióban szenvedő betegeknél javasolt röviddel az MI után.2 amikor alacsony dózisú spironolaktont adtak egy ACE-gátlóhoz NYHA III. és IV. stádiumú szívelégtelenségben szenvedő betegeknél, a betegek az összmortalitás 30%-os csökkenését tapasztalták.12 egy másik vizsgálat kimutatta, hogy az eplerenon a mortalitás csökkenéséhez vezetett azoknál a betegeknél, akiknél az LVEF kevesebb, mint 40% volt az MI-t követő 14 napon belül, bár nincsenek adatok az eplerenon alkalmazásáról az MI-n kívüli okokkal összefüggő szívelégtelenség kezelésében.13 az aldoszteron antagonisták legjelentősebb korlátozó tényezője potenciálisan életveszélyes hiperkalémia.2,14 a hiperkalémia fokozatosan növekszik, ha a szérum kreatinin meghaladja az 1,6 mg/dL-t, annak ellenére, hogy a vizsgálatok aldoszteron antagonistákat vizsgáltak olyan betegeknél, akiknél a szérum kreatinin belépő szintje 2,0-2,5 mg/dL volt. Ezenkívül kerülni kell az aldoszteron antagonistákat olyan betegeknél, akiknél a szérum káliumszint meghaladja az 5,0 mEq / liter értéket.2
Digoxin: a Digoxin egy szívglikozid, amely növeli a szív kontraktilitását a nátrium-kálium adenozin-trifoszfatáz (ATPáz) szivattyú gátlásával, ezáltal növelve az intracelluláris kalciumot. A Digoxin enyhe vagy közepesen súlyos szívelégtelenségben szenvedő NYHA II. vagy III. 2. egy post hoc analízisben a digoxin szérumkoncentrációja 0,5-0,9 ng/mL között csökkentette a hospitalizációkat; az 1 ng/mL-nél nagyobb koncentrációk azonban a placebóhoz képest a megnövekedett mortalitás tendenciájával társultak.15 bár a tanulmányok nem mutatták ki, hogy a digoxin csökkenti a mortalitást, ez a szer javíthatja a tüneteket és a testmozgás intoleranciáját, csökkentheti a kórházi kezeléseket és javíthatja az általános életminőséget.2,8,16
Értágító Kombináció: A hidralazin és az izoszorbid-dinitrát (ISDN) kombinációjának ajánlása azoknak a betegeknek van fenntartva, akik bizonyítottan nem tolerálják az ACE-gátlót vagy az ARB-t. Azonban egy nemrégiben végzett vizsgálatban, amelyben szimptómás NYHA III vagy IV szívelégtelenségben szenvedő afroamerikai betegek egy csoportja vett részt, a hidralazin és ISDN kombináció hozzáadása a standard terápiához (azaz ACE-gátló, diuretikum és béta-blokkoló) a túlélés 43% – os javulásához és az első kórházi kezelés kockázatának 33% – os csökkenéséhez vezetett a placebóhoz képest.17 elméletben a hidralazin és az ISDN kombináció növelheti a nitrogén-monoxid biohasznosulását.2 az ISDN és a hidralazin (bidil) kombinációját az FDA csak afro-amerikaiak számára hagyta jóvá a standard szívelégtelenség terápiájának kiegészítő terápiájaként.18 a hidralazin egy arteriol értágító, amely csökkenti az utóterhelést, míg az ISDN vénás értágító, amely csökkenti az előterhelést. Az értágítók ezen kombinációja nem előnyös az ACE-gátlókkal vagy az ARB-kkel szemben, mivel elviselhetetlen káros hatásai lehetnek, például fejfájás vagy szédülés, valamint megfelelési problémák, például kimaradt adagok, de kiegészítő terápiaként alkalmazható az afro-amerikai lakosság számára.2
alternatív gyógyszerek: galagonya levelek virágokkal, más néven Crataegus kivonat, már támogatta az enyhe szívelégtelenség (NYHA II). In vitro vizsgálatok révén a galagonya levelek pozitív inotrop hatásokat, értágító tulajdonságokat és fokozott koszorúér-véráramlást mutattak. A vizsgálatok a szubjektív tünetek javulását mutatták enyhe szívelégtelenségben szenvedő betegeknél. A digitalis-szerű hatások miatt mind a Crataegus kivonatot, mind a digitalis-t szedő betegeket szorosan ellenőrizni kell. A jelentett mellékhatások a gyomor-bélrendszeri tünetek, a szívdobogás, a mellkasi fájdalom és a vertigo voltak.19,20
a szívelégtelenség kezelésében alkalmazott másik alternatív gyógyszer a coenyzme Q10, egy zsírban oldódó vitamin. Néhány tanulmány kimutatta, hogy a Q10 koenzim javította a kórházi kezelések, a dyspnoe és az ödéma gyakoriságát.21 egy randomizált, kettős-vak, placebo-kontrollos vizsgálat azonban nem mutatott különbséget a coenyzme Q10 és a placebo között az LVEF, a testmozgás toleranciája vagy a szívelégtelenségben szenvedő betegek maximális oxigénfogyasztása tekintetében.22 A Q10 koenzim dokumentált káros hatásai a gastrointestinalis diszkomfort, hypoglykaemia és hypotonia voltak.A Crataegus kivonat és a coenyzme Q10 klinikai kontrollos vizsgálata folyamatban van a szívelégtelenség kezelésének hatékonyságának és biztonságosságának értékelésére.20,21
káros gyógyszerek szívelégtelenségben
számos gyógyszercsoport súlyosbíthatja a szívelégtelenséget, ezért kerülni kell. Az amiodaron vagy a dofetilid kivételével az antiaritmiás szerek cardiodepressant és proarrhythmiás hatást fejthetnek ki a szívre, ami akut dekompenzációhoz vezethet.1,2 az első generációs kalciumcsatorna-blokkolók fokozott cardiovascularis eseményekkel és a szívelégtelenség rosszabbodásával jártak. Az újabb, hosszú hatású kalciumcsatorna-blokkolók, az amlodipin és a felodipin biztonságosnak tűnnek, de egyetlen vizsgálat sem igazolta a mortalitás statisztikailag szignifikáns csökkenését.2,8,23 a tiazolidindionokat súlygyarapodással és folyadékretencióval hozták összefüggésbe, ami valószínűleg szívelégtelenséghez vagy a szívelégtelenség akut exacerbációjához vezetett. Az ödéma azonban nagyobb valószínűséggel fordul elő, ha a tiazolidindionokat inzulinterápiával kombinálva alkalmazzák.24,25 ezért a tiazolidindionok nem ajánlottak diabetes mellitusban és NYHA III.vagy IV. stádiumú szívelégtelenségben szenvedő betegeknél.25-27 NSAID-ok nátrium retenciót és perifériás érszűkületet okoznak, ami akut szívelégtelenség exacerbációt vált ki. Ezenkívül csökkentik a hatékonyságot és növelik az ACE-gátlók és a diuretikumok toxicitásának kockázatát. Lehetséges a gyógyszerkölcsönhatás, ha az aszpirint ACE-gátlókkal kombinálva alkalmazzák, de továbbra is ellentmondásos és további vizsgálatot igényel.2
gyógyszerész szerepe
a szívelégtelenség gyógyszeres kezelésének előnyeinek megértése optimális gyógyszerészeti ellátáshoz vezethet. A gyógyszerészek segíthetnek a betegeknek azonosítani és enyhíteni a magas kockázatú magatartásokat, például a dohányzást, az alkoholfogyasztást, valamint a tiltott és káros OTC kábítószer-használatot. Ezenkívül a gyógyszerészeknek figyelemmel kell kísérniük a betegeket a betegség progressziójára, beleértve a szívelégtelenség jeleit és tüneteit, és ösztönözniük kell a betegeket súlyuk feltérképezésére.
a betegek ösztönzése arra, hogy tartsák be az étrendi korlátozásokat, a testmozgási irányelveket és a szívelégtelenség gyógyszeres kezelési rendjét, a gyógyszerész prioritásának kell lennie. A terápiás gyógyszerek figyelmen kívül hagyása összefüggésbe hozható a halálozás növekedésével, és összefüggésben lehet a gyógyszerek káros mellékhatásaival. A gyógyszerészeknek figyelemmel kell kísérniük és ösztönözniük kell a betegeket, hogy megfeleljenek gyógyszereiknek a mortalitás csökkentése érdekében. A betegek és más egészségügyi szakemberek kábítószerrel kapcsolatos káros hatásainak figyelemmel kísérésével és oktatásával a gyógyszerészek hozzájárulhatnak a gyógyszerek megfelelőségének növeléséhez. Ezenkívül a gyógyszerészeknek tisztában kell lenniük az olyan gyógyszerek alternatíváival, mint az ACE-gátlók, és meg kell beszélniük más egészségügyi szolgáltatókkal a velük kapcsolatos halálozási előnyöket az optimális gyógyszerészeti ellátás biztosítása és a halálozás kockázatának csökkentése érdekében.
a betegek és az egészségügyi szolgáltatók nem ismerik a közös gyógyszerek és a szívelégtelenség súlyosbodása közötti összefüggést. Mivel néhány gyakori OTC gyógyszer, beleértve az NSAID-okat is, ellenjavallt szívelégtelenségben szenvedő betegeknél, a gyógyszerészek másik létfontosságú szerepe a beteg oktatása arról, hogy miért nem szedheti ezeket a gyógyszereket. A gyógyszerészeknek figyelemmel kell kísérniük a betegeket, és konzultálniuk kell az egészségügyi szolgáltatókkal és a betegekkel a káros gyógyszer-gyógyszer és gyógyszer-betegség kölcsönhatásokról, amelyek kórházi kezelést eredményezhetnek.
1. Klein L, O ‘ Connor CM, Gattis WA és mtsai. Farmakológiai terápia krónikus szívelégtelenségben és csökkent szisztolés funkcióban szenvedő betegek számára: a kísérletek és a gyakorlati megfontolások áttekintése. Cardiol Vagyok. 2003;91 (kiegészítés): 18F-40F.
2. Hunt SA, Abraham WT, Chin MH, et al. ACC / AHA 2005 útmutató frissítés a krónikus szívelégtelenség diagnosztizálására és kezelésére felnőttkorban: az American College of Cardiology/American Heart Association munkacsoport jelentése a gyakorlati Irányelvekről (a szívelégtelenség értékelésére és kezelésére vonatkozó 2001-es iránymutatások frissítésére szolgáló író Bizottság). Amerikai Kardiológiai Főiskola weboldala. Elérhető: www.acc.org/clinical/guidelines/failure//index.pdf.
3. Francis GS, Gassler JP, Sonnenblick EH. A szívelégtelenség kórélettana és diagnózisa. In: Fuster V, et al, Szerk. Hurst a szív. 10. kiadás. New York, NY: McGraw-Hill; 2001: 655-686.
4. Dei Cas L, Metra M, Nodari S és mtsai. A krónikus szívelégtelenség megelőzése és kezelése veszélyeztetett betegeknél. Cardiol Vagyok. 2003; 91 (kiegészítés): 10F-17F.
5. Chobanian AV, Bakris GL, Fekete HR, et al. A magas vérnyomás megelőzésével, kimutatásával, értékelésével és kezelésével foglalkozó nemzeti Vegyes Bizottság hetedik jelentése. Magas vérnyomás. 2003;42:1206-1252.
6. Frigerio M, Oliva F, Turazza FM, Bonow RO. Krónikus szívelégtelenség megelőzése és kezelése tünetmentes betegek kezelésében. Cardiol Vagyok. 2003; 91 (kiegészítés): 4F-9F.
7. Colonna P, Sorino M, D ‘ Agostino C és mtsai. A szívelégtelenség nem gyógyszeres kezelése: tanácsadás, étrendi korlátozás, rehabilitáció, alvási apnoe kezelése, ultraszűrés. Cardiol Vagyok. 2003;91 (kiegészítés): 41F-50F.
8. McConaghy JR, Smith SR. szisztolés szívelégtelenség járóbeteg-kezelése. Fam Orvos Vagyok. 2004;70:2157-2164.
9. Fiatal JB, Dunlap ME, Pfeffer MA, et al. Mortalitás és morbiditás csökkenés kandezartánnal krónikus szívelégtelenségben és bal kamrai szisztolés diszfunkcióban szenvedő betegeknél: a CHARM alacsony bal kamrai ejekciós frakció vizsgálatok eredményei. Keringés. 2004;110:2618-2626.
10. Cohn JN, Tognoni G. az angiotenzin-receptor blokkoló valzartán randomizált vizsgálata krónikus szívelégtelenségben. N Engl J Med. 2001;345:1667-1675.
11. Poole-Wilson PA, Swedbery K, Cleland JG, et al. A karvedilol és a metoprolol összehasonlítása krónikus szívelégtelenségben szenvedő betegek klinikai kimenetelével a karvedilol vagy a metoprolol Európai vizsgálatban (COMET): randomizált, kontrollos vizsgálat. Lancet. 2003;362:7-13.
12. Pitt B, Zannad F, Remme WJ és mtsai. A spironolakton hatása a morbiditásra és mortalitásra súlyos szívelégtelenségben szenvedő betegeknél. N Engl J Med. 1999;341:709-717.
13. Pitt B, Remme W, Zannad F és mtsai. Eplerenon, szelektív aldoszteron blokkoló, bal kamrai diszfunkcióban szenvedő betegeknél miokardiális infarktus után. N Engl J Med. 2003;348:1309-1321.
14. Aldakton . Chicago, IL: Pharmacia Corporation; 2003. július.
15. Ahmed a, gazdag MW, szerelem TE, et al. Digoxin és a mortalitás és a hospitalizáció csökkenése szívelégtelenségben: a Dig vizsgálat átfogó post hoc elemzése. Eur Szív J. 2006;27: 178-186.
16. A Digitalis Nyomozócsoport. A digoxin hatása a szívelégtelenségben szenvedő betegek mortalitására és morbiditására. N Engl J Med. 1997;336:525-533.
17. Taylor AL, Ziesche S, Yancy C, et al. Izoszorbid-dinitrát és hidralazin kombinációja szívelégtelenségben szenvedő feketéknél. N Engl J Med. 2004;351:2049-2057.
18. BiDil . Vicky vette, az: Nitromed Inc.; 2005. augusztus.
19. De Smet PA. Gyógynövény. N Engl J Med. 2002;347:2045-2056.
20. Holubersch CJ, Colucci WS, Meinertz T és mtsai. Túlélés és prognózis: a Crataegus Extract ws 1442 vizsgálata pangásos szívelégtelenségben(SPICE) – indoklás, tanulmányi tervezés és vizsgálati protokoll. Eur J Szív Nem. 2000;2:431-437.
21. Bonadkar RA, Guarneri E. Q10 koenzim. Fam Orvos Vagyok. 2005;72:1065-1070.
22. Khatta M, Alexander BS, Krichten CM, et al. A coenyzme Q10 hatása pangásos szívelégtelenségben szenvedő betegeknél. Ann Intern Med. 2000;132:636-640.
23. De Vries RJM, van Veldhuisen DJ, Dunselman PHJM. A kalciumcsatorna-blokkolók hatásossága és biztonságossága szívelégtelenségben: összpontosítson a második generációs dihidropiridinekkel végzett közelmúltbeli vizsgálatokra. Am Szív J. 2000;139: 185-194.
24. Delea TE, Edelsberg JS, Hagiwara M és mtsai. A tiazolidindionok alkalmazása és a szívelégtelenség kockázata 2-es típusú cukorbetegségben szenvedőknél. Cukorbetegség Ellátás. 2003;26:2983-2989.
25. Hollenberg NK. A tiazolidindionokkal kapcsolatos folyadékdinamikai problémák kezelésének szempontjai. Am J Med. 2003;115:111S-115S.
26. Avandia . Kutatási háromszög Park, NC: GlaxoSmithKline; 2005.augusztus.
27. Actos . Lincolnshire, IL: Takeda Pharmaceutical American Inc.; 2004. augusztus.
a cikk kommentálásához vegye fel a kapcsolatot [email protected].