はじめに
塩素は、水消毒のために最も一般的に使用される消毒剤の一つです。 塩素はほとんどの微生物の不活性化に適用することができ、比較的安価である。 塩素は、ガス状塩素(CL2)および次亜塩素酸ナトリウム液体または粉末(NaOCL)として市販されています。
ガス状塩素(CL2)と次亜塩素酸ナトリウム(NaOCL)の両方が非常に限られた消毒特性を持っています。 殺菌特性を阻害するのは、次亜塩素酸(HOCL)、次亜塩素酸イオン(OCL-)、塩酸(HCL)および酸素(O)などの塩素副生成物の形成である。
ガス状塩素
ガス状塩素(CL2)は市販されており、主に水道水の消毒に使用されています。
ガス状塩素(CL2)を水(H2O)に添加すると、以下の加水分解反応が起こる:
Cl2+H2O=H++Cl-+HOCl
次亜塩素酸ナトリウム
次亜塩素酸ナトリウムを苛性ソーダ(NaOH)にガス状塩素(CL2)を添加すると、次亜塩素酸ナトリウムが生成する。 これが行われると、次の反応に従って次亜塩素酸ナトリウム(NaOCL)、水(H2O)および塩(NaCl)が生成される:
Cl2+2NaOH+→NaOCl+NaCl+H2O
塩素は水酸化ナトリウムと次亜塩素酸ナトリウム(NaOCl)に反応する。 次亜塩素酸ナトリウムは漂白剤として知られています。 漂白剤(NaOCL)は酸と組み合わせることはできません。 NaOCLが酸と接触すると、次亜塩素酸塩は不安定になり、有毒なガス状塩素(CL2)が脱出する原因となります。
Hypochlorous Acid and Hypochlorite Ion formation
Hypochlorous Acid (HOCL) and Hypochlorite Ion (OCL-) are the by-products of Sodium Hypochlorite (NaOCL) in water (H2O). NaOCL reacts with water (H2O) to Hypochlorous Acid (HOCl) and Hypochlorite Ions (OCl-).
NaOCl + H2O → HOCl + NaOH-
Hypochlorous Acid formation
Hypochlorous Acid (HOCL) is the by-product of gaseous Chlorine (CL2) in Water. Gaseous Chlorine (CL2) reacts with water to Hypochlorous Acid (HOCL).
Cl2+H2O->HOCl+H++Cl-
酸素形成
pH値に応じて、次亜塩素酸(HOCL)は次亜塩素酸イオン(OCL-)に期限切れになります。
Cl2+2H2O->HOCl+H3O+Cl-HOCl+H2O->H3O++OCl-
これは塩素原子と酸素原子に分解されます。
OCl–>Cl-+O
消毒の有効性はpHによって決定されます。
>
消毒は、pHが5〜7のときに最適に行われ、最大HOCLが存在するためです。
HOCLはOClよりも速く反応する- ; HOCLはOCL-より有効な80-100%です。 HOCLは蒸発しないし、CL2のような厳しい腐食を引き起こさない。 空気中に露出したCL2は非常に爆発性であり、蒸発は避けるべきである。 このため、CL2が存在しないため、理想的なpHは6〜7です。
pH値が5より高いとHOCLのレベルが低下します。 HOCLのレベルは水素イオン濃度指数が5.より低い場合減ります。 PH値が6.5の場合、HOCLのレベルは90%以上であり、OCL-の濃度は10%未満である。
遊離塩素
遊離塩素(FAC)は、次亜塩素酸、次亜塩素酸イオン、または溶解した元素塩素の形で存在する塩素です。 FACはクロラミンを形作るためにアンモナル(か他の窒素の混合物)と結合されないすべての塩素種を含んでいます。 それはまだ何かに反応していないという意味では”自由”であり、必要に応じて反応することができ、反応するという意味では”利用可能”です。
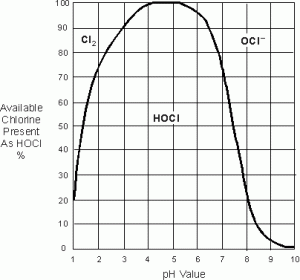
6から7の水素イオン濃度指数は塩素のガスの不在による最も有効で、最も安全なpH範囲です。 したがって、遊離の利用可能な塩素が言及されている場合、遊離の利用可能な塩素はHOCLおよびOCLのみで構成されると仮定される-
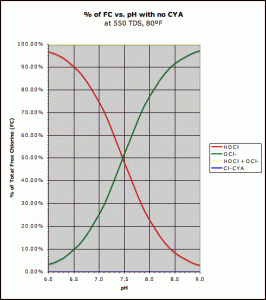
pHに関して自由な利用できる塩素の混合物。次亜塩素酸(赤)と次亜塩素酸イオン(緑)
次亜塩素酸の優位性次亜塩素酸イオン
次亜塩素酸(HOCl、電気的に中性)と次亜塩素酸イオン(OCl-、電気的に負)が結合すると、遊離塩素(FAC)が形成される。 これは消毒で起因します。 両方の物質は非常に独特の行動をしています。
病原性微生物の細胞壁は本質的に負に帯電している。 このように,細胞壁は中性次亜塩素酸(HOCL)によってのみ浸透し,負に帯電した次亜塩素酸イオン(OCL-)によっては浸透しなかった。
HOCLはスライム層、細胞壁、微生物の保護層に浸透することができ、結果として病原体を効果的に殺すことができます。 微生物は死ぬか、または生殖障害に苦しむでしょう。
pH中性次亜塩素酸(HOCL)は病原性微生物の細胞壁を貫通することができますが、負に帯電した次亜塩素酸イオン(OCL-)は細胞壁を貫通することができません。
HOCLの中性性に加えて、HOCLは塩酸(HCl)と原子空気酸素(O)に分割されるため、OCL-よりもはるかに反応性が高く、はるかに強力な消毒剤です。 酸素は非常に強力な消毒剤です。
中性電解水(HOCL)は、最適な消毒を保証します
水中の塩素の消毒特性は、酸素とHOCLの形成と酸化力に基づいています。 これらの条件はpHが6と7の間にあるとき起こります。
AQUAOXシステムからオンサイトで製造される中性電解水(新規)のpHは6.5です。 このpHでは、遊離の利用可能な塩素の90%以上がHOCLであり、10%未満のOCL-であり、CL2は形成されない。 新しいの自由な利用できる塩素(FAC)の強さは300+ppmに前もって調整される。 市販の漂白剤(Naocl)から3 0 0+ppmのFACを有する溶液を作製するために、それを水(H2O)中で希釈する。
漂白剤を水中で希釈する場合の問題は2つあります。
1)漂白剤を希釈する量が非常に小さい。 水に添加される漂白剤の量のわずかな違いは、pHおよび遊離の利用可能な塩素(FAC)の点で有意差を引き起こす。
2)水が自然に異なるpHレベルを有するという事実は、同じ量の漂白剤を添加すると依然として異なるpHになることを引き起こす。 各希釈で3 0 0+ppmのFACを測定することができるが、混合物のpH、ひいては活性化合物のHOCLおよびOCL−の量はかなり変化し得る。
したがって、漂白剤を用いた消毒特性は変化するが、新規の消毒特性は安定して保たれる。 その結果新しい300回漂白剤の消毒の特性を超過するかもしれません。
安全性
NaOCLを酸性化してHOCLを製造する場合、比較的高い価格と副反応の可能性が弱い有機酸の使用を制限します; 安価な無機酸の使用は、ガス状の塩素排出および毒性レベルの上昇を引き起こす。 そのため、上記の方法は、残留塩素濃度が0.5-5mg/lを超えない水処理にのみ使用されます。
式に従ってHOCLを生成するために水中のガス状塩素を希釈すると、特別な安全対策が必要であり、活性塩素濃度が10-15mg/l以下の大量の水を消毒するためにのみ使用されます。 この頃はガス状塩素を製造するすべての会社はガス状塩素の生産を停止し、安全考察のためにNaOCLの製造を専ら始めました。
AQUAOX Systemsが製造する中性電解水は、HOCLの非試薬合成のユニークな方法です。 私達はAQUAOXシステムの独特な質が6.0-7の指示されたpHの規則の可能性であることをもう一度指摘することを望む。0の範囲は、任意の鉱化の溶液で作業しながら、pHおよびFAC濃度が等しい場合、塩化ナトリウム溶液の電解は同一の殺生活性を有する。
詳細については、お問い合わせください[email protected]