Introduction
Le chlore est l’un des désinfectants les plus couramment utilisés pour la désinfection de l’eau. Le chlore peut être appliqué pour la désactivation de la plupart des microorganismes et il est relativement bon marché. Le chlore est disponible dans le commerce sous forme de chlore gazeux (CL2) et d’hypochlorite de sodium liquide ou en poudre (NaOCl).
Le chlore gazeux (CL2) et l’hypochlorite de sodium (NaOCl) ont tous deux des propriétés désinfectantes très limitées. C’est la formation de sous-produits chlorés tels que l’acide hypochloreux (HOCL), l’ion hypochlorite (OCL-), l’acide chlorhydrique (HCL) et l’oxygène (O) qui inhibent les propriétés désinfectantes.
Chlore gazeux
Le chlore gazeux (CL2) est disponible dans le commerce et principalement utilisé dans la désinfection de l’eau de distribution.
Lorsque du chlore gazeux (CL2) est ajouté à l’eau (H2O), la réaction d’hydrolyse suivante a lieu:
Cl2 + H2O = H + + Cl- + HOCl
Hypochlorite de sodium
L’hypochlorite de sodium est produit en ajoutant du chlore gazeux (CL2) à la soude caustique (NaOH). Lorsque cela est fait, l’hypochlorite de sodium (NaOCl), l’eau (H2O) et le sel (NaCl) sont produits selon la réaction suivante:
Cl2 + 2NaOH + → NaOCl + NaCl + H2O
Le chlore réagit avec l’hydroxyde de sodium en Hypochlorite de sodium (NaOCl). L’hypochlorite de sodium est connu sous le nom d’eau de Javel. L’eau de javel (NaOCl) ne peut pas être combinée avec des acides. Lorsque le NaOCl entre en contact avec des acides, l’hypochlorite devient instable, provoquant l’évacuation du chlore gazeux toxique (CL2).
Hypochlorous Acid and Hypochlorite Ion formation
Hypochlorous Acid (HOCL) and Hypochlorite Ion (OCL-) are the by-products of Sodium Hypochlorite (NaOCL) in water (H2O). NaOCL reacts with water (H2O) to Hypochlorous Acid (HOCl) and Hypochlorite Ions (OCl-).
NaOCl + H2O → HOCl + NaOH-
Hypochlorous Acid formation
Hypochlorous Acid (HOCL) is the by-product of gaseous Chlorine (CL2) in Water. Gaseous Chlorine (CL2) reacts with water to Hypochlorous Acid (HOCL).
Cl2 + H2O- > HOCl + H + + Cl-
Formation d’oxygène
Selon la valeur du pH, l’acide hypochloreux (HOCL) expire en ions hypochlorites (OCL-).
Cl2 + 2H2O – > HOCl + H3O + Cl-HOCl + H2O- > H3O + + OCl-
Ceci se désagrège en atomes de chlore et d’oxygène:
OCl– > Cl- + O
L’efficacité de la désinfection est déterminée par le pH.
La désinfection aura lieu de manière optimale lorsque le pH est compris entre 5 et 7, car alors un maximum de HOCL est présent.
HOCL réagit plus rapidement qu’OCl- ; HOCL est 80-100% plus efficace que OCL-. HOCL ne s’évapore pas et ne provoque pas de corrosion sévère comme le CL2. Le CL2 exposé à l’air peut être très explosif et l’évaporation doit être évitée. Pour cette raison, le pH idéal est compris entre 6 et 7, car aucun CL2 n’est présent.
Le niveau de HOCL diminuera lorsque la valeur du pH est supérieure à 5. Le niveau de HOCL diminuera lorsque la valeur du pH est inférieure à 5. Avec une valeur de pH de 6,5, le taux de HOCL est supérieur à 90%, tandis que la concentration de OCL – est inférieure à 10%.
Chlore libre disponible
Le chlore libre disponible (FAC) est le chlore présent sous forme d’acide hypochloreux, d’ions hypochlorites ou de chlore élémentaire dissous. Les AEC comprennent toutes les espèces de chlore qui ne sont pas combinées avec de l’ammoniac (ou d’autres composés azotés) pour former des chloramines. Il est « libre » dans le sens où il n’a encore réagi avec rien, et « disponible » dans le sens où il peut et réagira si nécessaire.
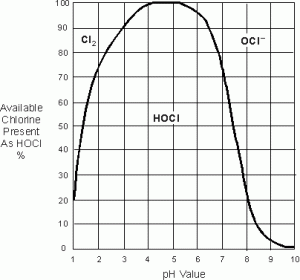
Une valeur de pH de 6 à 7 est la plage de pH la plus efficace et la plus sûre, en raison de l’absence de chlore gazeux. Par conséquent, lorsque le Chlore Libre Disponible est mentionné, on suppose que le Chlore Libre Disponible se compose uniquement de HOCL et d’OCL-
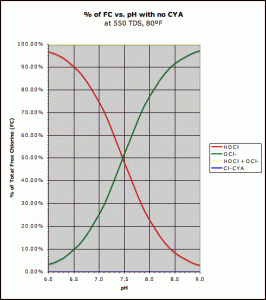
Composés chlorés disponibles gratuitement en ce qui concerne le pH.Acide hypochloreux (rouge) et Ion Hypochlorite (vert)
Supériorité de l’acide Hypochloreux par rapport à l’ion Hypochlorite
L’acide hypochloreux (HOCl, qui est électriquement neutre) et les ions Hypochlorite (OCl-, électriquement négatifs) formeront du chlore Libre disponible (FAC) lorsqu’ils sont liés ensemble. Cela entraîne une désinfection. Les deux substances ont un comportement très distinctif.
La paroi cellulaire des microorganismes pathogènes est chargée négativement par nature. En tant que telle, la paroi cellulaire ne pénètre que par l’acide hypochloreux neutre (HOCL), et non par l’ion Hypochlorite chargé négativement (OCL-).
HOCL peut pénétrer dans les couches de boue, les parois cellulaires et les couches protectrices des micro-organismes et tue efficacement les agents pathogènes en conséquence. Les micro-organismes mourront ou souffriront d’échecs de reproduction.
L’acide hypochloreux à pH neutre (HOCL) peut pénétrer dans les parois cellulaires des microorganismes pathogènes alors que l’ion hypochlorite chargé négativement (OCL-) ne peut pas pénétrer dans les parois cellulaires.
Outre la neutralité de HOCL, c’est un désinfectant beaucoup plus réactif et beaucoup plus puissant que l’OCL-, car HOCL est divisé en acide chlorhydrique (HCl) et oxygène de l’air atomique (O). L’oxygène est un désinfectant très puissant.
L’eau électrolysée neutre (HOCL) garantit une désinfection optimale
Les propriétés désinfectantes du chlore dans l’eau sont basées sur la formation et le pouvoir oxydant de l’oxygène et de l’HOCL. Ces conditions se produisent lorsque le pH est compris entre 6 et 7.
L’eau électrolysée Neutre (NEUVE) produite sur place à partir d’un système AQUAOX a un pH de 6,5. À ce pH, plus de 90% du chlore libre disponible est HOCL, moins de 10% OCL- et aucun CL2 ne se forme. La force du chlore libre disponible (FAC) dans le NEUF est préréglée à 300+ ppm. Pour obtenir une solution contenant plus de 300 ppm de FAC à partir d’eau de Javel disponible dans le commerce (NaOCl), elle est diluée dans de l’eau (H2O).
Le problème de dilution de l’eau de Javel dans l’eau est double:
1) Le volume de dilution de l’eau de Javel est très faible. De petites différences dans le volume d’eau de Javel ajoutée à l’eau entraînent des différences significatives en termes de pH et de chlore libre disponible (FAC).
2) Le fait que l’eau ait des niveaux de pH naturellement différents, fait que l’ajout du même volume d’eau de Javel entraîne toujours un pH différent. Bien qu’à chaque dilution on puisse mesurer 300+ ppm FAC, le pH du mélange et par conséquent la quantité de composés actifs HOCL et OCL- peuvent varier considérablement.
Par conséquent, les propriétés désinfectantes à l’aide d’eau de Javel varient alors que les propriétés désinfectantes du NEUF sont maintenues stables. En conséquence, NEW peut dépasser les propriétés désinfectantes de l’eau de Javel de 300 fois.
Sécurité
Lors de la production de HOCL par acidification du NaOCl, des prix relativement élevés et la possibilité de réactions secondaires limitent l’utilisation d’acides organiques faibles; l’utilisation d’acides inorganiques moins chers provoque une décharge de chlore gazeux et une augmentation du niveau de toxicité. Pour cette raison, la méthode ci-dessus n’est utilisée que pour le traitement de l’eau, où les valeurs de concentration en chlore résiduel ne dépassent pas 0,5-5mg / l.
La dilution du chlore gazeux dans l’eau pour produire du HOCL selon l’équation nécessite des mesures de sécurité spéciales et n’est utilisée que pour désinfecter de grands volumes d’eau, où la concentration en chlore actif est inférieure à 10-15mg / l. De nos jours, toutes les entreprises qui fabriquent du chlore gazeux ont arrêté la production de chlore gazeux et ont commencé la fabrication de NaOCl exclusivement pour des raisons de sécurité.
L’eau électrolysée neutre produite sur place par AQUAOX Systems est une méthode unique de synthèse non réactive de HOCL. Nous tenons à souligner une fois de plus que la qualité unique du système AQUAOX est la possibilité d’une régulation dirigée du pH dans le 6.0-7.0 plages, en travaillant avec des solutions de toute minéralisation, alors que les électrolysations de solutions de chlorure de sodium ont une activité biocide identique si pH et concentration FAC sont égaux.
Pour plus d’informations, veuillez contacter [email protected]