us Pharm. 2014; 39 (4): HS2-HS7.
ABSTRACT: de behandeling van hydrocephalus, de accumulatie van cerebrospinale vloeistof (CSF) in de ventrikels van de hersenen, omvat vaak shuntimplantatie om effecten op lange termijn te voorkomen. Shunts zijn drainage-apparaten ontworpen om intracraniale druk te ondersteunen en verdere CSF-accumulatie te voorkomen, maar ze kunnen ziekteverwekkers in het centrale zenuwstelsel introduceren. Dit kan tot besmettingen en gevolgen leiden, zoals beslagleggingen, shuntmislukking, meningitis, sepsis, en encefalitis. Infecties kunnen worden voorkomen door gebruik te maken van aseptische technieken, chemoprofylaxe en/of antibiotica-eluting shunts. Behandeling van een shunt infectie kan het verwijderen van de geïnfecteerde hardware, plaatsing van een drainage-apparaat, en het gebruik van IV of intraventriculaire antibiotica.
Hydrocephalus is een aandoening die wordt gekenmerkt door accumulatie van cerebrospinale vloeistof (CSF) in de ventrikels of subarachnoïdale ruimte in de hersenen, wat leidt tot verhoogde intraventriculaire druk en ventriculaire dilatatie. Een veel voorkomende etiologie van hydrocephalus is stoornis van CSF drainage.1,2 het voorkomen van Hydrocefalie in de Verenigde Staten en Europa wordt geschat op 0,5 tot 0,8 per 1.000 geboorten en is vaak secundair aan spina bifida, intracraniale bloeding of aangeboren etiologie.1,3 andere mogelijke oorzaken van hydrocephalus zijn myelodysplasie, tumoren, meningitis, posterior fossa cyste, Dandy-Walker malformatie of aqueductal stenose.4
Mechanisch rangeren is de primaire behandeling voor hydrocefalie. Hydrocephalus-gerelateerde shunt plaatsingen zijn de meest voorkomende neurochirurgische procedure uitgevoerd bij kinderen, maar ze hebben ook het hoogste percentage falen.5 meer dan 40.000 shunt plaatsingen worden jaarlijks uitgevoerd in de VS, met een geschatte intramurale mortaliteit van 2,7%.5,6 introductie van gemeenschappelijke huidflora en andere pathogenen, zowel perioperatief als postoperatief, kan leiden tot shuntinfecties en resulteren in shuntfalen.
het percentage shuntinfecties wordt geschat op 1,6% tot 16,7% bij volwassen patiënten, maar tot 20% bij pediatrische patiënten.Dit toegenomen voorkomen in de pediatrische populatie wordt toegeschreven aan een gebrek aan immuniteit (in het bijzonder <1 jaar oud), prematuriteit (<35 weken zwangerschapsduur), blootstelling aan potentiële pathogenen, bijkomende morbiditeiten en andere fysiologische factoren.3,4 pediatrische patiënten hebben de neiging om shuntinfecties eerder te ontwikkelen dan volwassenen, met de meeste infecties die optreden binnen de eerste 30 tot 60 dagen na plaatsing.1
patiënten die < 5 jaar oud zijn en volwassenen in de leeftijd van 50 tot 59 jaar lijken de grootste incidentie van shuntinfecties te hebben.1 risicofactoren voor een shuntinfectie kunnen zijn: jongere leeftijd, postoperatieve lekkage in de liquor, intraventriculaire bloeding, meerdere shunts, shuntrevisiechirurgie in de afgelopen 90 dagen, shunts direct na meningitis geplaatst, langdurig verblijf in het ziekenhuis (>1 maand) en eerdere shuntinfectie.2,4,7,8 complicaties in verband met shuntinfecties omvatten shuntstoringen, cognitieve stoornissen op korte of lange termijn, sepsis, meningitis en verlengd verblijf in het ziekenhuis.1,4,8
Shunttypen
de meest voorkomende shunttypen zijn samengevat in Tabel 1. Dit artikel zal zich richten op de twee meest gebruikte shunts: ventriculoperitoneal (VP) en ventriculoatrial (VA) shunts. VP shunts, de meest voorkomende van de twee, werken door CSF om te leiden naar het buikvlies, terwijl VA shunts verschuiven de CSF naar het atrium van het hart.2,9,10

pathogenese van Shuntinfecties
shuntcontaminatie wordt vaak veroorzaakt wanneer het proximale uiteinde van de shunt in contact komt met een normale huidflora. Dit kan postoperatief optreden als gevolg van een wondinfectie of perioperatief tijdens chirurgische implantatie.11 Gram-positieve bacteriën, zoals coagulase-negatieve Staphylococcus epidermidis en Staphylococcus aureus, zijn verantwoordelijk voor respectievelijk 45% tot 60% 1-3,12 en 20% tot 33% 2,3 (waarbij één melding tot 80% 4) van shuntinfecties. Deze pathogenen zijn nauw verbonden met vroege shuntinfecties (die binnen 4 weken na een shuntoperatie optreden).2
Late shuntinfecties kunnen enkele maanden na een shuntoperatie optreden en zijn verantwoordelijk voor ongeveer 15% van de shuntgerelateerde infecties.3 in veel gevallen kunnen deze late infecties worden veroorzaakt door ofwel grampositieve bacteriën, zoals Streptococcus of Enterococcus species, of gramnegatieve bacteriën, meestal Pseudomonas aeruginosa, als de patiënt een darmperforatie of peritonitis heeft ervaren (voornamelijk gezien in VP shunts).2 de meest voorkomende pathogenen geassocieerd met shuntinfecties worden samengevat in tabel 2.1-4,11 infecties verhogen de kans op shuntgerelateerde complicaties en mislukkingen.

preventie van Shuntinfecties
methoden die worden gebruikt om een shuntinfectie te voorkomen, omvatten het gebruik van steriele techniek, systemische antibiotica en met antibiotica geïmpregneerde katheters. Het is aangetoond dat aseptische chirurgische techniek het risico op shuntinfecties helpt verminderen. Een gestandaardiseerd chirurgisch protocol, met inbegrip van preoperatieve wassen van het haar van de patiënt met chloorhexidine shampoo, dubbele gloving door alle leden van het chirurgische team, en het gebruik van antibiotica-geïmpregneerde shunts (AIS), dat werd uitgevoerd door vier kinderziekenhuizen toonde een vermindering van de infectie van 8,8% tot 5,7%.13
systemische profylactische antibiotica kunnen worden gebruikt tijdens de procedure en in de eerste 24 uur na het plaatsen van de shunt. Volgens een meta-analyse verminderde het gebruik van systemische, profylactische antibiotica en met antibiotica geïmpregneerde katheters het aantal shuntinfecties.9 Deze zelfde studie vergeleek het gebruik van systemische, profylactische antibiotica versus placebo voor de vermindering van shuntinfectie en vond dat de antibiotica de tarieven van shuntinfecties verminderden (odds ratio , 0,52).Hoewel het meest geschikte profylactische antibioticum voor shuntplaatsing in het verleden niet goed gedefinieerd was, gebruiken de meeste artsen IV cefazoline of vancomycine voor chirurgische profylaxe.2,14 recente richtlijnen bevelen cefazolin aan voor neurochirurgische vocht-rangeerprocedures, met clindamycine en vancomycine als alternatieven voor allergische patiënten.15
AIS-katheters worden vaak gebruikt om shuntinfecties te voorkomen sinds de introductie ervan in 200216 de meeste hulpmiddelen zijn geïmpregneerd met een combinatie van rifampicine en clindamycine.4,16,17 zij worden ontworpen om de kolonisatie van gram-positieve bacteriën te richten die een glycoproteã ne biofilm produceren die aan de katheteroppervlakte aanhangt.In een meta-analyse werd gekeken naar het gebruik van met antibiotica geïmpregneerde katheters versus standaardkatheters en werd vastgesteld dat het gebruik van met antibiotica geïmpregneerde katheters in verband werd gebracht met verminderde percentages van shuntinfectie (OR, 0,21). In deze meta-analyse werd geconcludeerd dat het gebruik van zowel systemische antibiotische profylaxe als met antibiotica geïmpregneerde katheters gunstig zou kunnen zijn voor de vermindering van shuntinfecties.9
er werd ook een retrospectief onderzoek uitgevoerd bij pediatrische patiënten die gedurende een periode van 3 jaar shunt insertie hadden ondergaan. Gedurende de eerste 18 maanden kregen patiënten niet-antibiotisch geïmpregneerde katheters; gedurende de volgende 18 maanden kreeg elke nieuwe patiënt die shuntplaatsing nodig had, met antibiotica geïmpregneerde katheters. Alle kinderen werden gedurende 6 maanden na de plaatsing van de shunt gevolgd. De kinderen met niet-antibiotische katheters hadden een infectiepercentage van 12%, terwijl slechts 1,4% van de kinderen met met antibiotica geïmpregneerde katheters een infectie had.In een meer recente evaluatie van 15 onderzoeken werd ook geconcludeerd dat met antibiotica beklede katheters het aantal klinische infecties verminderen, met name bij patiënten met langdurige katheters, wat verschilt van sommige eerdere analyses.19
het voorkomen van shuntinfecties door profylaxe en het gebruik van AIS-katheters hebben aangetoond dat ze de kosten van patiëntenzorg verlagen.Er wordt geschat dat de kosten voor de behandeling van een shunt infectie kan variëren van $17.300 tot $48.454 per patiënt, wat leidt tot een geschatte jaarlijkse ziekenhuis kosten in de VS van $2 miljard.16,17 hoewel elke AIS-katheter gemiddeld $ 400 kost, kan de hoeveelheid geld die wordt bespaard door het voorkomen van infectie en/of herinfectie op lange termijn aanzienlijke besparingen opleveren.16 Deze besparingen zijn te wijten aan een 2,4-voudige verminderde kans op infectie en verminderde tijd in het ziekenhuis als gevolg van infectie. Er is gemeld dat deze besparingen zou oplopen tot meer dan $440.000 per 100 patiënten geschuwd.17
diagnose van Shuntinfecties
algemene symptomen van shuntinfecties zijn hoofdpijn, misselijkheid, braken, ontsteking van de operatieplaats, neurologische afwijkingen, koorts en convulsies.2,3 patiëntspecifieke klinische manifestaties van shuntinfecties hangen af van het type geïmplanteerde shunt. VP shunts kan worden geassocieerd met peritonitis, anorexia, prikkelbaarheid,en buikpijn, 8 terwijl VA shunts kan worden geassocieerd met sepsis en endocarditis.2,3 als klinische manifestaties zoals veranderde mentale toestand, erytheem rond de shuntplaats, vocht langs de shuntbaan, purulente afscheiding, papildeem, uitpuilende fontanel, nekstijfheid of duidelijke lekkage van de liquor worden waargenomen, moet de patiënt worden geëvalueerd met liquor-analyse, bloedculturen en cerebrale beeldvorming.8
liquor analyse voorspellend voor infectie omvat een verhoogd aantal witte bloedcellen, verhoogde eiwitconcentraties en verlaagde glucosespiegels; de liquor moet ook gekweekt en gramkleurig zijn. Bloedculturen zijn nuttigere indicatoren van VA-shuntinfecties in tegenstelling tot VP-shuntinfecties.11 cerebrale beeldvorming kan worden gebruikt om ventriculitis of bewijs van CSF obstructie te identificeren. Abdominale beeldvorming kan ook worden gebruikt om VP shunt storing te identificeren.
behandelingsopties
Momenteel zijn er geen praktische richtlijnen voor de behandeling van shuntinfecties; echter, het verwijderen van de geïnfecteerde hardware, het plaatsen van een externe ventriculaire drain, culturen en behandeling met IV of intraventriculaire anti-biotica zijn allemaal onderdeel van een effectief beheersproces.2
huidige aanbevelingen voor de empirische behandeling van infecties van het centraal zenuwstelsel (CZS) in aanwezigheid van een shunt bevelen aan IV vancomycine te gebruiken in combinatie met een middel dat voldoende gramnegatieve dekking heeft, zoals cefepime, ceftazidime, cefotaxime of meropenem. Het vermogen van een medicijn om de CSF te penetreren evenals de activiteit van het antibioticum tegen de bacteriële biofilm zijn ook belangrijk om te overwegen voor antibiotische keuze.Dergelijke middelen dienen te worden toegediend totdat de ziekteverwekker is geïdentificeerd en de definitieve behandeling is bepaald.22,23 in een VP-shunt ligt de distale punt van de shunt in de buikholte en is gevoeliger voor gramnegatieve bacteriën; gentamicine kan worden toegevoegd voor synergie.2 empirische antimicrobiële therapie en doseringsaanbevelingen voor shuntinfecties zijn samengevat in tabel 3.2,18,22,23
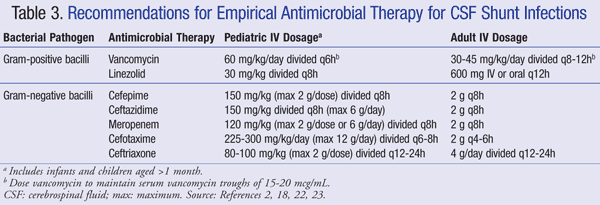
voor patiënten die refractair zijn voor vancomycine therapie is linezolid 10 mg/kg om de 8 uur werkzaam gebleken als monotherapie bij pediatrische patiënten.De toevoeging van rifampine als adjuvante therapie kan ook worden overwogen vanwege de penetratie ervan in het CZS.De duur van de antibiotische therapie hangt grotendeels af van de gebruikte chirurgische aanpak, het type shunt en de betrokken ziekteverwekker, met een studie die een behandelingsduur van 4 tot 47 dagen rapporteert.25,26 meer specifiek is 7 tot 10 dagen voorgesteld voor de behandelingsduur, 23 met een langere kuur (10-14 dagen) aanbevolen voor gramnegatieve infecties.2
in het geval van gecompliceerde of behandelingsresistente shuntinfecties dienen artsen intrathecale of intraventriculaire toediening van antibiotica te overwegen voor een verhoogde werkzaamheid vanwege hun vermogen om hogere bactericide concentraties in het CZS te bereiken.Vancomycine en gentamicine worden vaak gebruikt in deze situatie; er zijn echter geen definitieve aanbevelingen over het gebruik ervan.22,23
Schimmelhuntinfecties
een schimmelhuntinfectie wordt als zeldzaam beschouwd, met een incidentie van 0,01% in één studie.De meest voorkomende pathogenen die verantwoordelijk zijn voor een schimmelinfectie zijn Candida-soorten (waaronder C albicans, C parapsilosis en c tropicalis), die 75% van de schimmelgevallen veroorzaken. Andere organismen omvatten Histoplasmosis species, Cryptococcus neoformans, en Aspergillus species. De primaire behandeling voor schimmelinfecties is liposomaal amfotericine B 3 tot 5 mg/kg / dag gedurende ten minste 12 weken.Voor patiënten die amfotericine B niet verdragen, kan 5-flucytosine een alternatief zijn.Dit wordt vaak gevolgd door behandeling met fluconazol 600 tot 800 mg/dag of itraconazol 200 mg twee tot drie keer per dag gedurende maximaal 1 jaar bij immunocompetente patiënten en mogelijk levenslange therapie bij patiënten die immunogecompromitteerd zijn.
conclusie
Shuntinfecties zijn een risicofactor geassocieerd met hydrocefalie behandeling. Infectiepreventie is aangetoond met empirische antibiotica en het gebruik van AIS-katheters, gecombineerd met de juiste aseptische techniek, om het infectiepercentage significant te verlagen en het risico op comorbide sequelae te verminderen. Er zijn momenteel geen richtlijnen voor de behandeling van shuntinfecties; echter, IV empirische therapie met zowel gram-positieve als gram-negatieve dekking, zoals vancomycine en een derde generatie cefalosporine, zou worden aanbevolen. Intraventriculaire antibiotica kunnen ook nodig zijn voor maximale bactericide CZS-concentratie.
1. Langley JM, Gravel D, Moore D, et al. Studie van cerebrospinale vocht shunt-geassocieerde infecties in het eerste jaar na plaatsing, door de Canadese nosocomiale infectie Surveillance. Infecteren Controle Ziekenhuis Epidemiol. 2009;30:285-288.
2. Wells DL, Allen JM. Ventriculoperitoneale shuntinfecties bij volwassen patiënten. AACN Adv Crit zorg. 2013;24:6-12.
3. Lee JK, Seok JY, Lee JH, et al. Incidentie en risicofactoren van ventriculoperitoneale shuntinfecties bij kinderen: een studie van 333 opeenvolgende shunts in 6 jaar. J Koreaanse Med Sci. 2012;27:1563-1568.
4. Parker SL, Attenello FJ, Sciubba DM, et al. Vergelijking van de incidentie van shuntinfecties in subgroepen met een hoog risico die met antibiotica geïmpregneerd worden, versus standaardshunts. Childs Nerv Syst. 2009;25:77-83.
5. Behandeling van hydrocephalus. Hydrocephalus Association. www.Hydro-Assoc.org / hydrocephalus-onderwijs-en-ondersteuning/leren-over-hydrocephalus/behandeling-van-hydrocephalus/. Geraadpleegd Op 11 Februari 2014.
6. Patwardhan RV, Nanda A. geïmplanteerde ventriculaire shunts in de Verenigde Staten: de miljard-dollar-per-jaar kosten van Hydrocefalie behandeling. Neurochirurgie. 2005;56:139-144.
7. Dallacasa P, Dappozzo A, Galassi E, et al. Hersenvocht shunt infecties bij zuigelingen. Childs Nerv Syst. 1995;11:643-648.
8. Rogers EA, Kimia A, Madsen JR, et al. Voorspellers van ventriculaire shunt infectie bij kinderen presenteren aan een pediatrische spoedeisende hulp afdeling. Kinderverzorging Emerg. 2012;28:405-409.
9. Ratilal BO, Costa J, Sampaio C. antibiotische profylaxe voor chirurgische introductie van intracraniale ventriculaire shunts. Cochrane Database Syst Rev. 2006; (3):CD005365.
10. Shuntsystemen. Hydrocephalus Association. www.hydroassoc.org/hydrocephalus-education-and-support/learning-about-hydrocephalus/shunts. Geraadpleegd op 12 februari 2014.
11. Vooruit KR, minder HD, Stiver HG. Hersenvocht shunt infectie. Een overzicht van 35 infecties bij 32 patiënten. J Neurochirurg. 1983;59:389-394.
12. Lan CC, Wong TT, Chen SJ, et al. Vroege diagnose van ventriculoperitoneale shunt infecties en storingen bij kinderen met hydrocephalus. J Microbiol Immunol Infecteren. 2003;36:47-50.
13. Kestle JR, Riva-Cambrin J, Wellons JC, et al. Een gestandaardiseerd protocol om hersenvocht shunt infectie te verminderen: het Hydrocephalus Clinical Research Network Quality Improvement Initiative. J Neurochirurg Pediatr. 2011;8:22-29.
14. Shah SS, Sinkowitz-Cochran RL, Keyserling HL, et al. Gebruik vancomycine bij pediatrische neurochirurgiepatiënten. Am J Infecteert De Controle. 1999;27:482-487.
15. Bratzler DW, Dellinger EP, Olsen KM, et al. Klinische praktijk richtlijnen voor antimicrobiële profylaxe in chirurgie. Am J Health-Syst Pharm. 2013;70:195-283.
16. Parker SL, Anderson WN, Lilienfeld S, et al. Cerebrospinale shunt infectie bij patiënten die met antibiotica geïmpregneerd versus standaard shunts. J Neurochirurg Pediatr. 2011;8:259-265.
17. Attenello F, Garces-Ambrossi G, Zaidi H, et al. Ziekenhuiskosten in verband met shuntinfecties bij patiënten die met antibiotica geïmpregneerde shuntkatheters krijgen versus standaard shuntkatheters. Neurochirurgie. 2010;66:284-289.
18. Sciubba DM, Stuart RM, McGirt MJ, et al. Effect van met antibiotica geïmpregneerde shuntkatheters bij het verminderen van de incidentie van shuntinfectie bij de behandeling van hydrocephalus. J Neurochirurg. 2005; 103 (suppl): 131-136.
19. Babu MA, Patel R, Marsh WR, et al. Strategieën om het risico van ventriculaire katheter infecties te verminderen: een overzicht van het bewijs. Neurocrit Care. 2012;16:194-202.
20. Bratzler DW, Dellinger EP, Olsen KM, et al. Klinische praktijk richtlijnen voor antimicrobiële profylaxe in chirurgie. Surg Infecteren (Larchmt). 2013;14:73-156.
21. Yilmaz A, Dalgic N, Musluman M, et al. Linezolide behandeling van shunt-gerelateerde cerebrospinale vocht infecties bij kinderen. J Neurochirurg Pediatr. 2010;5:443-448.
22. Tunkel AR, Hartman BJ, Kaplan SL, et al. Praktijkrichtlijnen voor de behandeling van bacteriële meningitis. Clin Infecteert Dis. 2004;39:1267-1284.
23. Van de Beek D, Drake JM, Tunkel AR. Nosocomiale bacteriële meningitis. N Engl J Med. 2010;362:146-154.
24. Hedberg A, Hardemark HG, Olsson-Liljequist B, et al. Penetratie van fusidinezuur en rifampicine in de cerebrospinale vloeistof bij laaggradige inflammatoire meningitis veroorzaakt door Staphylococcus epidermidis. Clin Microbiol Infecteren. 2004;10:765-768.
25. Antimicrobiële profylaxe voor chirurgie. Behandel Guidel Med Lett. 2004;2:27-32.
26. Simon TD, Hall M, Dean JM, et al. Herinfectie na initiële infectie met de shunt van de cerebrospinale vloeistof. J Neurochirurg Pediatr. 2010;6:277-285.
27. Veeravagu A, Ludwig C, Camara-Quintana JQ, et al. Schimmelinfectie van een ventriculoperitoneale shunt: histoplasmose diagnose en behandeling. Wereld Neurochirurgie. 2013;80:222.e5-e13.
28. Chiou CC, Wong TT, Lin HH, et al. Schimmelinfectie van ventriculoperitoneale shunts bij kinderen. Clin Infecteert Dis. 1994;19:1049-1053.