în chimie, punctul de echivalență este un termen care este utilizat în timpul efectuării titrării. Se aplică oricărei reacții acido-bazice sau de neutralizare din punct de vedere tehnic.
definiție:
punctul de echivalență al unei reacții chimice este punctul în care cantități egale de reactanți sunt amestecați chimic.
cu alte cuvinte, în timp ce titrează, este un punct în care cantitatea de titrant adăugat este suficientă pentru a neutraliza complet soluția de analit. Numărul de moli de titrant adică. soluția standard este egală cu molii unei soluții care are o concentrație necunoscută. Este, de asemenea, cunoscut sub numele de punct stoichiometric, deoarece este un punct în care molii de acid sunt egali cu molii bazei care sunt necesari pentru neutralizarea soluției. Rețineți că raportul acid / bază nu trebuie să fie 1:1. Acest raport acid-bază se explică prin ecuația chimică echilibrată acid-bază. Indicatorii pot fi utilizați în acest scop, de exemplu, portocaliu metil sau fenolftaleină.

punctul de echivalențănu poate fi luat la fel ca obiectivul final al unei titrări. Punctul final estereferit ca punct în care indicatorul utilizat își schimbă culoarea. Aceste modificări de culoare apar după atingerea punctului de echivalență. Dacă folosim punctul final pentru a determina echivalența, va induce o eroare.
metode de determinare a punctului de echivalență:
există metode diferite pentru determinarea punctului de echivalență. Acestea sunt discutate caurmătoarele:
- indicator pH
- conductanță
- schimbare de culoare
- Precipitare
- calorimetrie Izotermă
- titrimetrie termometrică
- spectroscopie
- Amperometrie
indicator pH:
Indicator APH este o substanță chimică care își schimbă culoarea ca reacție la orice schimbare chimică. Un indicator acido-bazic, de exemplu, fenolftaleina se schimbăculoarea sa, care depinde de pH-ul său. Inițial, se adaugă doar o singură picătură de soluție indicatoare latitrare. Schimbarea culorii va arăta că punctul final a fost atins.Aceasta va fi o estimare a punctului de echivalență.
conductanță:
conductivitatea electrică a unei soluții este afectată de ioni. Prin urmare, conductivitatea se schimbă atunci când reacționează unul cu celălalt. (de exemplu, în timp ce efectuează o titrare acido-bazică, ionii H3O + și OH reacționează și se formeazăapă neutră, soluție H20). Conductanța este relativ o metodă dificilăoperați, mai ales atunci când ionii prezenți în soluție potparticipa la conductivitate. Conductanța poate fi utilizată pentru câteva baze acidereacții.
schimbarea culorii:
la punctul de echivalență, soluția își va schimba culoarea în mod natural, fără a adăuga un indicator în unele reacții. Acest lucru poate fi observat în tranzițiemetale în care starea de oxidare constă în culori diferite.
Precipitare:
în timpul titrării, precipitatul se va forma dacă reacția formează un solid. Un bun exemplu de precipitare este reacțiaîntre argint, Ag+ și clor, Cl – care are ca rezultat formarea de sare aninsolubilă, clorură de argint, AgCl. În mod neașteptat, acest lucru face foarte dificilă determinarea exactă a punctelor finale din cauza dimensiunii particulelor, rata de sedimentare și culoare face foarte dificil de văzut. Acesta este motivul pentru caretitrarea prin precipitare se face ca titrări înapoi.
Calorimetrie Izotermă:
determinarea punctului de echivalență se face prin calcularea cantității de căldură care este produsă sau absorbită prin utilizarea unui dispozitiv cunoscut sub numele de titrare Izotermă. Acest tip este de obicei utilizat în titrări care implică biochimiereacții, adică ca legare enzimatică.
Titrimetria termometrică:
Termometrictitrimetria este o tehnică excepțional de complexă. Aici echivalențapunctul este determinat prin măsurarea vitezei de schimbare a temperaturii produsă de reacția achemică. Această proprietate o diferențiază de calorimetrictitrimetrie. Deoarece titrimetria termometrică este o tehnică relativă, nu estenecesare pentru a efectua titrarea în condiții izoterme. Acest tip detitrarea poate fi efectuată în materiale plastice sau chiar în vase de sticlă. Pentru a preveni curenții de scurgere, aceste vase sunt de obicei închise provocând orice zgomot care perturbă punctul final. Datorită capacității acestui tip de titrare de a fiefectuate în condiții ambientale, acestea sunt adecvate pentru procesele de rutină și controlul calității în industrie. Temperatura fie va crește, fie va scădea în timpul procesului de titrare, în funcție de faptul dacă reacția care ia locul dintre titrant și analit este exotermă sau endotermă. Ittitrare când tot analitul a fost consumat de reacție, rata de temperatură se modifică, adică. o creștere sau o scădere determină echivalențapunctul și inflexiunea în curba de temperatură pot fi observate. Punctul de echivalență poate fi observat exact prin utilizarea celei de-a doua derivate a curbei de temperatură. Software-ul care este utilizat într-un sistem modern de titrare termometrică automatizată constă din algoritmi digitali avansați obișnuiți, astfel încât zgomotul generat de sondele de temperatură extrem de sensibile să nu provoace nicio interferență cu apariția unui vârf secundar regulat, uniform, care descrie punctul final. Această tehnică are capacitateafoarte mare precizie și coeficientul de varianță (CVs) de mai puțin de 0,1 areusual. Cele mai recente sonde de temperatură de titrare termometrică au un termistorcare formează un braț al unui pod de piatră de grâu. cel mai bun sistem de titrare termometrică poate rezolva temperatura la 10-5 K dacă este cuplat la electronică de înaltă rezoluție. Dacă temperatura se schimbă în timpul efectuării titrării devine capuțin până la 0,001 K se va obține un punct de echivalență ascuțit. În cazul în care există o modificare a entalpiei, această tehnică poate fi aplicată în mod necesar oricărei reacții chimice într-un fluid, deși cinetica reacției joacă un rol important în calcularea clarității punctului final. Acest punct de titrimetrie a fost substanțialaplicat la titrarea acido-bazică, EDTA, REDOX și precipitare. Importantexemple de titrare a precipitațiilor includ:
- Sulfatetitrare cu ioni de bariu
- Fosfatetitrare cu magneziu în soluție de amoniu
- Cloridetitrare cu Azotat de argint
- Nickeltitrare cu Dimetilglioximă
- Fluoridetitrare cu aluminiu (ca K2NaAlF6)
titrările non-apoase pot fi efectuate cu ușurință ca titrare apoasă, deoarece sonda de temperatură nu necesită conectarea electrică la soluție, așa cum este necesar în titrările potențiometrice. Soluțiile care sunt foarte tulbure sau colorate pot fi analizate cu ușurință prin termometrie fără niciun tratament ulterior al unei probe. Sonda nu necesită întreținere. Acum o zi prin utilizarea celor mai recente și extrem de PR cu motor pas cu pas cu motor,titrările termometrice sunt finalizate în câteva minute, ceea ce face ca această tehnică să fie o alegere perfectă în cazul în care este necesară o producție ridicată într-un laborator.
spectroscopie:
în acest tip, spectroscopia este utilizată pentru a determina punctul de echivalență dacă spectrul reactantului, produsului sau titrantului este cunoscut. O cantitate specifică de produsși reactantul este utilizat pentru a găsi punctul de echivalență. Un nivel foarte scăzut deprezența titrantului liber poate fi, de asemenea, determinată. Pe scurt, această metodă este utilizatăpentru a determina existența semiconductorilor.
Amperometrie:
Amperometrieeste o tehnică de detectare care este utilizată pentru a măsura modificarea curentului.Amperometria este utilizată mai ales în acele titrări în care poate fi redus excesul de titrant. Această metodă este utilă în timpul titrării unei halogenuri cu Ag+, deoarece formarea precipitatelor nu va fi afectată.
Exemple de punct de echivalență:
- reacția unui acid puternic cu o bază puternică:
să presupunem că acidul clorhidric HCl (un acid puternic) este luat ca analit și hidroxidul de sodiu NaOH (bază puternică) este luat ca titrant. Dacă trasăm un grafic între pH-ul analitului și un NaOH titrant care poate fi adăugat din biuretă, se va forma un grafic de titrare așa cum este prezentat mai jos:
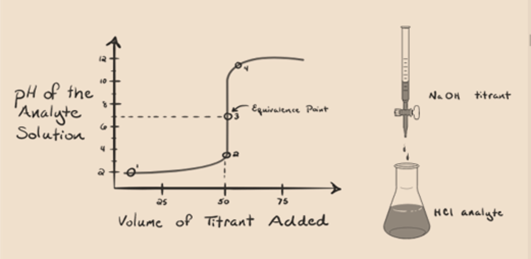
figura 1.1
figura 1.1 de mai sus arată la punctul 1 că atunci când nu se adaugă nicio bază ca NaOH. PH-ul analitului este scăzut, deoarece conține în cea mai mare parte H3O+ din separarea HCl.

pe măsură ce hidroxidul de sodiu NaOH este adăugat picătură cu picătură, începe să fie absorbit de Oh– încet, care este produs de disocierea NaOH. Analitul produs va fi acid datorită dominanțeiprezența ionilor de hidroniu, H3O+.
în figura 1.1 punctul 2 indică momentul în care pH-ul este înregistrat chiar înainte ca neutralizarea să aibă loc complet. În timp ce punctul 3 ne arată punctul de echivalență. Aici molii de hidroxid de sodiu adăugați sunt egali cu molii clorurii de hidroxil din analit. Acesta este punctul în care ionii de hidroniu, H3O+ sunt complet neutralizați de ionul hidroxil, OH–. PH-ul soluției este neutru, adică pH = 7 deoarece are sare, NaCl și apă H2O.
punctul 4 din figura 1.1 arată că, pe măsură ce continuăm să adăugăm NaOH, pH-ul soluției începe să devină bazic datorită neutralizării complete a HCl. Acum există o mulțime de OH– ioni sunt prezenți în soluția care disociază de NaOH.
- reacția unui acid slab cu o bază puternică:
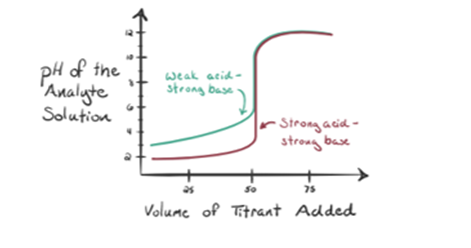
să considerăm un acid slab, un acid acetic CH3COOH și un hidroxid de sodiu puternic de bază NaOH ca titrant. Dacă trasăm un grafic între pH-ul analitului și volumul NaOH, vom obține o curbă de titrare așa cum se arată mai jos.
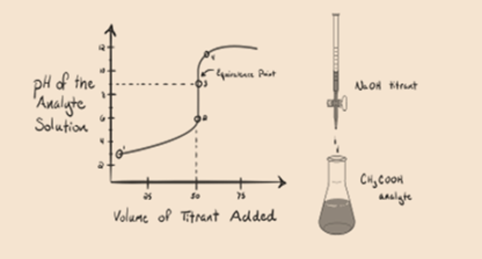
figura 1.2
figura 1.2 arată la punctul 1 că NaOH nu este încă adăugat, deci chiar acum pH-ul analitului este scăzut, deoarece conține în mare parte H3O+ când CH3COOH disociază. Dar, deoarece acidul acetic este un acid slab, prin urmare, inițial pH-ul său va fi mai mare.

pe măsură ce continuăm să adăugăm NaOH în picături, H3O+ va începe să fie consumat de OH– încet. Acest lucru va fi produs de disocierea lui NaOH. Dar aici analitul este încă acid datorită prezenței ionilor H3O + în cea mai mare parte.
figura 1.2 punctul 2 indică pH-ul înregistrat la un moment dat chiar înainte ca aneutralizarea să aibă loc complet.
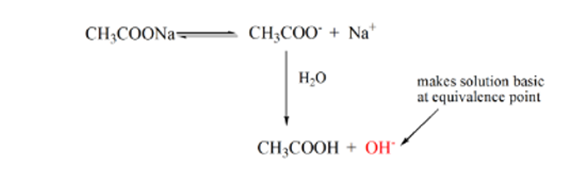
punctul 3 reprezintă punctul de echivalență. Acesta este punctul în care molii de NaOH sunt egali cu molii de CH3COOH într-un analit. Ionii de hidroniu sunt complet neutralizați de ionii hidroxilici. Soluția va conține apoi sare CH3COONa și H2O.

notă:
Youcan observa o diferență aici, în comparație cu un caz 1 cu A având un strongacid titrat împotriva unei baze puternice. În acest caz (acid slab și puternicbază), pH-ul nu este neutru într-un punct de echivalență. Soluția are un pH~9 la punctul de echivalență. Să ne dăm seama de motivul de mai jos.
din ecuația de mai sus, se arată că soluția conține CH3COONa la punctul de echivalență. Aceasta se disociază într-un ion de sodiu și ioni de acetat. Ionul acetat este baza conjugată a acidului slab CH3COOH. Prin urmare, CH3COO– este relativ o bază puternică (adică acidul slab are o bază conjugată puternică), prin urmare reacționează cu apa pentru a produce ioni de hidroxid care cresc pH-ul până aproape de 9 în punctul de echivalență.
punctul 4 din figura 1.2 arată că atunci când hidroxidul de sodiu este în cantitate mai mare, curba de titrare câștigată va fi identică cu HCl-NaOH.
- Strongacid cu o bază slabă:
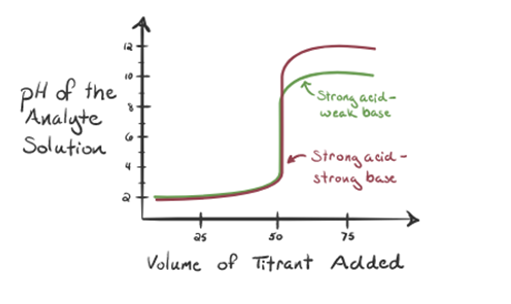
aici, să considerăm acidul clorhidric ca un acid puternic ca analit și amoniacul ca o bază slabă ca titrant. Dacă trasăm un grafic între pH-ul soluției de analit și volumul titrantului NH3, vom obține o curbă de titrare așa cum este prezentată mai jos:
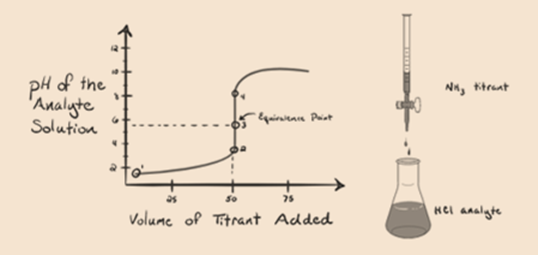
figura 1.3
din figura 1.3 punctul 1 arată că atunci când nu se adaugă amoniac, pH-ul analitului va fi scăzut, deoarece conține în cea mai mare parte H3O+ din disocierea acidului clorhidric.
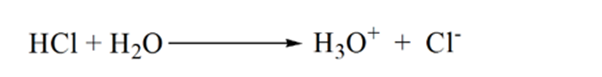
pe măsură ce amoniacul este adăugat picătură cu picătură, H3O+ începe să fie consumat lent de amoniac. Analitul va fi încă acid datorită majorității ionilor H3O+.
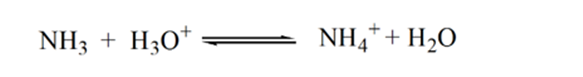
punctul 2 din figura 1.3 indică faptul că pH-ul este înregistrat într-un punct chiar înainte ca aneutralizarea să aibă loc complet.
Punctul3 arată punctul de echivalență. Aici numărul de moli de NH3 adăugateste egal cu molii HCl din analit. Ionii de hidroniu sunt completneutralizați de NH3.
notă:
se observă că în cazul bazei slabe împotriva unui acid puternic, pH-ul nu este neutru în punctul de echivalență. Prin urmare, soluția care se realizeazăva fi acid având un pH în jur de 5,5 la punctul de echivalență.
motivul pentru aceasta este că într-un punct de echivalență soluția are numai ioni de amoniu NH4+ și ioni de clor, CL -. Deoarece ionii de amoniu sunt acidul conjugat al unei baze slabe, adică NH3. Prin urmare, NH4+ este un acid puternic și astfel NH4+ va reacționa cu apa pentru a produce ioni de hidroniu ceea ce face soluția acidă.
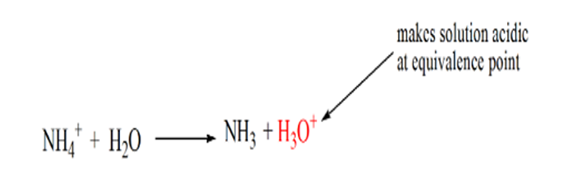
punctul 4 arată că, după atingerea unui punct de echivalență, vom continua să adăugăm amoniac și, atunci când este în exces, pH-ul va începe să crească. Amoniacul este o bază slabă, astfel încât pH-ul său este peste 7, dar este la fel de scăzut în comparație cu o bază puternică NaOH prezentată în cazul 1.
- Weakbase cu un acid slab:
să luăm în considerare amoniacul, o bază slabă ca analit și un acid acetic care este un acid slab ca titrant. Dacă trasăm un grafic între pH-ul soluției de analit față de volumul acidului acetic ca titrant, vom obține o curbă de titrare ca mai jos:
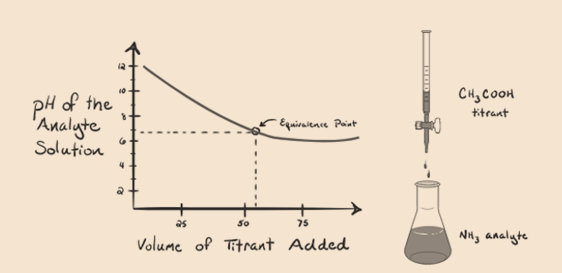
figura 1.4
am observat că nu există nici o abruptă în acest grafic grafic. Acesta este ceea ce numim un”punct de inflexiune” în punctul de echivalență. Absența modificării abrupte necesare a pH-ului nu ne oferă prea multe informații printr-o astfel de buclă.