em Química, ponto de equivalência é um termo usado durante a realização da titulação. Aplica-se a qualquer reacção de ácido-base ou neutralização tecnicamente.
definição:
o ponto de equivalência de uma reacção química é o ponto em que quantidades iguais de reagentes são fixadas quimicamente.
por outras palavras, enquanto se titula, é um ponto em que a quantidade de titulante adicionado é suficiente para neutralizar completamente a solução do analito. = = Ligações externas = = a solução-padrão é igual aos moles de uma solução com uma concentração desconhecida. É também conhecido como ponto estequiométrico porque é um ponto onde os moles de ácido é igual aos moles da base que são necessários para neutralizar a solução. Note que a relação ácido / base não precisa ser 1:1. Esta razão ácido-base é explicada pela equação química ácido-base equilibrada. Os indicadores podem ser utilizados para este fim, por exemplo, laranja-metilo ou fenolftaleína.

o ponto de equivalência não pode ser tomado como o ponto final de uma titulação. O objectivo é referenciado como o ponto em que o indicador usado muda a sua cor. Estas alterações moleculares surgem após a obtenção do ponto de equivalência. Se usarmos oendpoint para determinar a equivalência, induzirá um erro.
Métodos de determinação do ponto de equivalência:
existem métodos diferentes para a determinação do ponto de equivalência. São debatidas da seguinte forma::
- indicador de pH
- Condutância
- Alteração de Cor
- Precipitação
- calorimetria Isotérmica
- Thermometric titrimetry
- Espectroscopia
- Amperometry
indicador de pH:
apH indicador é uma substância química que muda de cor em reação ao anychemical mudança. Um indicador ácido-base, por exemplo, a fenolftaleína altera a sua cor, que depende do seu pH. os indicadores Redox também podem ser utilizados para este fim. Inicialmente, apenas uma única gota de solução indicadora é adicionada à titulação. A mudança de cor mostrará que o endpoint foi atingido.Esta será uma estimativa do ponto de equivalência.
condutância:
a condutividade eléctrica de uma solução é afectada pelos iões. Daí que a condutividade mude quando reagem uns com os outros. (por exemplo, ao executar uma titulação ácido-base, os H3O+, e OH – íons reagem e formam água autral, solução H20). Condutância é relativamente um método difícil tooperate, especialmente quando os íons que estão presentes na solução podem participar na condutividade. A condutância pode ser usada para algumas acid-basereactions.
mudança de cor:
no ponto de equivalência, a solução mudará a sua cor naturalmente sem qualqueradição de um indicador em algumas reações. Isto pode ser observado em transições onde o estado de oxidação consiste de cores diferentes.
precipitação:
durante a titulação, o precipitado formar-se-á se a reacção se formar um sólido. Um bom exemplo de precipitação é a reação entre prata, Ag+, e cloro, Cl – que resulta na formação de sal aninsolúvel, Cloreto De Prata, AgCl. Inesperadamente, isso faz com que seja muito difícil determinar os parâmetros com precisão por causa do tamanho das partículas, a taxa de aplicação e cor torna muito difícil de ver. Esta é a razão pela qual a titulação de apreciação é feita como titulação posterior.
Calorimetria isotérmica:
a determinação do ponto de equivalência é feita calculando a quantidade de calor que é produzido ou absorvido usando um dispositivo conhecido como um titrationcalorímetro isotérmico. Este tipo é geralmente usado em titulações que envolvem ações bioquímicas, ou seja, como ligação enzimática.
Titulometria termométrica:
a Termometricitrimetria é uma técnica excepcionalmente multifacetada. Aqui o ponto equivalente é determinado medindo a taxa de variação de temperatura produzida pela reação aquímica. Esta propriedade diferencia-a da calorimetria. Uma vez que a titimetria termométrica é uma técnica relativa, não é necessário efectuar a titulação em condições isotérmicas. Este tipo de titulação pode ser realizada em plásticos ou mesmo em recipientes de vidro. Para prevenir a seca, estes navios são geralmente fechados por causar qualquer ruído que perturbe o ponto final. Devido à capacidade deste tipo de titulação para ser realizado em condições ambientais, são adequados para o processo rotineiro e o controlo da qualidade na indústria. A temperatura irá aumentar a ordecrease durante o processo de titulação, dependendo se a reacção que ocorre entre o obtentor e o analito é exotérmica ou endotérmica. Ititração quando todo o analito foi consumido pela reação, a taxa de temperatura muda. um aumento ou diminuição determina o ponto equivalente e inflexão na curva de temperatura pode ser observado. O ponto equivalente pode ser observado com precisão empregando a segunda derivada da curva de temperatura. O software que é usado em um moderno sistema automatizado de titulação termométrica consiste em algoritmos digitais avançados regulares que o ruído gerado a partir de sondas de temperatura altamente sensíveis não causa qualquer interferência com o aparecimento de um pico seconderivativo regular e uniforme que descreve o endpoint. Esta técnica tem a capacidade de precisão muito alta e o coeficiente de variância (CVs) de menos de 0,1 são usuais. As últimas sondas de temperatura de titulação termométrica têm um termistor que forma um braço de uma ponte de Wheatstone. o melhor sistema de titulação termométrica pode reduzir a temperatura para 10-5 K se associado à electrónica de alta resolução. Se as alterações de temperatura durante a realização da titulação se tornarem tão pequenas como 0,001 K, será obtido um ponto de equivalência nítido. Onde há uma mudança anentalpia, esta técnica pode ser aplicada necessariamente a qualquer reação química em um fluido, embora a cinética de reação desempenha um papel importante no cálculo da nitidez do endpoint. Este ponto de titimetria foi substancialmente aplicado à titulação ácido-base, EDTA, REDOX e precipitação. Exemplos importantes de titulação de precipitação incluem::
- Sulfatetitration com íons Bário
- Phosphatetitration com Magnésio em solução de amónio
- Chloridetitration com Nitrato de prata
- Nickeltitration com Dimetilglioxima
- Fluoridetitration com Alumínio (K2NaAlF6)
Asnon-aquosa titulações pode ser facilmente realizado, conforme aquosa de titulação becausethe sonda de temperatura não requer, para ser ligado electricamente a thesolution como ela é necessária em potenciométrica titulações. As soluções que são altamente turvas ou coloridas podem ser facilmente analisadas por termometria sem qualquer tratamento adicional de uma amostra. A sonda não tem manutenção. Agora, um dia, utilizando as mais recentes e altamente pré-preparadas burettes com motor de estepe, as titrações termométricas são concluídas em poucos minutos, tornando a tecnologia uma escolha perfeita onde é necessária uma elevada produção em laboratório.
espectroscopia:
neste tipo, espectroscopia é usada para determinar o ponto de equivalência se o espectrum do reagente, produto ou titular for conhecido. Uma quantidade específica do produto e reagente é usada para encontrar o ponto de equivalência. Pode também ser determinado um nível muito baixo da presença dos três titulares. Em suma, este método é utilizado para determinar a existência de semicondutores.
Amperometria:
Amperometry é uma técnica de detecção que é usada para medir a mudança na corrente.A amperometria é utilizada principalmente nas titulações em que o excesso de titularidade pode ser reduzido. Este método é útil ao Titular um haleto com Ag+ porque a formação de precipitados não será afectada.Exemplos de pontos de equivalência:
- A reação de um ácido forte com uma base forte:
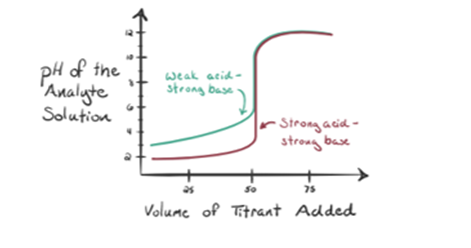
Vamos supor ácido clorídrico, HCl (um ácido forte) é tomado como um analito e de hidróxido de sódio NaOH (base forte) é tomado como um titrant. Se desenharmos um gráfico entre o pH analito e um NaOH titular que pode ser adicionado a partir da bureta, um grafo de titulação será formado como é dado abaixo:
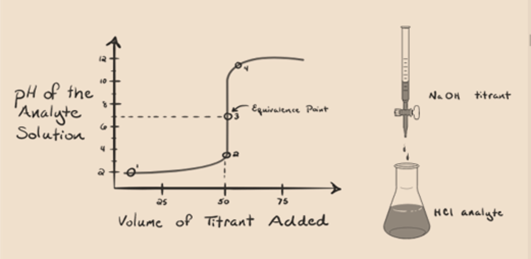
figura 1.1
a figura 1.1 acima mostra, no ponto 1, que quando não se adiciona nenhuma base como NaOH. O pH do analito é baixo, pois ele contém principalmente H3O+ da separação do HCl.

à medida que o hidróxido de sódio NaOH é adicionado gota a gota, ele começa a ser absorvido por OH– lentamente que é produzido peladissociação de NaOH. O analito produzido será ácido devido à predominância de íons hidrônicos, H3O+.
na figura 1.1, o ponto 2 indica o momento em que o pH é registado imediatamente antes da neutralização ocorrer completamente. Enquanto o ponto 3 nos mostra o ponto de equivalência. Aqui os moles do hidróxido de sódio adicionado é igual aos moles do cloreto de hidroxilo no analito. Este é o ponto onde íons hidrônio, H3O+ são completamente neutralizados pelo íon hidroxilo, OH -. O pH da solução é neutro, isto é, pH = 7 porque tem sal, NaCl e água H2O..
o ponto 4 da figura 1.1 mostra que à medida que continuamos adicionando NaOH, o pH da solução começa a se tornar básico por causa da neutralização completa do HCl. Agora há uma abundância de Oh– ions estão presentes na solução que dissocia de NaOH.
- a reacção de um ácido fraco com uma base forte:
vamos considerar um ácido fraco, um ácido acético CH3COOH e uma base forte de hidróxido de sódio NaOH como um titular. Se traçar um gráfico entre o pH do analito e o volume de NaOH, teremos uma curva de titulação como mostrado abaixo.
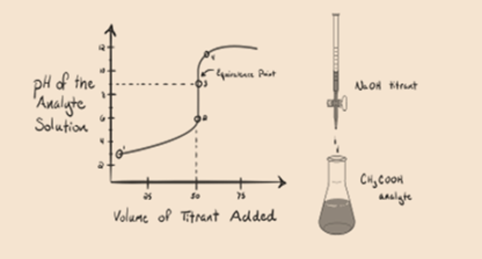
a figura 1.2
a figura 1.2 mostra, no ponto 1, que a NaOH ainda não é adicionada, por isso, neste momento o pH do analito é baixo, pois ele contém principalmente H3O+ quando o CH3COOH dissocia-se. Mas como o ácido acético é um ácido fraco, portanto, o seu pH inicial será maior.

à medida que continuamos a adicionar NaOH dropwise, o H3O+ começará a ser composto por Oh– slowly. Isto será produzido pela dissociação de NaOH. Mas aqui o analito ainda é ácido devido à presença de H3O+ions principalmente.
Infigure 1.2 o ponto 2 indica o pH registado num momento pouco antes de a aneutralização ter lugar completamente.
o ponto 3 representa o ponto de equivalência. Este é o ponto onde moles de NaOH é igual aos moles de CH3COOH em um analito. Os íons hidrônicos são completamente neutralizados por íons hidroxila. A solução conterá então sal e H2O de CH3COONa..

Nota:
pode notar uma diferença aqui em comparação com um caso 1 com a tendo um strongacid titulado contra uma base forte. Neste caso (ácido fraco e uma base forte), o pH não é neutro em um ponto de equivalência. A solução é ter um pH~9 no ponto de equivalência. Vamos descobrir a razão lá em baixo.
da equação acima, é mostrado que a solução contém CH3COONa no ponto de equivalência. Isto dissocia-se em iões de sódio e acetato. Íon acetato é a base conjugada do ácido fraco CH3COOH. Portanto, CH3COO – é uma base relativamente forte (ou seja, ácido fraco tem uma base conjugada forte), portanto, eles reagem com a água para produzir íons de hidróxido que aumentam o pH para perto de 9 no ponto de equivalência.
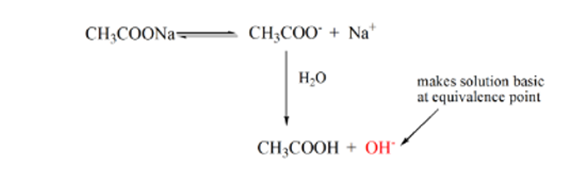
o ponto 4 da figura 1.2 mostra que, quando o hidróxido de sódio estiver em maior quantidade, a curva de titulação obtida será idêntica à HCl-NaOH.
- Strongacid com uma base fraca:
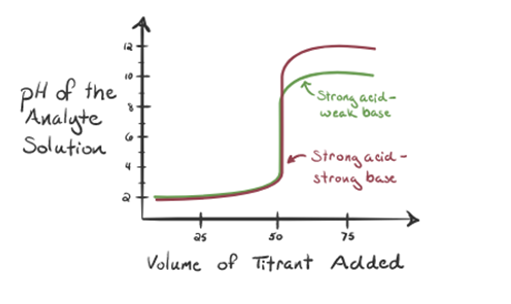
Aqui, vamos considerar o ácido clorídrico como um ácido forte como um analito e amônia como uma base fraca como um titrant. Se nós plotar um gráfico entre o pH da solução do analito e do volume de titrant NH3, vamos obter uma curva de titulação conforme indicado abaixo:
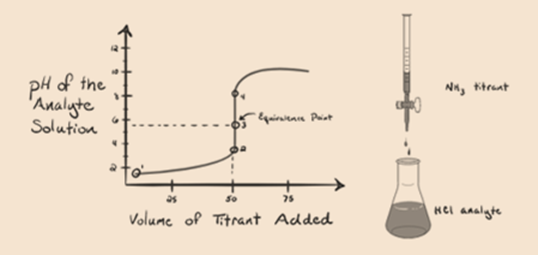
Figura 1.3
Na figura 1.3 ponto 1 mostra que, quando não amônia é adicionada, o pH do analito vai ser baixo, pois a maioria contém H3O+ a partir da dissociação do ácido Clorídrico.
como a amônia é adicionada gota a gota, H3O+ começa a ser consumido lentamente por amônia. O analito ainda será ácido devido à maioria dos íons H3O+.
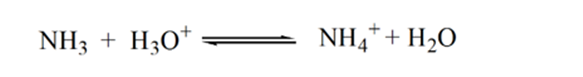
o ponto 2 na figura 1.3 indica que o pH é registrado em um ponto imediatamente antes da aneutralização ocorrer completamente.
Point3 mostra o ponto de equivalência. Aqui o número de moles de NH3is adicionados é igual aos moles de HCl no analito. Os íons de hidrônio são completeneutralizados pelo NH3.
Nota:
Itis noticed that in the case of the weak base against a strong acid, the pH isnot neutral at the point of equivalence. Assim, a solução alcançada será ácida com um pH de cerca de 5,5 no ponto de equivalência.
a razão para isso é que num ponto de equivalência a solução tem apenas iões amónio NH4+ e iões cloreto, CL-. Como os íons de amônio são o ácido conjugado de uma base fraca, ou seja, NH3. Portanto, NH4+ é um ácido forte e, portanto, NH4+ irá reagir com água para produzir íons de hidrônio que torna a solução ácida.
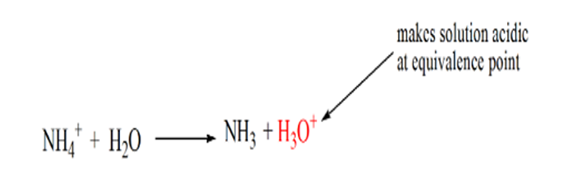
o ponto 4 mostra que, depois de alcançar um ponto de equivalência, vamos continuar adicionando amônia e quando em excesso, o pH vai começar a aumentar. Amônia é uma base fraca de modo que seu pH é acima de 7, mas é tão menor em comparação com uma base forte NaOH mostrado no caso 1.
- Weakbase com um ácido fraco:
Vamos considerar a amônia, uma base fraca como um analito e um ácido acético, que é um ácido fraco, como um titrant. Se nós plotar um gráfico entre o pH da solução do analito versus o volume do ácido acético como um titrant, vamos obter uma curva de titulação, conforme abaixo:
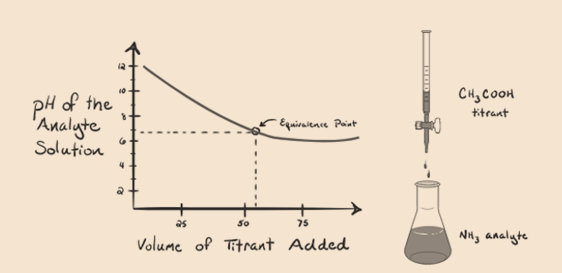
Figura 1.4
Wehave notado que não há íngreme neste gráfico enredo. Isto é o que chamamos de”ponto de inflexão” no ponto de equivalência. A ausência de uma mudança íngreme no pH não nos dá muita informação através de tal acurve.