v chemii je bod ekvivalence termín, který se používá při provádění titrace. Platí pro jakoukoli acidobazickou nebo neutralizační reakci.
definice:
bod ekvivalence chemické reakce je bod, ve kterém jsou chemicky smíchány stejné množství reaktantů.
jinými slovy, při titraci je to bod, kdy množství přidaného titrantu stačí k úplné neutralizaci roztoku analytu. Počet molů titrantu, tj. standardní roztok se rovná molům roztoku s neznámou koncentrací. To je také známé jako stechiometrický bod, protože to je bod, kde molů kyseliny je rovno znaménka základny, které jsou potřebné k neutralizaci roztoku. Všimněte si, že poměr kyseliny a báze nemusí být 1: 1. Tento poměr acidobazické báze je vysvětlen vyváženou chemickou rovnicí acidobazické báze. Pro tento účel lze použít indikátory, například methyl orange nebo fenolftalein.

bod ekvivalence nelze brát stejně jako koncový bod titrace. Koncový bod se označuje jako bod, ve kterém použitý indikátor mění barvu. Tytozměny barvy se objeví po dosažení bodu ekvivalence. Použijeme – li bod k určení ekvivalence, vyvolá to chybu.
metody stanovení bodu ekvivalence:
existují různé metody pro stanovení bodu ekvivalence. Jsou diskutovány následující:
- pH indikátor
- Vodivost
- Změna Barvy
- Srážky
- Izotermické kalorimetrie
- Thermometric titrace
- Spektroskopie
- Amperometrii
pH indikátor:
apH indikátor je chemická látka, která mění svou barvu v reakci na anychemical změnit. Kyselina-base ukazatele, například, fenolftalein změníjeho barvu, která závisí na jeho pH. Redoxní indikátory mohou být také použity pro tento účel. Zpočátku se k nim přidá pouze jedna kapka indikátorového roztoku. Změna barvy ukáže, že koncový bod byl dosažen.Toto bude odhad bodu ekvivalence.
vodivost:
elektrická vodivost roztoku je ovlivněna ionty. Proto se vodivost mění, když reagují navzájem. (například při provádění acidobazické titrace reagují ionty H3O+ a OH a tvoří seneutrální voda, roztok H20). Vodivost je poměrně obtížná metodaodolný, zvláště když ionty přítomné v roztoku mohoupodílet se na vodivosti. Vodivost může být použita pro několik kyselých základenreakce.
Změna barvy:
v bodě ekvivalence roztok změní svou barvu přirozeně bez jakéhokoli přidání indikátoru v některých reakcích. To lze pozorovat při přechodukovy, kde oxidační stav sestává z různých barev.
srážení:
během titrace se sraženina vytvoří, pokudreakce vytvoří pevnou látku. Dobrým příkladem srážení je reakcemezi stříbrem, Ag+ a chlorem, Cl-což vede k tvorbě nerozpustné soli, chloridu stříbrného, AgCl. Neočekávaně je to velmi těžkéurčení koncových bodů přesně kvůli velikosti částic, rychlosti sedimentace a barvě je velmi obtížné vidět. To je důvod, proč se titrace srážek provádí jako titrace zpět.
Izotermická kalorimetrie:
stanovení bodu ekvivalence se provádí výpočtem množství tepla, které se vyrábí nebo absorbuje pomocí zařízení známého jako izotermický titrační kalorimetr. Tento typ se obvykle používá v titracích, které zahrnují biochemickéreakce tj. jako vazba enzymu.
Termometrická Titrimetrie:
Termometrická Titrimetrie je výjimečně mnohostranná technika. Zde je ekvivalencebod je určen měřením rychlosti změny teploty produkované achemickou reakcí. Tato vlastnost ji odlišuje od kalorimetriktitrimetrie. Protože termometrická titrimetrie je relativní technika, nenínezbytné provést titraci za izotermických podmínek. Tento typtitrace může být prováděna v plastech nebo dokonce ve skleněných nádobách. Aby se zabránilo průvanu, jsou tyto nádoby obvykle uzavřeny tím, že způsobují jakýkoli hluk, který narušuje koncový bod. Vzhledem ke schopnosti tohoto typu titrace býtprováděné za okolních podmínek, jsou vhodné pro rutinní proces a kontrolu kvality v průmyslu. Teplota se během titračního procesu buď zvýší, nebo sníží, v závislosti na tom, zda je reakce mezi titrantem a analytem exotermická nebo endotermická. Pokud byl reakcí spotřebován veškerý analyt, rychlost teplot se mění, tj. zvýšení nebo snížení určuje ekvivalencibod a skloňování v teplotní křivce lze pozorovat. Rovnocenný bod lze přesně pozorovat použitím druhé derivace křivky teploty. Software, který se používá v moderní automatedthermometric titrační systém se skládá z pravidelné pokročilé digitální algorithmsso, že hluk generování z vysoce citlivé teplotní sondy nenívyvolávají jakýkoli zásah s výskytem pravidelné, jednotné secondderivative vrchol, který popisuje sledovanou vlastnost. Tato technika má schopnostvelmi vysoká přesnost a koeficient rozptylu (CVs) menší než 0,1 areusual. Nejnovější termometrické titrační teplotní sondy mají termistor, který tvoří jedno rameno Wheatstonova mostu. nejlepší termometrická titracesystém může vyřešit teplotu na 10-5 K, pokud je spojen s vysokým rozlišením. Pokud se teplota během titrace změní jakomálo jako 0,001 K, získá se ostrý bod ekvivalence. Tam, kde je anenthalpy změnit, tato technika může být použita nutně žádné chemické reactionin tekutiny, i když reakce kinetika hraje důležitou roli v calculatingthe ostrost koncového bodu. Tento bod titrimetrie byl podstatněaplikované na acidobazickou, EDTA, redoxní a srážkovou titraci. Důležitépříklady titrace srážek zahrnují:
- Sulfatetitration s Barnaté ionty
- Phosphatetitration s Hořčíkem v amonného roztok
- Chloridetitration s Dusičnanem stříbrným
- Nickeltitration s Dimethylglyoxime
- Fluoridetitration s Hliníkovým (jako K2NaAlF6)
Asnon-vodné titrace může být snadno provedena jako vodný titrace, protože teplotní sonda nevyžaduje, aby být elektricky připojen k thesolution, jak je to vyžadováno v potenciometrickou titrací. Roztoky, které jsouvysoce zakalené nebo barevné, lze snadno analyzovat termometricky bez jakéhokoli dalšího zpracování vzorku. Sonda je bezúdržbová. Teď den byusing nejnovější a vysoce précised krokový motor řízený byrety o objemu,thermometric titrací jsou dokončeny během několika minut, což thistechnique ideální volbou tam, kde vysoká produkce v laboratoři je potřeba.
spektroskopie:
v tomto typu se spektroskopie používá ke stanovení bodu ekvivalence, pokud je známo spektrum reaktantu, produktu nebo titrantu. Specifické množství produktua reaktant se používá k nalezení bodu ekvivalence. Lze také určit velmi nízkou úroveň přítomnosti volného titrantu. Stručně řečeno, tato metoda se používáurčit existenci polovodičů.
Amperometrie:
Amperometrieje detekční technika, která se používá k měření změny proudu.Amperometrii je většinou používán v těchto titrací, kde přebytek titrantu můžete sníží. Tato metoda je užitečná při titraci halogenidu Ag+, protože tvorba sraženin nebude ovlivněna.
příklady bodu ekvivalence:
- reakce silné kyseliny se silnou základnou:
Nechť předpokládejme, že kyselina chlorovodíková HCl (silná kyselina) je brán jako analytu a hydroxidu sodného NaOH (silná základna) je přijata jako titrantu. Pokud bychom do grafu mezi analytu, pH a titrantu NaOH, které mohou být přidány z byrety, titrace graf bude tvořen jako je uveden níže:
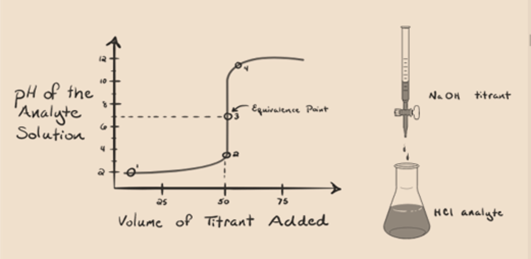
Obrázek 1.1
výše uvedený obrázek 1.1 ukazuje na bod 1, že když se žádná základna jako NaOH se přidá. PH analytu je nízké, protože většinou obsahuje H3O+ ze separace HCl.

když se přidá hydroxid sodný NaOH po kapkách, začne se absorbovat OH-pomalu, který je produkován disociací NaOH. Produkovaný analyt bude kyselý díky dominantnímupřítomnost hydroniových iontů, H3O+.
na obrázku 1.1 bod 2 označuje časový bod, ve kterém je pH zaznamenáno těsně před úplnou neutralizací. Zatímco bod 3 nám ukazuje bod ekvivalence. Zde se moly přidaného hydroxidu sodného rovnají molům hydroxylchloridu v analytu. To je místo, kde hydroniové ionty, H3O+ jsou zcela neutralizovány hydroxylovým iontem, OH -. PH roztoku je neutrální, tj. pH=7, protože to má sůl, NaCl a vody H2O.
Bod 4 obrázek 1.1 ukazuje, že jak jsme se udržet na přidávání NaOH, pH roztoku začne být základní, protože úplné neutralizaci HCl. Nyní existuje spousta OH-ionty jsou přítomny v roztoku, který odděluje od NaOH.
- reakce slabé kyseliny se silnou bází:
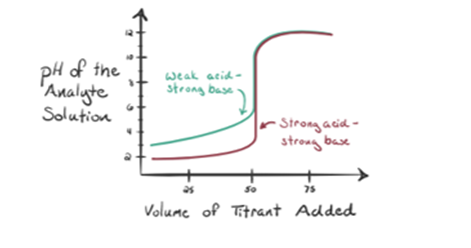
uvažujme slabou kyselinu, kyselinu octovou CH3COOH a silnou bázi hydroxidu sodného NaOH jako titrant. Pokud vykreslíme graf mezi pH analytu a objemem NaOH, dostaneme titrační křivku, jak je znázorněno níže.
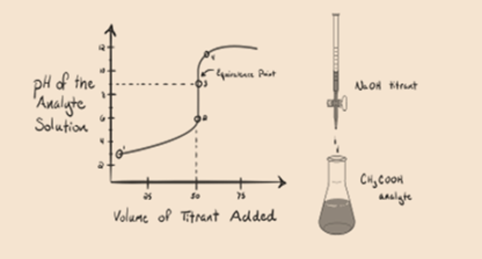
obrázek 1.2
obrázek 1.2 ukazuje v bodě 1, že NaOH ještě není přidán, takže právě teď je pH analytu nízké, protože většinou obsahuje H3O+, když se CH3COOH disociuje. Ale protože kyselina octová je slabá kyselina, proto zpočátku bude její pH vyšší.

Jsme udržet na přidávání NaOH po kapkách, H3O+ začne gettingconsumed tím, OH– pomalu. To bude produkováno disociacínaoh. Zde je však analyt stále kyselý díky přítomnosti iontů H3O+.
Infigure 1.2 bod 2 označuje pH zaznamenané v době těsně před úplnou aneutralizací.
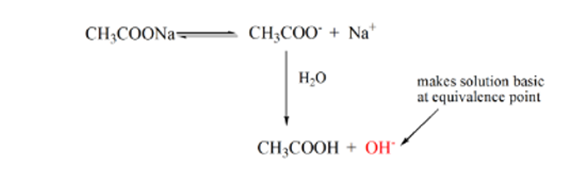
bod 3 představuje bod ekvivalence. Toto je bod, kdy se mol NaOH rovná molům CH3COOH v analytu. Hydroniové ionty jsou zcela neutralizovány hydroxylovými ionty. Řešení bude pak obsahovat CH3COONa soli a H2O.

Poznámka:
Můžete všimnout, rozdíl oproti případu 1 s s strongacid titrována proti silnou základnu. V tomto případě (slabá kyselina a silnázákladna) není pH neutrální v bodě ekvivalence. Řešení má pH~9 v bodě ekvivalence. Pojďme zjistit důvod níže.
z výše uvedené rovnice je ukázáno, že roztok obsahuje Ch3coonu v bodě ekvivalence. To se disociuje na ionty sodíku a acetátové ionty. Acetátový ion je konjugovaná báze slabé kyseliny CH3COOH. Slabá kyselina má silnou konjugovanou bázi) proto reagují s vodou za vzniku hydroxidových iontů, které zvyšují pH na téměř 9 v bodě ekvivalence.
bod 4 na obrázku 1.2 ukazuje, že pokud je hydroxid sodný ve větším množství, získaná titrační křivka bude identická s HCl-NaOH.
- Strongacid se slabou základnou:
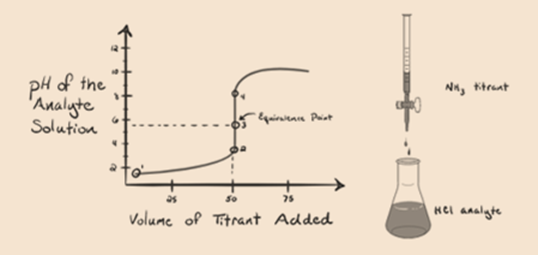
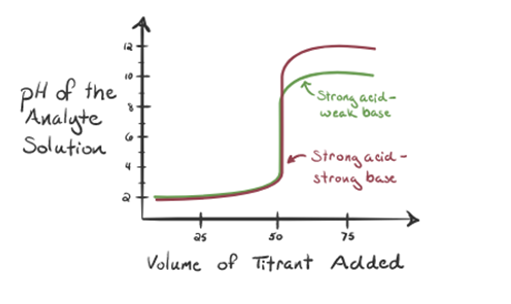
zde uvažujme kyselinu chlorovodíkovou jako silnou kyselinu jako analyt a amoniak jako slabou bázi jako titrant. Pokud bychom do grafu mezi pH roztoku analytu a objemu titrantu NH3, získáme titrační křivky, jak je uvedeno níže:
Obrázek 1.3
Na obrázku 1.3 bodu 1 ukazuje, že když žádný amoniak je přidáno, pH analytu bude nízké, jak je to většinou obsahuje H3O+ z disociace kyseliny Chlorovodíkové.
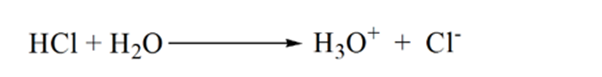
jak se přidává amoniak po kapkách, H3O+ začne pomalu spotřebovávat amoniak. Analyt bude stále kyselý kvůli většině iontů H3O+.
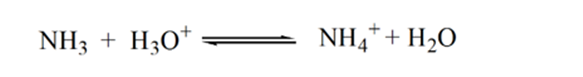
Bodové2 obrázek 1.3 ukazuje, že pH je zaznamenán v bodě těsně před aneutralization probíhá zcela.
Point3 ukazuje bod ekvivalence. Zde je počet molů přidaného Nh3se rovná molům HCl v analytu. Hydroniové ionty jsou plněneutralizovány NH3.
Poznámka:
Všiml jsem si, že v případě slabé báze proti silné kyselině není pH v bodě ekvivalence neutrální. Řešení, které je dosaženobude kyselé s pH kolem 5,5 v bodě ekvivalence.
důvodem je to, že v bodě ekvivalence má roztok pouze amonné ionty NH4+ a chloridové ionty, CL -. Jako amonné ionty jsou konjugovaná kyselina slabé báze, tj. Proto, NH4+ je silná kyselina, a tedy NH4+ reagují s vodou k výrobě vodíku ionty, které je roztok kyselý.
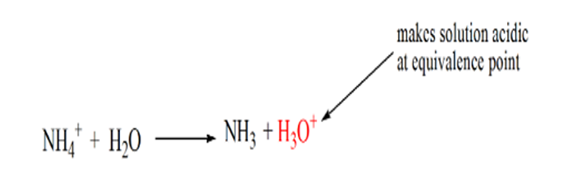
bod 4 ukazuje, že po dosažení bodu ekvivalence budeme pokračovat v přidávání amoniaku a při nadbytku se pH začne zvyšovat. Amoniak je slabá báze, takže jeho pH je nad 7 ale je nižší ve srovnání se silnou bází NaOH ukázanou v případě 1.
- Weakbase s slabé kyseliny:
podívejme se amoniak je slabá báze jako analytu a octové kyseliny, která je slabou kyselinou jako titrantu. Pokud bychom do grafu mezi pH analytu řešení versus objem kyseliny octové jako titrantu, získáme titrační křivky, jak je uvedeno níže:
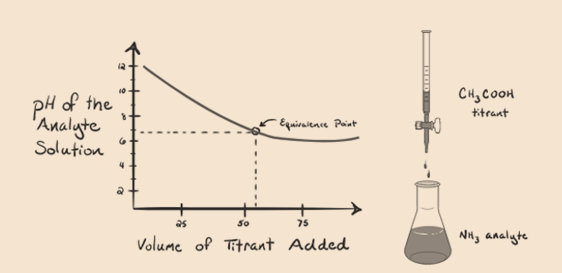
Obrázek 1.4
Máme si všiml, že tam je žádné strmé v tomto grafu plot. Tomu říkáme „bod skloňování“ v bodě ekvivalence. Absence prudké změny pH nám nedává mnoho informací prostřednictvím takové acurvédy.