w chemii punkt równoważności jest terminem używanym podczas miareczkowania. Stosuje się do każdej reakcji kwasowo-zasadowej lub neutralizacji technicznie.
definicja:
punkt równoważności reakcji chemicznej jest punktem, w którym równe ilości reagentów są mieszane chemicznie.
innymi słowy, podczas miareczkowania jest to punkt, w którym ilość dodanego titrantu wystarcza do całkowitego zneutralizowania roztworu analitu. Liczba moli titranta tj. roztwór wzorcowy jest równy molom roztworu o nieznanym stężeniu. Jest również znany jako punkt stechiometryczny, ponieważ jest to punkt, w którym Mole kwasu są równe molom zasady, które są potrzebne do zneutralizowania roztworu. Należy pamiętać, że stosunek kwasu do zasady nie musi być 1:1. Ten stosunek kwasowo-zasadowy jest wyjaśniony przez zrównoważone równanie chemiczne kwasowo-zasadowe. Do tego celu można wykorzystać Wskaźniki, na przykład pomarańcz metylową lub fenoloftaleinę.

punkt równoważności nie może być traktowany tak samo jak punkt końcowy miareczkowania. Punkt końcowy jest określany jako punkt, w którym używany wskaźnik zmienia swój kolor. Zmiany koloru pojawiają się po osiągnięciu punktu równoważności. Jeśli użyjemy punktu do określenia równoważności, spowoduje to błąd.
metody wyznaczania punktu równoważności:
istnieją różne metody wyznaczania punktu równoważności. Są one omawiane jako następstwa:
- wskaźnik pH
- przewodność
- Zmiana Koloru
- opady
- kalorymetria izotermiczna
- miareczkowanie termometryczne
- Spektroskopia
- amperometria
wskaźnik ph:
wskaźnik APH to substancja chemiczna, która zmienia swój kolor w reakcji na dowolną zmianę chemiczną. Wskaźnik kwasowo-zasadowy, na przykład fenoloftaleina, zmienia swój kolor, który zależy od jej pH. do tego celu można również użyć wskaźników redoks. Początkowo do roztworu dodawana jest tylko jedna kropla roztworu wskaźnikowego. Zmiana koloru pokaże, że punkt końcowy został osiągnięty.Będzie to oszacowanie punktu równoważności.
przewodność:
na przewodność elektryczną roztworu wpływają jony. Dlatego przewodnictwo zmienia się, gdy reagują ze sobą. (na przykład, podczas miareczkowania kwasowo-zasadowego, jony H3O+ i OH – reagują i tworzą wodę syntetyczną, roztwór H20). Przewodnictwo jest stosunkowo trudną metodą, zwłaszcza gdy jony obecne w roztworze mogą mieć wpływ na przewodnictwo. Przewodnictwo może być stosowane dla kilku zasad kwasowychdziałania.
zmiana koloru:
w punkcie równoważności rozwiązanie w naturalny sposób zmieni kolor bez podania wskaźnika w niektórych reakcjach. Można to zaobserwować w metaliach przejściowych, w których stan utleniania składa się z różnych kolorów.
wytrącanie:
podczas miareczkowania osad utworzy się, jeśli reakcja utworzy ciało stałe. Dobrym przykładem wytrącania jest reakcja między srebrem, Ag+ i chlorem, Cl -, która powoduje powstanie soli rozpuszczalnej, chlorku srebra, AgCl. Nieoczekiwanie, to sprawia, że bardzo trudno jest dokładnie określić punkty końcowe ze względu na wielkość cząstek, szybkość osadzania i kolor sprawia, że bardzo trudno jest zobaczyć. To jest powód whyprecipitation miareczkowanie odbywa się jako powrotem miareczkowanie.
kalorymetria izotermiczna:
określenie punktu równoważności odbywa się poprzez obliczenie ilości ciepła, które jest wytwarzane lub pochłaniane za pomocą urządzenia znanego jako kalorymetr miareczkowania izotermicznego. Ten typ jest zwykle używany w miareczkowaniu, które obejmuje biochemiczne reakcje, tj. jako Wiązanie enzymów.
miareczkowanie termometryczne:
miareczkowanie termometryczne jest techniką wyjątkowo wieloaspektową. Tutaj równoważność wyznaczana jest przez pomiar szybkości zmian temperatury wywołanych reakcją achemiczną. Właściwość ta odróżnia ją od kalorymetryczności. Ponieważ miareczkowanie termometryczne jest techniką względną, nie jest konieczne wykonywanie miareczkowania w Warunkach izotermicznych. Ten rodzaj wytworzenia może być przeprowadzany w tworzywach sztucznych, a nawet w naczyniach szklanych. Aby zapobiec przeciągom, naczynia te są zwykle zamknięte, powodując hałas zakłócający punkt końcowy. Ze względu na zdolność tego typu miareczkowania do prowadzenia w warunkach otoczenia, są one odpowiednie do rutynowego procesu i kontroli jakości w przemyśle. Podczas procesu miareczkowania temperatura albo wzrośnie, albo wzrośnie, w zależności od tego, czy reakcja zachodząca między titrantem a analitem jest egzotermiczna, czy endotermiczna. Po spożyciu całego analitu przez reakcję zmienia się szybkość reakcji, tj. wzrost lub spadek determinuje równoważność i można zaobserwować przegięcie krzywej temperatury. Punkt równoważności można zaobserwować precyzyjnie, stosując drugą pochodną krzywej temperatury. Oprogramowanie stosowane w nowoczesnym zautomatyzowanym systemie miareczkowania termicznego składa się z regularnych zaawansowanych algorytmów cyfrowych, dzięki czemu hałas generowany przez bardzo czułe sondy temperaturowe nie powoduje żadnych zakłóceń w pojawieniu się regularnego, jednolitego piku wtórnego opisującego punkt końcowy. Technika ta ma zdolność bardzo wysokiej precyzji i współczynnik wariancji (CVs) mniejszy niż 0,1 są używane. Najnowsze sondy temperatury miareczkowania termometrycznego mają termistor, który tworzy jedno ramię mostu Wheatstone ’ a. najlepszy system miareczkowania termometrycznego może regulować temperaturę do 10-5 K, jeśli jest połączony z elektroniką o wysokiej rozdzielczości. Jeśli zmiany temperatury podczas wykonywania miareczkowania stać aslittle jak 0.001 K ostry punkt równoważności zostaną uzyskane. W przypadku zmiany entalpii technika ta może być zastosowana do każdej reakcji chemicznej w płynie, chociaż Kinetyka reakcji odgrywa ważną rolę w obliczaniu ostrości punktu końcowego. Ten punkt miareczkowania został znacznie zastosowany do miareczkowania kwasowo-zasadowego, EDTA, redoks i wytrącania. Ważne przykłady miareczkowania opadów obejmują:
- Sulfatetracja jonami baru
- Fosfatetracja magnezem w roztworze amonu
- Chlorydetracja azotanem srebra
- Nickeltetracja Dimetyloglioksym
- Fluorydetracja aluminium (jako K2NaAlF6)
miareczkowanie Niewodne można łatwo przeprowadzić jako miareczkowanie wodne, ponieważ sonda temperaturowa nie wymaga elektrycznie podłączonego do rozwiązania, ponieważ jest to wymagane w miareczkowaniu potencjometrycznym. Roztwory, które są silnie mętne lub zabarwione, można łatwo analizować za pomocą termometru bez dalszej obróbki próbki. Sonda nie wymaga konserwacji. Teraz, dzięki zastosowaniu najnowszych i wysoce precyzyjnych biuret napędzanych silnikiem krokowym, miareczkowanie termometryczne jest zakończone w ciągu kilku minut, co czyni tę technikę idealnym wyborem tam, gdzie potrzebna jest wysoka produkcja w laboratorium.
Spektroskopia:
w tym typie spektroskopia służy do określenia punktu równoważności, jeśli widmo reagenta, produktu lub titrantu jest znane. W celu znalezienia punktu równoważności stosuje się określoną ilość produktu i reagenta. Można również określić bardzo niski poziom obecności titranta. W skrócie, ta metoda jest stosowana, aby określić istnienie półprzewodników.
Amperometria:
Amperometria jest techniką wykrywania, która jest używana do pomiaru zmiany prądu.Amperometria stosowana jest głównie w miareczkowaniu, w którym nadmiar titrantu może ulec zahamowaniu. Metoda ta jest pomocna podczas miareczkowania halogenku z Ag+, ponieważ nie ma to wpływu na kształtowanie się osadów.
przykłady punktu równoważności:
- reakcja mocnego kwasu z mocną zasadą:
Załóżmy, że kwas solny HCl (mocny kwas) przyjmuje się jako analit, a wodorotlenek sodu NaOH (mocna zasada) przyjmuje się jako titrant. Jeśli wykreślimy Wykres między pH analitu a titrantem NaOH, który można dodać z biuretu, powstanie Wykres miareczkowania, jak podano poniżej:
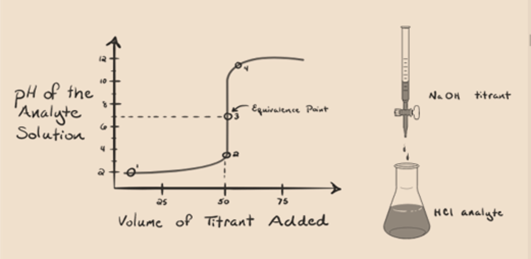
rysunek 1.1
powyższy rysunek 1.1 pokazuje w punkcie 1, że gdy nie dodaje się bazy takiej jak NaOH. PH analitu jest niskie, ponieważ zawiera głównie H3O+ z separacji HCl.

po dodaniu wodorotlenku sodu NaOH kropla bydrop, zaczyna się wchłaniać przez OH– powoli, który jest wytwarzany przez Związek NaOH. Wytworzony analit będzie kwaśny ze względu na dominację jonów hydroniowych, H3O+.
na rysunku 1.1 punkt 2 wskazuje punkt czasowy, w którym pH jest rejestrowane tuż przed całkowitym neutralizacji. Natomiast punkt 3 pokazuje nam punkt równoważności. Tutaj Mole dodawanego wodorotlenku sodu są równe mol chlorku hydroksylowego w analicie. Jest to punkt, w którym jony hydroniowe, H3O+ są całkowicie neutralizowane przez Jon hydroksylowy, OH–. PH roztworu jest neutralne, tzn. pH=7, ponieważ zawiera sól, NaCl i wodę H2O.
punkt 4 na rysunku 1.1 pokazuje, że w miarę dodawania NaOH, pH roztworu zaczyna stawać się podstawowe z powodu całkowitej neutralizacji HCl. Obecnie w roztworze, który dysocjuje z NaOH, występuje wiele jonów OH.
- reakcja słabego kwasu z silną zasadą:
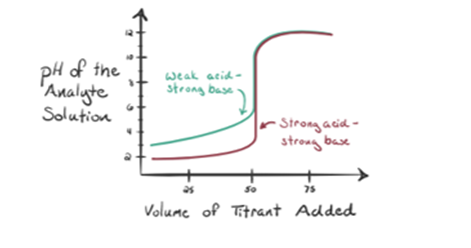
rozważmy słaby kwas, kwas octowy CH3COOH i silną zasadę wodorotlenku sodu NaOH jako titrant. Jeśli wykreślimy Wykres między pH analitu a objętością NaOH, otrzymamy krzywą miareczkowania, jak pokazano poniżej.
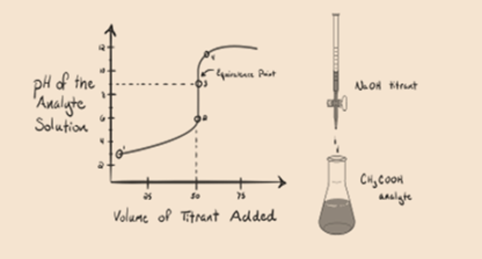
rysunek 1.2
rysunek 1.2 pokazuje w punkcie 1, że NaOH nie został jeszcze dodany, więc teraz pH analitu jest niskie, ponieważ głównie zawiera H3O+, gdy CH3COOH dysocjuje. Ale ponieważ kwas octowy jest słabym kwasem, stąd początkowo jego pH będzie wyższe.

w miarę jak dodajemy kroplami NaOH, H3O+ zacznie się powoli pobierać. Powstanie to w wyniku dysocjacji NaOH. Ale tutaj analit jest nadal kwaśny ze względu na obecność jonów H3O+głównie.
Infigure 1.2 punkt 2 wskazuje pH zarejestrowane w czasie tuż przed całkowitym przeprowadzeniem aneutralizacji.
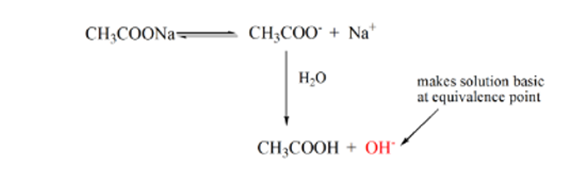
Punkt 3 oznacza punkt równoważności. To jest punkt, w którym Mole NaOH są równe mol CH3COOH w analicie. Jony hydroniowe są całkowicie neutralizowane przez jony hydroksylowe. Następnie roztwór zawiera sól CH3COONa i H2O.

Uwaga:
można zauważyć różnicę w porównaniu do przypadku 1 z mocnym kwasem miareczkowanym w stosunku do mocnej zasady. W tym przypadku (słaby kwas i mocna podstawa) pH nie jest neutralne w punkcie równoważności. Roztwór ma pH~9 w punkcie równoważności. Ustalmy powód poniżej.
z powyższego równania wynika, że rozwiązanie zawiera CH3COONa w punkcie równoważności. Dysocjuje na jon sodu i jony octanowe. Jon octanowy jest sprzężoną zasadą słabego kwasu CH3COOH. Stąd CH3COO– jest stosunkowo silną zasadą (tj. słaby kwas ma silną sprzężoną zasadę), dlatego reagują z wodą, tworząc jony wodorotlenkowe, które podnoszą pH do blisko 9 w punkcie równoważności.
punkt 4 na rysunku 1.2 pokazuje, że gdy wodorotlenek sodu jest w większej ilości, uzyskana krzywa miareczkowania będzie identyczna z HCl-NaOH.
- Strongacid o słabej bazie:
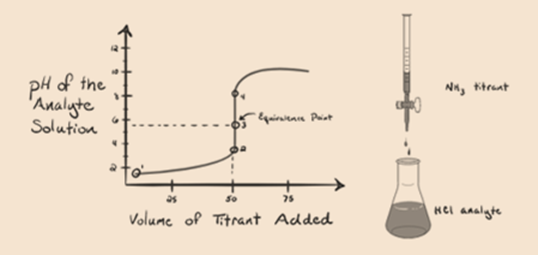
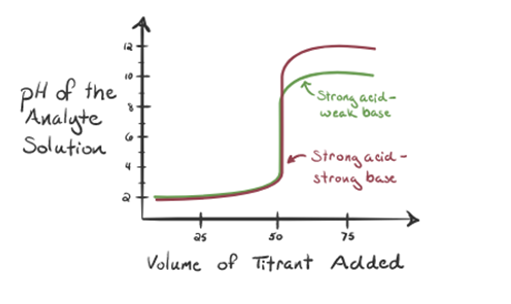
tutaj rozważmy kwas solny jako silny kwas jako analit i amoniak jako słabą zasadę jako titrant. Jeśli wykreślimy Wykres między pH roztworu analitu a objętością titranta NH3, otrzymamy krzywą miareczkowania, jak podano poniżej:
rysunek 1.3
na rysunku 1.3 punkt 1 pokazuje, że gdy nie dodaje się amoniaku, pH analitu będzie niskie, ponieważ w większości zawiera H3O+ z dysocjacji kwasu solnego.
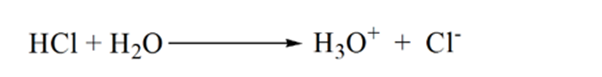
ponieważ amoniak jest dodawany kropla po kropli, H3O+ zaczyna powoli zużywać amoniak. Analit będzie nadal kwaśny ze względu na większość jonów H3O+.
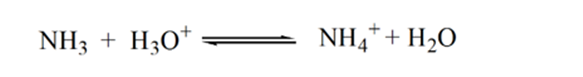
Punkt2 na fig. 1.3 wskazuje, że pH jest rejestrowane w punkcie tuż przed całkowitym przeprowadzeniem aneutralizacji.
Punkt3 pokazuje punkt równoważności. Tutaj liczba moli dodanego NH3 jest równa mol HCl w analicie. Jony hydroniowe są w pełni neutralizowane przez NH3.
Uwaga:
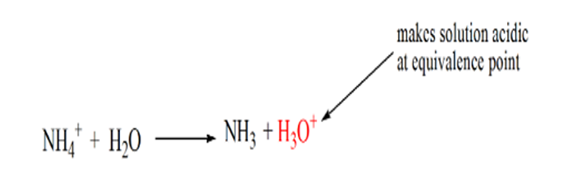
zauważono, że w przypadku słabej zasady przeciwko mocnemu kwasowi pH nie jest neutralne w punkcie równoważności. Stąd otrzymany roztwór jest kwaśny o pH około 5,5 w punkcie równoważności.
powodem tego jest to, że w punkcie równoważności roztwór ma tylko jony amonowe NH4+ i jony chlorkowe, CL-. Ponieważ jony amonowe są sprzężonym kwasem słabej zasady, tj. NH3. Dlatego NH4+ jest silnym kwasem, a zatem NH4+ reaguje z wodą, tworząc jony hydroniowe, które sprawiają, że roztwór jest kwaśny.
punkt 4 pokazuje, że po osiągnięciu punktu równoważności będziemy nadal dodawać amoniak, a gdy będzie w nadmiarze, pH zacznie wzrastać. Amoniak jest słabą zasadą, więc jego pH wynosi powyżej 7, ale jest niższy w porównaniu do silnej Zasady NaOH pokazanej w przypadku 1.
- słaba Baza ze słabym kwasem:
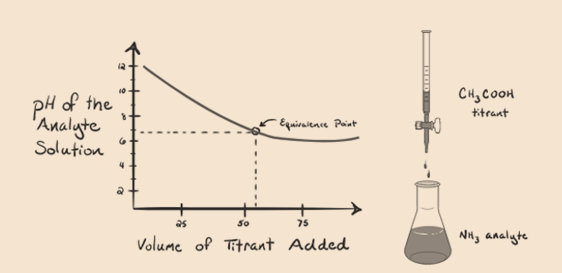
rozważmy amoniak, słabą zasadę jako analit i kwas octowy, który jest słabym kwasem jako titrant. Jeśli wykreślimy Wykres między pH roztworu analitu a objętością kwasu octowego jako titrantu, otrzymamy krzywą miareczkowania, jak poniżej:
rysunek 1.4
zauważyliśmy, że na tym wykresie nie ma stromych. To jest to, co nazywamy „punktem przegięcia” w punkcie równoważności. Brak wymaganej gwałtownej zmiany pH nie daje nam wielu informacji dzięki takiemu zabiegowi.