In der Chemie ist ein Äquivalenzpunkt ein Begriff, der bei der Titration verwendet wird. Es gilt für jede Säure-Base- oder Neutralisationsreaktion technisch.
Definition:
Der Äquivalenzpunkt einer chemischen Reaktion ist der Punkt, an dem gleiche Mengen an Reaktanten chemisch gemischt werden.
Mit anderen Worten, während der Titration ist es ein Punkt, an dem die Menge des zugesetzten Titriermittels ausreicht, um die Analytlösung vollständig zu neutralisieren. Die Molzahl des Titriermittels, d.h. standardlösung ist gleich den Molen einer Lösung mit unbekannter Konzentration. Es ist auch als stöchiometrischer Punkt bekannt, da es sich um einen Punkt handelt, an dem die Mol Säure gleich den Molen der Base sind, die zum Neutralisieren der Lösung benötigt werden. Beachten Sie, dass das Verhältnis von Säure zu Base nicht 1: 1 sein muss. Dieses Säure-Base-Verhältnis wird durch die ausgewogene chemische Säure-Base-Gleichung erklärt. Zu diesem Zweck können Indikatoren verwendet werden, beispielsweise Methylorange oder Phenolphthalein.

Der Äquivalenzpunkt kann nicht als Endpunkt einer Titration angesehen werden. Als Endpunkt wird der Punkt bezeichnet, an dem der verwendete Indikator seine Farbe ändert. Diese Farbänderungen treten nach Erreichen des Äquivalenzpunkts auf. Wenn wir den Endpunkt verwenden, um die Äquivalenz zu bestimmen, führt dies zu einem Fehler.
Methoden zur Bestimmung des Äquivalenzpunktes:
Es gibt verschiedene Methoden zur Bestimmung des Äquivalenzpunktes. Sie werden als diskutiertfolgen:
- pH-Indikator
- Leitwert
- Farbwechsel
- Niederschlag
- Isotherme Kalorimetrie
- Thermometrische Titrimetrie
- Spektroskopie
- Amperometrie
pH-Indikator:
apH-Indikator ist eine chemische Substanz, die ihre Farbe in Reaktion auf jede chemische Veränderung ändert. Ein Säure-Base-Indikator, beispielsweise Phenolphthalein, ändert seine Farbe, die von seinem pH-Wert abhängt. Redoxindikatoren können auch für diesen Zweck verwendet werden. Zunächst wird nur ein einziger Tropfen Indikatorlösung zur Infiltration gegeben. Die Farbänderung zeigt an, dass der Endpunkt erreicht wurde.Dies wird eine Schätzung des Äquivalenzpunkts sein.
Leitfähigkeit:
Die elektrische Leitfähigkeit einer Lösung wird durch die Ionen beeinflusst. Daher ändert sich die Leitfähigkeit, wenn sie miteinander reagieren. (zum beispiel, whileperforming eine säure-base-titration, die H3O +, und OH-ionen reagiert und formneutral wasser, H20 lösung). Leitfähigkeit ist relativ eine schwierige Methode tooperate, besonders wenn die Ionen, die in der Lösung canparticipate in der Leitfähigkeit anwesend sind. Leitfähigkeit kann für einige Säure-Base verwendet werdenreaktionen.
Farbe ändern:
Atthe äquivalenz punkt, die lösung wird ändern seine farbe natürlich ohne anyaddition von ein indikator in einige reaktionen. Dies kann beim Übergang beobachtet werdenmetalle, bei denen die Oxidationsstufe aus verschiedenen Farben besteht.
Niederschlag:
Während der Titration bildet sich der Niederschlag, wenn die Reaktion einen Feststoff bildet. Ein gutes Beispiel für Fällung ist die Reaktionzwischen Silber, Ag + und Chlor, Cl- das führt zur Bildung eines unlöslichen Salzes, Silberchlorid, AgCl. Unerwartet macht dieses es sehr hart todetermine die Endpunkte genau, weil Partikelgröße, die Rate ofsedimentation und Farbe es sehr schwierig zu sehen macht. Dies ist der Grund whyprecipitation Titration wird als Rücktitrationen durchgeführt.
Isotherme Kalorimetrie:
Die Bestimmung des Äquivalenzpunkts erfolgt durch Berechnung der Wärmemenge, die unter Verwendung eines als isothermes Titrierkalorimeter bekannten Geräts erzeugt oder absorbiert wird. Dieser Typ wird normalerweise in Titrationen verwendet, die biochemische Reaktionen beinhalten, d. H. Als Enzymbindung.
Thermometrische Titrimetrie:
Die thermometrische Titrimetrie ist eine außergewöhnlich vielseitige Technik. Hier wird der Äquivalenzpunkt bestimmt, indem die Geschwindigkeit der Temperaturänderung gemessen wird, die durch eine chemische Reaktion erzeugt wird. Diese Eigenschaft unterscheidet sie von der Kalorimetriktitrimetrie. Da die thermometrische Titrimetrie eine relative Technik ist, ist es nicht notwendig, die Titration unter isothermen Bedingungen durchzuführen. Diese Art der Filtration kann in Kunststoffen oder sogar in Glasgefäßen durchgeführt werden. Um verirrten Zugluft vorzubeugen, werden diese Gefäße normalerweise eingeschlossen, indem sie Geräusche verursachen, die den Endpunkt stören. Aufgrund der Fähigkeit dieser Art der Titration, unter Umgebungsbedingungen durchgeführt zu werden, sind sie für die routinemäßige Prozess- und Qualitätskontrolle in der Industrie geeignet. Je nachdem, ob die Reaktion zwischen Titriermittel und Analyt exotherm oder endotherm ist, steigt oder sinkt die Temperatur während des Titrationsprozesses. Ittitration Wenn der gesamte Analyt durch die Reaktion verbraucht wurde, ändert sich die Geschwindigkeit der Temperatur, d.h. eine Zunahme oder Abnahme bestimmt die Äquivalenzpunkt und Beugung in der Temperaturkurve können beobachtet werden. Der Äquivalenzpunkt kann genau beobachtet werden, indem die zweite Ableitung der Temperaturkurve verwendet wird. Die Software, die in einem modernen automatisierten thermometrischen Titrationssystem verwendet wird, besteht aus regelmäßigen fortschrittlichen digitalen Algorithmen, so dass das Rauschen, das von hochempfindlichen Temperatursonden erzeugt wird, keine Interferenz mit dem Auftreten eines regelmäßigen, gleichmäßigen sekundären Spitzenwerts verursacht, der den Endpunkt beschreibt. Diese Technik hat die Fähigkeit vonsehr hohe Präzision und der Varianzkoeffizient (CVs) von weniger als 0,1 sindüblich. Die neuesten thermometrischen Titrationstemperaturfühler haben einen Thermistor, der einen Arm einer Wheatstone-Brücke bildet. das beste thermometrische Titriersystem kann die Temperatur auf 10-5 K auflösen, wenn es mit hochauflösender Elektronik gekoppelt ist. Wenn die Temperaturänderungen während der Durchführung der Titration aslittle als 0.001K werden, wird ein scharfer Äquivalenzpunkt erhalten. Bei einer Enthalpieänderung kann diese Technik notwendigerweise auf jede chemische Reaktion in einer Flüssigkeit angewendet werden, obwohl die Reaktionskinetik eine wichtige Rolle bei der Berechnung der Schärfe des Endpunkts spielt. Dieser Punkt der Titrimetrie wurde im Wesentlichen auf Säure-Base-, EDTA-, REDOX- und Fällungstitration angewendet. Importantexamples der Fällung Titration umfassen:
- Sulfattitration mit Bariumionen
- Phosphattitration mit Magnesium in Ammoniumlösung
- Chloridtitration mit Silbernitrat
- Nickeltitration mit Dimethylglyoxim
- Fluoridtitration mit Aluminium (als K2NaAlF6)
Asnon-wässrige Titrationen können leicht als wässrige Titration durchgeführt werden, da die Temperatursonde nicht elektrisch mit der Lösung verbunden werden muss, wie dies bei potentiometrischen Titrationen erforderlich ist. Lösungen, die arehighly trüb oder gefärbt sind, können durch thermometric ohne anyfurther Behandlung einer Probe leicht analysiert werden. Die Sonde ist wartungsfrei. Mit den neuesten und hochpräzisen Schrittmotorbüretten sind die thermometrischen Titrationen innerhalb weniger Minuten abgeschlossen, was diese Technik zu einer perfekten Wahl macht, wenn eine hohe Produktion in einem Labor erforderlich ist.
Spektroskopie:
Bei diesem Typ wird die Spektroskopie verwendet, um den Äquivalenzpunkt zu bestimmen, wenn das Spektrum des Reaktanten, Produkts oder Titrants bekannt ist. Eine bestimmte Menge des Produktsund Reaktant wird verwendet, um den Äquivalenzpunkt zu finden. Ein sehr niedriges Niveau der Anwesenheit des freien Titrants kann auch bestimmt werden. Kurz gesagt, diese Methode wird verwendetum die Existenz von Halbleitern zu bestimmen.
Amperometrie:
Amperometrieist eine Detektionstechnik, die verwendet wird, um die Änderung des Stroms zu messen.Die Amperometrie wird meist bei Titrationen eingesetzt, bei denen das überschüssige Titriermittel reduziert werden kann. Diese Methode ist bei der Titration eines Halogenids mit Ag + hilfreich, da die Bildung von Präzipitaten nicht beeinträchtigt wird.
Beispiele für Äquivalenzpunkte:
- Die Reaktion einer starken Säure mit einer starken Base:
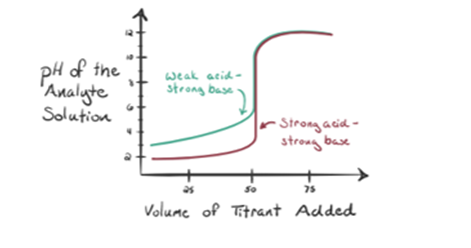
Angenommen, Salzsäure HCl (eine starke Säure) wird als Analyt und Natriumhydroxid NaOH (starke Base) als Titriermittel verwendet. Wenn wir ein Diagramm zwischen Analyt-pH und einem Titriermittel-NaOH zeichnen, das aus der Bürette hinzugefügt werden kann, wird ein Titrationsdiagramm gebildet, wie es unten angegeben ist:
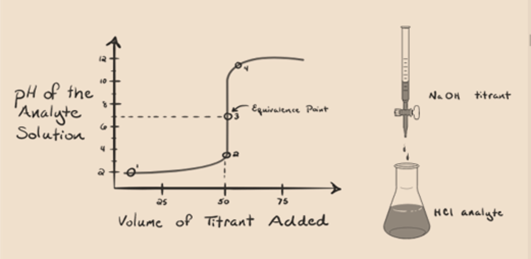
Abbildung 1.1
Die obige Abbildung 1.1 zeigt an Punkt 1, dass, wenn keine Base wie NaOH hinzugefügt wird. Der pH-Wert des Analyten ist niedrig, da er hauptsächlich H3O+ aus der HCl-Abtrennung enthält.

Wenn Natriumhydroxid-NaOH tropfenweise zugegeben wird, beginnt es, von OH– langsam absorbiert zu werden, das durch Dissoziation von NaOH erzeugt wird. Der produzierte Analyt wird aufgrund der Dominanz sauer seinVorhandensein von Hydroniumionen, H3O +.
In Abbildung 1.1 gibt Punkt 2 den Zeitpunkt an, zu dem der pH-Wert kurz vor der vollständigen Neutralisation erfasst wird. Während Punkt 3 uns den Äquivalenzpunkt zeigt. Hier sind die zugesetzten Mol Natriumhydroxid gleich den Molen des Hydroxylchlorids im Analyten. Dies ist der Punkt, an dem Hydroniumionen, H3O+ vollständig durch Hydroxylionen, OH- neutralisiert werden. Der pH-Wert der Lösung ist neutral, dh pH = 7, da sie Salz, NaCl und Wasser H2O enthält.
Punkt 4 von Abbildung 1.1 zeigt, dass der pH-Wert der Lösung aufgrund der vollständigen Neutralisation der HCl basisch wird, wenn wir weiterhin NaOH hinzufügen. Nun sind reichlich OH- Ionen in der Lösung vorhanden, die von NaOH dissoziieren.
- Die Reaktion einer schwachen Säure mit einer starken Base:
Betrachten wir eine schwache Säure, eine Essigsäure CH3COOH und eine starke Base Natriumhydroxid NaOH als Titriermittel. Wenn wir ein Diagramm zwischen dem pH-Wert des Analyten und dem Volumen der NaOH zeichnen, erhalten wir eine Titrationskurve wie unten gezeigt.
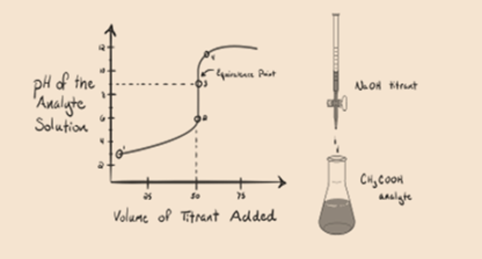
Abbildung 1.2
Abbildung 1.2 zeigt an Punkt 1, dass NaOH noch nicht zugegeben wird, so dass der pH-Wert des Analyten derzeit niedrig ist, da er hauptsächlich H3O + enthält, wenn CH3COOH dissoziiert. Da Essigsäure jedoch eine schwache Säure ist, ist ihr pH-Wert am Anfang höher.

Aswe halten auf zugabe NaOH tropfenweise, H3O + wird starten gettingconsumed durch OH-langsam. Dies wird durch die Dissoziation vonnaoh. Aber hier ist der Analyt immer noch sauer aufgrund der Anwesenheit von H3O + Ionen meist.
Infigur 1.2 Punkt 2 gibt den pH-Wert an, der zu einem Zeitpunkt aufgezeichnet wurde, kurz bevor die Aneutralisation vollständig stattfindet.
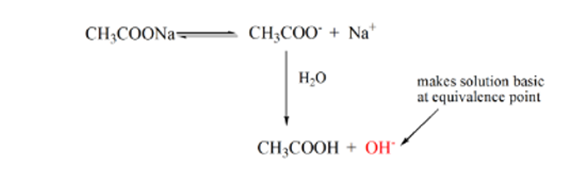
Punkt 3 stellt den Äquivalenzpunkt dar. Dies ist der Punkt, an dem Mol NaOH gleich Mol CH IST3COOH in einem Analyten. Hydroniumionen werden durch Hydroxylionen vollständig neutralisiert. Die Lösung enthält dann CH3COONa Salz und H2O.

Hinweis:
Sie können hier einen Unterschied zu einem Fall 1 feststellen, bei dem eine starke Säure gegen eine starke Base titriert ist. In diesem Fall (schwache Säure und eine starkebase) ist der pH-Wert an einem Äquivalenzpunkt nicht neutral. Die Lösung ist havinga pH ~ 9 am Äquivalenzpunkt. Lassen Sie uns den Grund unten herausfinden.
Aus der obigen Gleichung wird gezeigt, dass die Lösung am Äquivalenzpunkt CH3COONa enthält. Dies dissoziiert in ein Natriumion und Acetationen. Acetation ist die konjugierte Base der schwachen Säure CH3COOH. Daher ist CH3COO- relativ eine starke Base (d. H. Schwache Säure hat eine starke konjugierte Base), daher reagieren sie mit Wasser unter Bildung von Hydroxidionen, die den pH-Wert am Äquivalenzpunkt auf nahe 9 erhöhen.
Punkt 4 in Abbildung 1.2 zeigt, dass bei größerer Menge Natriumhydroxid die gewonnene Titrationskurve identisch mit HCl-NaOH ist.
- Starke Säure mit schwacher Base:
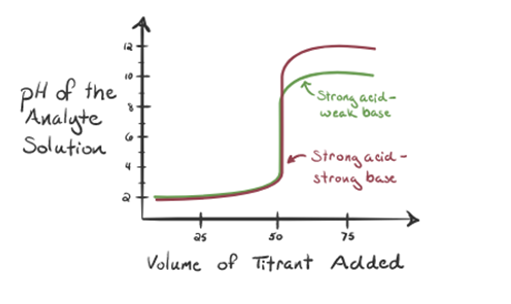
Betrachten wir hier Salzsäure als starke Säure als Analyt und Ammoniak als schwache Base als Titriermittel. Wenn wir ein Diagramm zwischen dem pH-Wert der Analytlösung und dem Volumen des Titriermittels NH3 zeichnen, erhalten wir eine Titrationskurve wie unten angegeben:
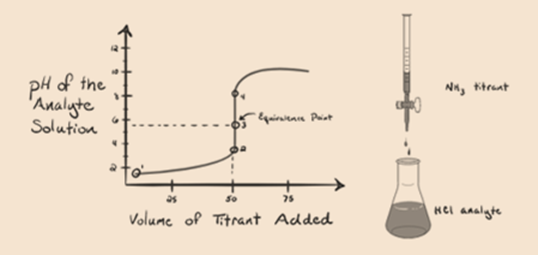
Abbildung 1.3
In Abbildung 1.3 zeigt Punkt 1, dass der pH-Wert des Analyten niedrig ist, wenn kein Ammoniak zugesetzt wird, da er hauptsächlich H3O + aus der Dissoziation von Salzsäure enthält.
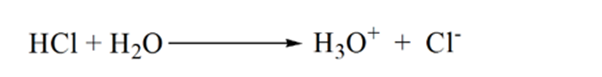
Wenn Ammoniak tropfenweise zugegeben wird, beginnt H3O + langsam von Ammoniak verbraucht zu werden. Der Analyt ist aufgrund der Mehrheit der H3O + -Ionen immer noch sauer.
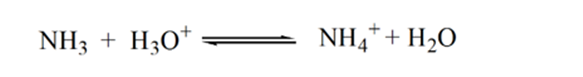
Punkt 2 in Abbildung 1.3 zeigt an, dass der pH-Wert an einem Punkt aufgezeichnet wird, kurz bevor die Aneutralisation vollständig stattfindet.
Point3 zeigt den Äquivalenzpunkt an. Hier ist die Anzahl der Mol von zugesetztem NH3IST gleich den Molen von HCl im Analyten. Die Hydroniumionen sind durch NH3 vollständig neutralisiert.
Hinweis:
Es wurde festgestellt, dass im Falle der schwachen Base gegen eine starke Säure der pH-Wert am Äquivalenzpunkt nicht neutral ist. Daher ist die Lösung, die erreicht wirdwird sauer sein und am Äquivalenzpunkt einen pH-Wert um 5,5 haben.
Der Grund dafür ist, dass die Lösung an einem Äquivalenzpunkt nur Ammoniumionen NH HAT4+ und Chloridionen, CL-. Da die Ammoniumionen die konjugierte Säure einer schwachen Base sind, d. H. NH3. Daher ist NH4 + eine starke Säure und daher reagiert NH4 + mit Wasser unter Bildung von Hydroniumionen, wodurch die Lösung sauer wird.
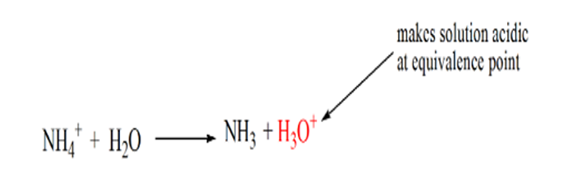
Punkt 4 zeigt, dass wir nach Erreichen eines Äquivalenzpunkts weiterhin Ammoniak hinzufügen und bei einem Überschuss den pH-Wert erhöhen. Ammoniak ist eine schwache Base, so dass sein pH-Wert über 7 liegt, aber im Vergleich zu einer starken Base NaOH, die in Fall 1 gezeigt wird, niedriger ist.
- Schwache Base mit einer schwachen Säure:
Betrachten wir Ammoniak, eine schwache Base als Analyt und eine Essigsäure, die eine schwache Säure als Titriermittel ist. Wenn wir ein Diagramm zwischen dem pH-Wert der Analytlösung und dem Volumen der Essigsäure als Titriermittel zeichnen, erhalten wir eine Titrationskurve wie folgt:
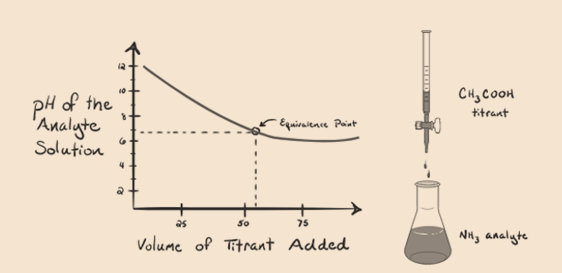
Abbildung 1.4
Wir haben festgestellt, dass es in diesem Diagrammdiagramm keine Steilheit gibt. Dies nennen wir einen“Wendepunkt“ am Äquivalenzpunkt. Das Fehlen der erforderlichen steilen Änderung des pH-Werts gibt uns durch eine solche Kurve nicht viele Informationen.