i kemi er ækvivalenspunkt et udtryk, der bruges under udførelse af titrering. Det gældertil enhver syre-base eller neutraliseringsreaktion teknisk.
Definition:
ækvivalenspunktet for en kemisk reaktion er det punkt, hvor lige store mængder reaktanter er blandet kemisk.
med andre ord, mens titrering er det et punkt, hvor mængden af tilsat titrant er tilstrækkelig til at neutralisere analytopløsningen fuldstændigt. Antallet af mol titrant dvs. standardopløsning er lig med mol af en opløsning med en ukendt koncentration. Det er også kendt som det støkiometriske punkt, fordi det er et punkt, hvor molene af syre er lig med molene i basen, der er nødvendige for at neutralisere opløsningen. Bemærk, at forholdet mellem syre og base ikke behøver at være 1: 1. Dette syre-base-forhold forklares med den afbalancerede syre-base kemiske ligning. Indikatorer kan anvendes til dette formål, for eksempel methylorange eller phenolphthalein.

ækvivalenspunktetkan ikke tages det samme som endepunktet for en titrering. Slutpunktet erhenvist til det punkt, hvor den anvendte indikator ændrer sin farve. Dissefarveændringer vises efter at have nået ækvivalenspunktet. Hvis vi bruger endpoint til at bestemme ækvivalens, vil det fremkalde en fejl.
metoder til bestemmelse af Ækvivalenspunktet:
der er forskelligemetoder til bestemmelse af ækvivalenspunktet. De diskuteres somfølger:
- pH-indikator
- konduktans
- farveændring
- nedbør
- isotermisk kalorimetri
- termometrisk titrimetri
- spektroskopi
- Amperometri
pH-indikator:
APH-Indikator er et kemisk stof, der ændrer sin farve som reaktion på Nogenkemisk ændring. En syre-base indikator, for eksempel, phenolphthalein ændrerdens farve, som afhænger af dens pH. I første omgang tilføjes kun en enkelt dråbe indikatoropløsning titrering. Ændringen i farve viser, at slutpunktet er nået.Dette vil være et skøn over ækvivalenspunktet.
konduktans:
denelektriske ledningsevne af en opløsning påvirkes af ionerne. Derfor erledningsevne ændres, når de reagerer med hinanden. (for eksempel, mens der udføres en syre-base titrering, reagerer H3O+ og OH – ioner og danner neutralt vand, H20 opløsning). Konduktans er relativt en vanskelig metode tiloperere, især når de ioner, der er til stede i opløsningen, kandeltage i ledningsevne. Konduktans kan bruges til et par syre-basereaktioner.
farveændring:
Påækvivalenspunktet vil opløsningen ændre sin farve naturligt uden nogentilføjelse af en indikator i nogle reaktioner. Dette kan observeres i overgangenmetaller, hvor iltningstilstanden består af forskellige farver.
udfældning:
under titrering dannes bundfaldet hvisreaktionen danner et fast stof. Et godt eksempel på nedbør er reaktionenmellem sølv, Ag+ og chlor, Cl – der resulterer i dannelsen af anuopløseligt salt, sølvchlorid, AgCl. Uventet gør det det meget svært at bestemme endepunkterne nøjagtigt på grund af partikelstørrelse, hastigheden afdimentation og farve gør det meget svært at se. Dette er grunden til hvorforudfældning titrering udføres som back titreringer.
isotermisk kalorimetri:
detbestemmelse af ækvivalenspunktet sker ved at beregne mængden af varmeder produceres eller absorberes ved hjælp af en enhed kendt som en isotermisk titreringkalorimeter. Denne type anvendes normalt i titreringer, der involverer biokemiskreaktioner, dvs.
termometrisk titrimetri:
Termometrisktitrimetri er en usædvanlig multifacetteret teknik. Her bestemmes ækvivalenspunktet ved at måle hastigheden af temperaturændring produceret ved akemisk reaktion. Denne egenskab adskiller den fra kalorimetrisktitrimetri. Fordi termometrisk titrimetri er en relativ teknik, er det ikkenødvendigt at udføre titreringen under isotermiske forhold. Denne type aftitrering kan udføres i plast eller endda i glasbeholdere. For at forhindre stray-udkast er disse fartøjer Normalt lukket ved at forårsage støj, der forstyrrer slutpunktet. På grund af denne type titrerings evne til at væreudført under omgivende forhold, er de egnede til rutinemæssig proces og kvalitetskontrol i branchen. Temperaturen vil enten stige eller falde under titreringsprocessen, afhængigt af om reaktionen tager sted mellem titranten og analyt er eksoterm eller endoterm. Ittitrering når al analyt er blevet forbrugt af reaktionen, ændres hastigheden af temperaturen, dvs. en stigning eller et fald bestemmer ækvivalenspunktet og bøjningen i temperaturkurven kan observeres. Ækvivalenspunktet kan observeres nøjagtigt ved at anvende det andet derivat af temperaturkurven. Programmet, der bruges i et moderne automatiserettermometrisk titreringssystem, består af regelmæssige avancerede digitale algoritmerså den støj, der genereres fra meget følsomme temperaturprober, ikke forårsager interferens med udseendet af en regelmæssig, ensartet sekundderivativ top, der beskriver slutpunktet. Denne teknik har evnen tilmeget høj præcision og varianskoefficienten (CVs) på mindre end 0,1 ersædvanligt. De seneste termometriske titreringstemperaturprober har en termistorder danner en arm af en Hvedestenbro. den bedste termometriske titrationssystem kan løse temperaturen til 10-5 K, hvis den er koblet til højopløsningelektronik. Hvis temperaturen ændres under udførelse af titrering bliver somlidt som 0,001 K opnås et skarpt ækvivalenspunkt. Hvor der er enenthalpyændring, kan denne teknik nødvendigvis anvendes på enhver kemisk reaktioni en væske, selvom reaktionskinetikken spiller en vigtig rolle i beregningendepunktets skarphed. Dette punkt af titrimetri er blevet væsentligt anvendt på syre-base, EDTA, REDOKS og nedbør titrering. Vigtigeksempler på nedbørstitrering omfatter:
- Sulfatetitrering med Bariumioner
- Phosphatetitrering med Magnesium i ammoniumopløsning
- Chloridtitrering med sølvnitrat
- Nickeltitrering med Dimethylglyoksimum
- Fluoridtitrering med aluminium (som K2NaAlF6)
Asikke-vandige titreringer kan let udføres som vandig titrering, da temperatursonden ikke kræver at være elektrisk forbundet til opløsningen, som det kræves i potentiometriske titreringer. Løsninger, der erhøjt uklare eller farvede, kan let analyseres ved termometrisk uden nogenYderligere behandling af en prøve. Sonden er vedligeholdelsesfri. Nu en dag ved hjælp af de nyeste og meget pr-forstærkede stepmotordrevne buretter,termometriske titreringer afsluttes inden for få minutter, hvilket gør denne teknik til et perfekt valg, hvor der er behov for høj produktion i et laboratorium.
spektroskopi:
iDenne type anvendes spektroskopi til at bestemme ækvivalenspunktet, hvis spektrumetaf reaktanten, produktet eller titranten er kendt. En bestemt mængde af produktetog reaktant bruges til at finde ækvivalenspunktet. Et meget lavt niveau afgratis titrants tilstedeværelse kan også bestemmes. Kort sagt anvendes denne metodeat bestemme eksistensen af halvledere.
Amperometri:
Amperometryer en detektionsteknik, der bruges til at måle ændringen i strømmen.Amperometri bruges mest i de titreringer, hvor overskydende titrant kan værereduceret. Denne metode er nyttig under titrering af et halogenid med Ag+, fordi dannelsen af bundfald ikke vil blive påvirket.
eksempler på ækvivalenspunkt:
- reaktionen af en stærk syre med en stærk base:
lad os antage, at saltsyre HCl (en stærk syre) tages som en analyt, og Natriumhydroksid NaOH (stærk base) tages som en titrant. Hvis vi tegner en graf mellem analyt pH og en titrant NaOH, som kan tilføjes fra buretten, dannes en titreringsgraf som angivet nedenfor:
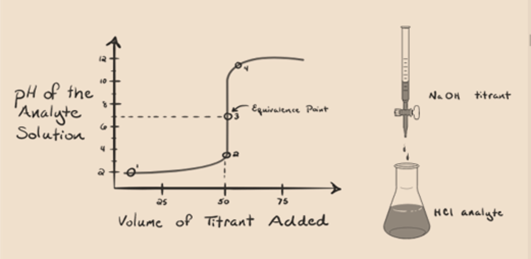
figur 1.1
ovenstående figur 1.1 viser ved punkt 1, at når der ikke tilføjes nogen base som NaOH. Analytens pH er lav, da den for det meste indeholder H3O+ fra adskillelsen af HCI.

når natriumhydroksid NaOH tilsættes drop bydrop, begynder det at blive absorberet af OH– langsomt, der produceres afdissociation af NaOH. Den producerede analyt vil være sur på grund af den dominerendetilstedeværelse af hydroniumioner, H3O+.
i figur 1.1 punkt 2 angiver det tidspunkt, hvor pH registreres lige før neutraliseringen finder sted fuldstændigt. Mens punkt 3 viser os ækvivalenspunktet. I de fleste tilfælde er det nødvendigt at tage hensyn til, om det er nødvendigt. Dette er det punkt, hvor hydroniumioner, H3O+ neutraliseres fuldstændigt af hydroksylion, OH–. Opløsningens pH er neutral, dvs. pH=7, fordi den har salt, NaCl og vand H2O.
punkt 4 i figur 1.1 viser, at når vi fortsætter med at tilføje NaOH, begynder opløsningens pH at blive grundlæggende på grund af den fuldstændige neutralisering af HCl. Nu er der masser af OH-ioner er til stede i opløsningen, som adskiller sig fra NaOH.
- reaktionen af en svag syre med en stærk base:
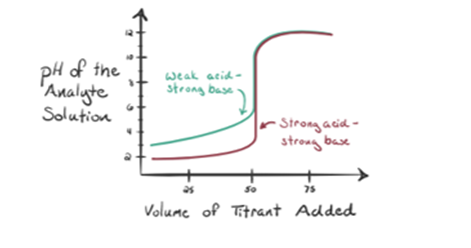
lad os betragte en svag syre, en eddikesyre CH3COOH og en stærk base natriumhydroksid NaOH som en titrant. Hvis vi tegner en graf mellem analytens pH og volumenet af NaOH, får vi en titreringskurve som vist nedenfor.
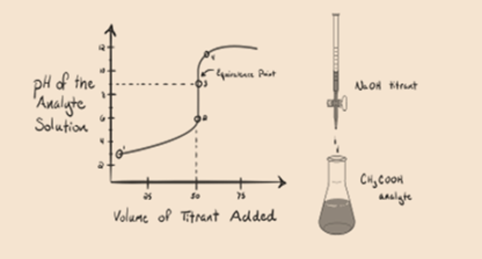
figur 1.2
figur 1.2 viser på punkt 1, At NaOH ikke er tilføjet endnu, så lige nu er analytens pH lav, da den for det meste indeholder H3O+, når CH3COOH dissocierer. Men da eddikesyre er en svag syre, vil dens pH i første omgang være højere.

når vi fortsætter med at tilføje NaOH dråbevis, begynder H3O + at blive forbrugt af OH– langsomt. Dette vil blive produceret ved dissociation ofNaOH. Men her er analytten stadig sur på grund af tilstedeværelsen af H3O+ioner for det meste.
Infigure 1.2 punkt 2 angiver pH optaget ad gangen lige før aneutralisering finder sted fuldstændigt.
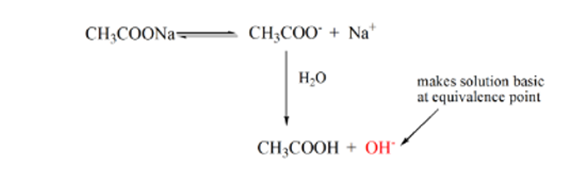
punkt 3 repræsenterer ækvivalenspunktet. Dette er det punkt, hvor mol NaOH er lig med mol CH3COOH i en analyt. Hydroniumioner neutraliseres fuldstændigt af hydroksylioner. Opløsningen vil derefter indeholde CH3COONa salt og H2O.

Bemærk:
Youcan mærke en forskel her i forhold til en sag 1 med en der har en strongacid titreret mod en stærk base. I dette tilfælde (svag syre og en stærkbase) er pH ikke neutral ved et ækvivalenspunkt. Løsningen haren pH~9 ved ækvivalenspunktet. Lad os finde ud af årsagen nedenfor.
fra ovenstående ligning er det vist, at opløsningen indeholder CH3COONa ved ækvivalenspunktet. Dette dissocieres i en natriumion og acetationer. Acetation er den konjugerede base af den svage syre CH3COOH. Derfor er CH3COO– relativt en stærk base (dvs.svag syre har en stærk konjugatbase), derfor reagerer de med vand for at producere hydroksidioner, der øger pH til næsten 9 ved ækvivalenspunktet.
punkt 4 i figur 1.2 viser, at når natriumhydroksid er i større mængde, vil den opnåede titreringskurve være identisk med HCl-NaOH.
- Strongsyre med en svag base:
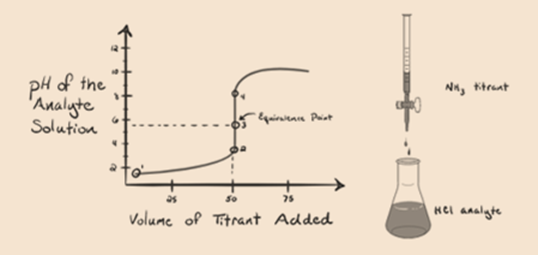
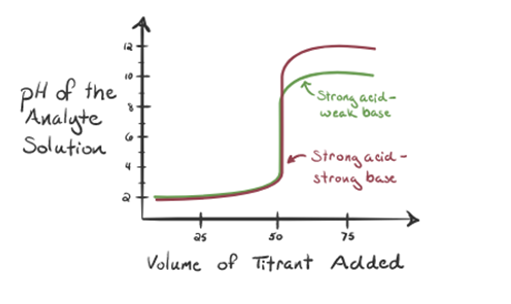
lad os her betragte saltsyre som en stærk syre som en analyt og ammoniak som en svag base som en titrant. Hvis vi tegner en graf mellem pH-værdien af analytopløsningen og volumen af titranten NH3, får vi en titreringskurve som angivet nedenfor:
figur 1.3
i figur 1.3 punkt 1 viser, at når der ikke tilsættes ammoniak, vil analytens pH være lav, da den for det meste indeholder H3O+ fra dissociationen af saltsyre.
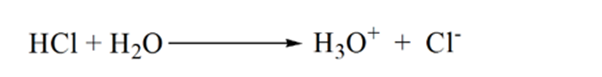
når ammoniak tilsættes dråbe for dråbe, begynder H3O + langsomt at blive forbrugt af ammoniak. Analytten vil stadig være sur på grund af størstedelen af H3O+ ioner.
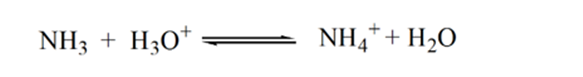
Punkt2 i figur 1.3 angiver, at pH registreres på et punkt lige før aneutralisering finder sted fuldstændigt.
Point3 viser ækvivalenspunktet. Her er antallet af mol tilsat Nh3er lig med mol HCI i analytten. Hydroniumionerne er fullyneutraliseret af NH3.
Bemærk:
deter bemærket, at i tilfælde af den svage base mod en stærk syre er phikke neutral ved ækvivalenspunktet. Derfor er den opløsning, der opnåsvil være sur med en pH omkring 5,5 ved ækvivalenspunktet.
årsagen til dette er, at opløsningen på et ækvivalenspunkt kun har ammoniumioner NH4+ og chloridioner, CL-. Som ammoniumioner er konjugatsyren af en svag base, dvs. NH3. Derfor er NH4+ en stærk syre, og NH4+ vil således reagere med vand for at producere hydroniumioner, hvilket gør opløsningen sur.
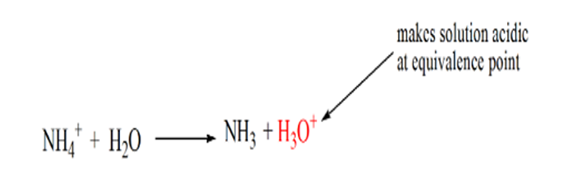
punkt 4 viser, at efter at have opnået et ækvivalenspunkt, vil vi fortsætte med at tilføje ammoniak, og når det er overskydende, vil pH begynde at stige. Ammoniak er en svag base, så dens pH er Over 7, men den er så lavere sammenlignet med en stærk base NaOH vist i tilfælde 1.
- Svagbase med en svag syre:
lad os overveje ammoniak, en svag base som en analyt og en eddikesyre, som er en svag syre som en titrant. Hvis vi tegner en graf mellem pH-værdien af analytopløsningen versus volumenet af eddikesyren som en titrant, får vi en titreringskurve som nedenfor:
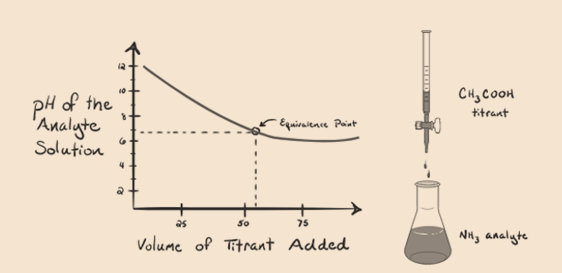
figur 1.4
Vihar bemærket, at der ikke er nogen stejl i denne grafplot. Dette er, hvad vi kalder et”bøjningspunkt” på ækvivalenspunktet. Fraværet af den krævede stejle ændring i pH giver os ikke meget information gennem sådan en kurve.