kemiassa ekvivalenssipiste on termi, jota käytetään titrausta suoritettaessa. Se soveltuu teknisesti mihin tahansa happo-emäs-tai neutralointireaktioon.
määritelmä:
kemiallisen reaktion ekvivalenssipiste on kohta, jossa kemiallisesti sekoittuu yhtä paljon reaktantteja.
toisin sanoen titrattaessa on kyse pisteestä, jossa lisätyn titrantin määrä riittää neutraloimaan analyytiliuoksen kokonaan. Titrantin moolien määrä ts. standardiliuos on yhtä suuri kuin sellaisen liuoksen moolit, jonka pitoisuus on tuntematon. Se tunnetaan myös stoikiometrisenä pisteenä, koska se on piste, jossa hapon moolit ovat yhtä suuret kuin emäksen moolit, joita tarvitaan liuoksen neutraloimiseen. Huomaa, että hapon ja emäksen suhteen ei tarvitse olla 1:1. Tämä happo-emäs-suhde selittyy tasapainoisella happo-emäs-kemiallisella yhtälöllä. Tähän tarkoitukseen voidaan käyttää indikaattoreita, esimerkiksi metyylioranssia tai fenoliftaleiinia.

ekvivalenssipistettä ei voida pitää samana kuin titrauksen päätepistettä. Päätepisteeksi viitataan pisteenä, jossa käytetty indikaattori muuttaa väriään. Värimuutokset näkyvät ekvivalenssipisteen saavuttamisen jälkeen. Jos käytämme theendpoint määrittää vastaavuus, se aiheuttaa virheen.
Ekvivalenssipisteen määritysmenetelmät:
ekvivalenssipisteen määrittämiseen on olemassa erilaisia menetelmiä. Niistä keskustellaan:
- pH-indikaattori
- konduktanssi
- värinmuutos
- Sademäärä
- isoterminen kalorimetri
- Termometrinen titrimetria
- spektroskopia
- Amperometria
pH-indikaattori:
APH-indikaattori on kemiallinen aine, joka muuttaa väriään reaktiossa mihin tahansa kemialliseen muutokseen. Happo-emäs-indikaattori, esimerkiksi fenoliftaleiini muuttaa sen väriä, joka riippuu sen pH: sta.Redox-indikaattoreita voidaan käyttää myös tähän tarkoitukseen. Aluksi vain yksi pisara indikaattoriratkaisua lisätään thetitration. Värin muutos osoittaa, että päätepiste on saavutettu.Tämä on ekvivalenssipisteen estimointi.
konduktanssi:
ionit vaikuttavat liuoksen sähköiseen johtavuuteen. Siksi theconductivity muuttuu, kun ne reagoivat keskenään. (esimerkiksi happo-emästitrauksen aikana H3O+ – ja OH-ionit reagoivat ja muodostavat neutraalin veden, H20-liuoksen). Konduktanssi on suhteellisen vaikea menetelmäperaatti, varsinkin kun liuoksessa olevat ionit voivat osallistua johtavuuteen. Konduktanssia voidaan käyttää muutamille happo-basereaktioille.
värimuutos:
ekvivalenssipisteessä liuos muuttaa väriään luonnollisesti ilman indikaattoria joissakin reaktioissa. Tämä voidaan havaita transitiometaaleissa, joissa hapetustila koostuu eri väreistä.
saostuma:
titrauksen aikana saostuma muodostuu, jos reaktiossa muodostuu kiinteää ainetta. Hyvä esimerkki saostumisesta on hopean, Ag+: n ja kloorin, Cl: n välinen reaktiivisuus, joka johtaa erottuvan suolan, hopeakloridin, AgCl: n muodostumiseen. Yllättäen tämä tekee hyvin vaikeaksi määrittää päätepisteet tarkasti, koska hiukkaskoko, nopeus ofsedimentation ja väri tekee siitä hyvin vaikea nähdä. Tämä on syy, miksi resitaatiotitraus tehdään selkätitrauksina.
isoterminen kalorimetri:
ekvivalenssipiste määritetään laskemalla lämpö, joka tuotetaan tai absorboidaan isotermisen titrationcalorimetrin avulla. Tätä tyyppiä käytetään yleensä titrauksissa, joihin liittyy biokemiallisia reaktioita eli entsyymisitoutumista.
Termometrinen Titrimetria:
Termometrinen Titrimetri on poikkeuksellisen monipuolinen tekniikka. Tässä ekvivalenssipiste määritetään mittaamalla akeemisen reaktion aikaansaaman lämpötilan muutoksen nopeus. Tämä ominaisuus erottaa sen kalorimetritrimetriasta. Koska termometrinen titrimetria on suhteellinen tekniikka, titrausta ei tarvitse suorittaa isotermisissä olosuhteissa. Tämän tyyppinentitraus voidaan suorittaa muoveissa tai jopa lasiastioissa. Jotta estetään sumutusvedot, nämä alukset suljetaan yleensä aiheuttamalla päätetapahtumaa häiritsevää melua. Koska kyky tämäntyyppisen titraus beconducted ympäristön olosuhteissa, ne ovat asianmukaisia rutiini prosessi ja laadunvalvonta alalla. Lämpötila joko nousee tai kohoaa titrausprosessin aikana riippuen siitä, onko titrantin ja tutkittavan aineen välinen reaktio eksoterminen vai endoterminen. Ittitraatio, kun reaktio on kuluttanut kaiken tutkittavan aineen, lämpötilan muutosten nopeus so. lisäys tai lasku määrittää ekvivalenssipiste ja taivutuksessa lämpötilakäyrä voidaan havaita. Ekvivalenssipointti voidaan havaita juuri käyttämällä tetemperatuurikäyrän toista derivaataa. Ohjelmisto, jota käytetään nykyaikaisessa automatedhermometrinen titrausjärjestelmä koostuu säännöllisesti kehittynyt digitaalinen algorithmsso että melu tuottaa erittäin herkkä lämpötila koettimet ei aiheuta häiriöitä ulkonäkö säännöllinen, yhtenäinen seconderivaative huippu, joka kuvaa päätepiste. Tämä tekniikka on kyky oferykorkea tarkkuus ja varianssikerroin (CVs) on alle 0,1 areusual. Uusimmissa termometrisissä titrauslämpötilaluotaimissa on thermistorthat muodostaa Wheatstone-sillan yhden varren. paras termometrinen titrausjärjestelmä voi ratkaista lämpötilan 10-5 K: iin, jos se on kytketty korkearesoluutioiseen elektroniikkaan. Jos lämpötila muuttuu titrauksen aikana 0,001 K: n tarkkuudella, saadaan terävä ekvivalenssipiste. Jos onentalpian muutos, tätä tekniikkaa voidaan soveltaa välttämättä mihin tahansa kemialliseen reaktioon nesteessä, vaikka reaktiokinetiikalla on tärkeä rooli päätetapahtuman terävyyden laskemisessa. Tätä titrimetriapistettä on merkittävästi sovellettu happo-emäs -, EDTA -, REDOX-ja saostustitraukseen. Tärkeitä esimerkkejä saostuksen titrauksesta ovat:
- Sulfatetitointi Bariumioneilla
- Fosfatetitointi magnesiumin kanssa ammoniumliuoksessa
- Kloridititraus hopeanitraatilla
- Nikkelitraus Dimetyyliglyoksiimilla
- Fluoridititraus alumiinilla (k2naalf6: na))
Asnon-vesipitoiset titraukset voidaan helposti suorittaa vesipitoisina titrauksina, koska lämpötila-anturi ei tarvitse olla sähköisesti kytkettynä thesoluutioon, koska sitä tarvitaan potentiometrisissä titrauksissa. Erittäin sameat tai värilliset liuokset voidaan helposti analysoida termometrisesti ilman näytteen jatkokäsittelyä. Luotain on huoltovapaa. Nyt päivässä uusimpia ja erittäin précisoituja askelmoottorikäyttöisiä buretteja käyttämällä termometriset titraukset valmistuvat muutamassa minuutissa, mikä tekee thistechniquesta täydellisen valinnan, jossa tarvitaan suurta tuotantoa laboratoriossa.
spektroskopia:
tässä tyypissä spektroskopiaa käytetään ekvivalenssipisteen määrittämiseen, jos reaktantin, tuotteen tai titrantin spektri tunnetaan. Ekvivalenssipisteen löytämiseen käytetään tiettyä määrää tuotetta ja reagoijaa. Myös vapaa titrantin läsnäolo on hyvin vähäistä. Lyhyesti sanottuna tätä menetelmää käytetään puolijohteiden olemassaolon määrittämiseen.
Amperometria:
Amperometria on havaitsemistekniikka, jolla mitataan virran muutosta.Amperometriaa käytetään enimmäkseen niissä titrauksissa, joissa ylimääräinen titrantti voidaan vähentää. Tämä menetelmä on hyödyllinen titrattaessa halidia Ag+: lla, koska saostumien muodostuminen ei vaikuta.
esimerkkejä ekvivalenssipisteestä:
- vahvan hapon ja vahvan emäksen reaktio:
oletetaan, että analyytiksi otetaan suolahappo HCl (vahva happo) ja titrantiksi natriumhydroksidi NaOH (vahva emäs). Jos me piirtää kuvaajan välillä analyyttiä pH ja titrantti NaOH, joka voidaan lisätä osoitteesta byretti, titraus kuvaaja muodostetaan kuten on esitetty alla:
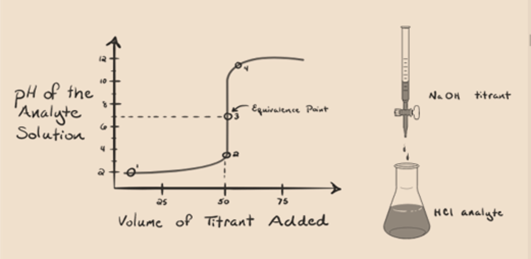
Kuva 1.1
yllä oleva kuva 1.1 osoittaa kohdassa 1, että kun NaOH: n kaltaista emästä ei lisätä. Tutkittavan aineen pH on alhainen, koska se sisältää pääasiassa H3O+: a HCl: n erotuksesta.

kun natriumhydroksidi NaOH lisätään pisaratartuntana, se alkaa imeytyä OH-hitaasti, joka syntyy NaOH: n liittyessä. Tuotettu analyytin on hapan johtuen dominantpresence hydroniumioneja, H3O+.
kuvassa 1.1 kohta 2 osoittaa ajankohdan, jolloin pH kirjataan juuri ennen kuin neutralisaatio tapahtuu kokonaan. Vaikka kohta 3 osoittaa meille ekvivalenssi kohta. Tässä lisätyn natriumhydroksidin moolit ovat yhtä suuret kuin analyytin hydroksyylikloridin moolit. Tällöin hydroniumionit, H3O+, neutraloituvat kokonaan hydroksyyli-ionilla OH–. Liuoksen pH on neutraali eli pH=7, koska siinä on suolaa, NaCl ja vettä H2O.
Kuvan 1.1 kohta 4 osoittaa, että kun lisäämme NaOH: ta, liuoksen pH alkaa muuttua emäksiseksi HCl: n täydellisen neutraloitumisen vuoksi. Nyt liuoksessa on runsaasti Oh– ioneja, jotka dissosioituvat NaOH: sta.
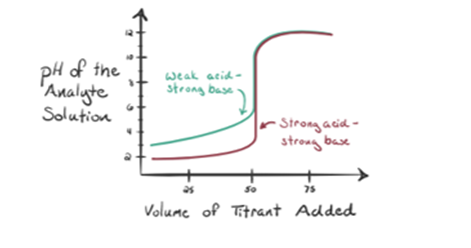
- heikon hapon reaktio, jolla on vahva emäs:
pidetään titranttina heikkoa happoa, etikkahappoa CH3COOH ja vahvaa emäksistä natriumhydroksidia NaOH. Jos me piirtää kuvaaja välillä pH, tutkittavan ja tilavuus NaOH, saamme titraus käyrä kuten alla.
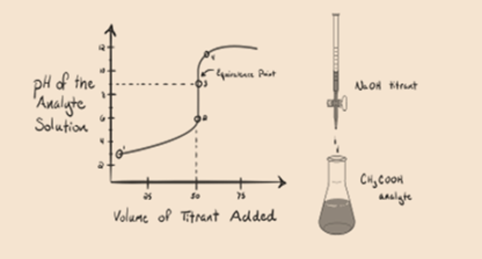
Kuva 1.2
Kuva 1.2 osoittaa kohdassa 1, että NaOH: ta ei ole vielä lisätty, joten juuri nyt tutkittavan aineen pH on alhainen, koska se sisältää enimmäkseen H3O+: ta CH3COOH: n hajotessa. Mutta etikkahappo on heikko happo, joten aluksi sen pH on korkeampi.

kun jatkamme NaOH: n lisäämistä dropwise, H3O+ alkaa saada Oh– hitaasti. Tämä saadaan aikaan ofNaOH: n dissosiaatiolla. Mutta tässä analyytin on edelleen hapan, koska läsnäolo H3O + ioneja enimmäkseen.
Infigure 1, 2 kohta 2 osoittaa pH-arvon, joka kirjataan juuri ennen kuin aneutralisaatio tapahtuu kokonaan.
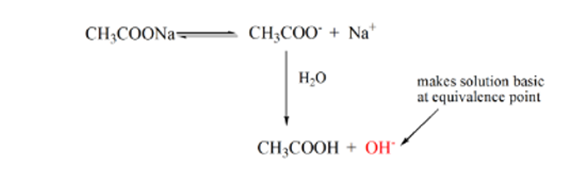
kohta 3 edustaa ekvivalenssipistettä. Tässä kohdassa NaOH: n moolit ovat yhtä suuret kuin CH3COOH: n moolit analyyttissä. Hydroniumionit neutraloituvat kokonaan hydroksyyli-ioneilla. Liuos sisältää ch3coona-suolaa ja H2O: ta.

Huomautus:
tässä voidaan havaita ero verrattuna tapaukseen 1, jossa A: n vahvuusaste on titrattu vahvaa pohjaa vasten. Tällöin (heikko happo ja vahvabase) pH ei ole neutraali ekvivalenssipisteessä. Ratkaisu on pH~9 ekvivalenssipisteessä. Selvitetään syy alla.
yllä olevasta yhtälöstä voidaan osoittaa, että ratkaisu sisältää ch3coonan ekvivalenssipisteessä. Tämä hajoaa natriumioniksi ja asetaatti-ioniksi. Asetaatti-ioni on heikon hapon CH3COOH konjugaattiemäs. Näin ollen CH3COO-on suhteellisen vahva emäs (eli heikolla hapolla on vahva konjugaattiemäs), joten ne reagoivat veden kanssa muodostaen hydroksidi-ioneja, jotka nostavat pH: n lähelle 9: ää ekvivalenssipisteessä.
kuvan 1.2 kohta 4 osoittaa, että kun natriumhydroksidia on enemmän, saavutettu titrauskäyrä on sama kuin HCl-NaOH.
- Strongacid heikolla pohjalla:
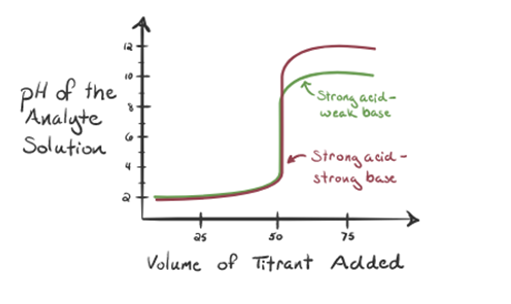
tässä tarkastellaan suolahappoa vahvana happona analyytinä ja ammoniakkia heikkona emäksenä titranttina. Jos piirrämme kuvaajan analyyttiliuoksen pH: n ja titrantin NH3: n tilavuuden välille, saamme titrauskäyrän, kuten alla on esitetty:
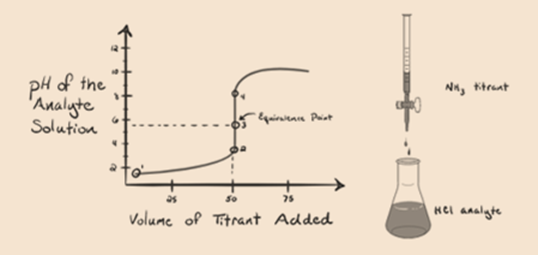
Kuvan 1.3
kuvan 1.3 kohdassa 1 osoitetaan, että kun ammoniakkia ei lisätä, analyytin pH on alhainen, koska se sisältää enimmäkseen H3O+: ta suolahapon dissosiaatiosta.
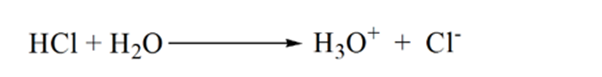
kun ammoniakkia lisätään pisaroittain, H3O+ alkaa kuluttaa ammoniakkia hitaasti. Analyytit ovat edelleen happamia johtuen suurimmasta osasta H3O + – ioneja.
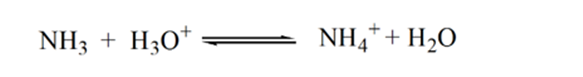
kohta 2 Kuvassa 1.3 osoittaa, että pH kirjataan pisteessä juuri ennen kuin aneutralisaatio tapahtuu kokonaan.
piste3 osoittaa ekvivalenssipisteen. Tässä lisätyn NH3: n moolien määrä on yhtä suuri kuin HCl: n moolit analyysissä. Hydroniumionit ovat täysineutralisoituneet NH3: lla.
Huomautus:
on huomattu, että heikon emäksen tapauksessa vahvaa happoa vastaan pH ei ole neutraali ekvivalenssipisteessä. Näin ollen liuos, joka on saavutettu, on hapan, jonka pH on noin 5,5 ekvivalenssipisteessä.
tämä johtuu siitä, että vastaavuuspisteessä liuoksessa on vain ammoniumioneja NH4+ ja kloridi-ioneja, CL -. Koska ammoniumionit ovat heikon emäksen eli NH3: n konjugaattihappoa. Siksi NH4+ on vahva happo ja näin NH4+ reagoi veden kanssa muodostaen hydroniumioneja, mikä tekee liuoksesta happaman.
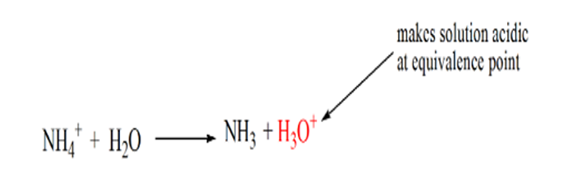
kohta 4 osoittaa, että ekvivalenssipisteen saavuttamisen jälkeen jatkamme ammoniakin lisäämistä, ja kun sitä on liikaa, pH alkaa nousta. Ammoniakki on heikko emäs, joten sen pH on yli 7, mutta se on pienempi kuin tapauksessa 1 esitetyssä vahvassa emäs NaOH: ssa.
- heikko pohja heikolla hapolla:
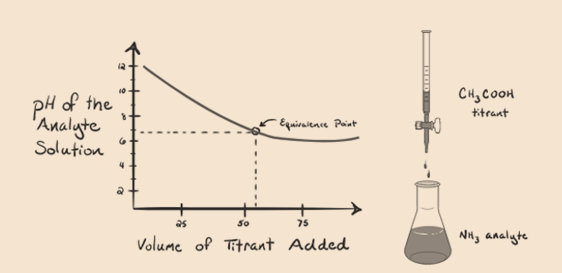
tarkastellaan ammoniakkia, heikkoa emästä analyyttinä ja etikkahappoa, joka on heikko happo titranttina. Jos kuvaamme käyrän tutkittavan liuoksen pH: n ja etikkahapon tilavuuden välille titranttina, saamme titrauskäyrän kuten alla:
Kuva 1.4
olemme huomanneet, että tässä kuvaajassa ei ole jyrkkyyttä. Tätä kutsutaan”taivutuspisteeksi” ekvivalenssipisteessä. Vaaditun jyrkän pH-muutoksen puuttuminen ei anna meille paljon tietoa tällaisen acurven kautta.