a kémiában az ekvivalencia pont egy olyan kifejezés, amelyet a titrálás végrehajtása során használnak. Technikailag minden sav-bázis vagy semlegesítési reakcióra vonatkozik.
meghatározás:
a kémiai reakció egyenértékűségi pontja az a pont, amelyen azonos mennyiségű reagens vegyileg keveredik.
más szavakkal, titrálás közben ez egy olyan pont, ahol a hozzáadott titráló mennyisége elegendő az analit oldat teljes semlegesítéséhez. A titráns móljainak száma, azaz. a standard oldat megegyezik az ismeretlen koncentrációjú oldat móljaival. Sztöchiometrikus pontként is ismert, mert ez egy olyan pont, ahol a sav móljai megegyeznek az oldat semlegesítéséhez szükséges bázis móljaival. Ne feledje, hogy a sav-bázis aránynak nem kell 1:1-nek lennie. Ezt a sav-bázis arányt a kiegyensúlyozott sav-bázis kémiai egyenlet magyarázza. Erre a célra indikátorok használhatók, például metil-narancs vagy fenolftalein.

az ekvivalenciapont nem ugyanaz, mint a titrálás végpontja. A végpontaz a pont, ahol a használt jelző megváltoztatja a színét. Ezek a színváltozások az ekvivalenciapont elérése után jelennek meg. Ha a végpontot használjuk az ekvivalencia meghatározására, akkor hibát okoz.
az Ekvivalenciapont meghatározásának módszerei:
az ekvivalenciapont meghatározására különböző módszerek léteznek. Ezeket a következőképpen tárgyalják:
- pH indikátor
- vezetőképesség
- színváltozás
- Csapadék
- izotermikus kalorimetria
- termometriai titrimetria
- spektroszkópia
- Amperometria
pH indikátor:
APH indikátor olyan kémiai anyag, amely bármilyen kémiai változásra reagálva megváltoztatja színét. Sav-bázis indikátor, például fenolftalein változikszíne, amely a pH-jától függ. Redox indikátorok is használhatók erre a célra. Kezdetben csak egy csepp indikátor oldatot adunk hozzá atitrálás. A színváltozás azt mutatja, hogy a végpont elérte.Ez lesz az ekvivalencia pont becslése.
vezetőképesség:
az oldat elektromos vezetőképességét az ionok befolyásolják. Ezért aa vezetőképesség megváltozik, amikor reagálnak egymással. (például sav-bázis titrálás közben a H3O+ és OH – ionok reakcióba lépnek és semleges vizet, H20 oldatot képeznek). A vezetőképesség viszonylag nehéz módszerkülönösen akkor, ha az oldatban jelen lévő ionok képesek részt venni a vezetőképességben. A vezetőképesség néhány sav-bázisra használhatóreakciókat.
színváltozás:
az ekvivalenciapontnál az oldat természetesen megváltoztatja a színét anélkül, hogy bizonyos reakciókban mutatót adna hozzá. Ez megfigyelhető az átmenet soránfémek, ahol az oxidációs állapot különböző színekből áll.
Csapadék:
a titrálás során a csapadék képződik, haa reakció szilárd anyagot képez. A kicsapódás jó példája a reakcióaz ezüst, az Ag+ és a klór, Cl között, amely oldhatatlan só, ezüst-klorid, AgCl képződését eredményezi. Váratlanul ez nagyon megnehezíti a végpontok pontos meghatározását a részecskeméret, a szemcseméret és a szín aránya miatt nagyon nehéz látni. Ez az oka annak, hogya Csapadék titrálása hátsó titrálásként történik.
izotermikus kalorimetria:
az ekvivalenciapont meghatározása az izotermikus titrációs kaloriméter néven ismert eszköz segítségével előállított vagy elnyelt hőmennyiség kiszámításával történik. Ezt a típust általában olyan titrálásokban használják, amelyek biokémiai reakciókat, azaz enzimkötést tartalmaznak.
termometriai Titrimetria:
a Termometrikustrimetria rendkívül sokrétű technika. Itt az ekvivalenciapontot az achemikus reakció által előidézett hőmérséklet-változás sebességének mérésével határozzuk meg. Ez a tulajdonság megkülönbözteti a kalorimetriatitrimetriától. Mivel a termometriai titrimetria relatív technika, nemaz izotermikus körülmények között történő titráláshoz szükséges. Ez a fajtaa titrálás műanyagokban vagy akár üvegedényekben is elvégezhető. A huzat megelőzése érdekében ezeket az edényeket általában úgy zárják be, hogy bármilyen zajt okoznak, amely megzavarja a végpontot. Mivel az ilyen típusú titrálás környezeti körülmények között végezhető, alkalmasak az iparág rutinszerű folyamataira és minőségellenőrzésére. A hőmérséklet vagy emelkedik, vagy csökken a titrálási folyamat során, attól függően, hogy a titráló és az analit közötti reakció exoterm vagy endoterm. Ittitrálás ha a reakció során az összes analitet elfogyasztották, a hőmérséklet változása, pl. a növekedés vagy csökkenés határozza meg az egyenértékűségetés a hőmérsékleti görbe inflexiója megfigyelhető. Az ekvivalenciapont pontosan megfigyelhető a hőmérsékleti görbe második deriváltjának alkalmazásával. A modern automatedtermometrikus titrálási rendszerben használt szoftver rendszeres fejlett digitális algoritmusokból áll, így a rendkívül érzékeny hőmérséklet-szondákból származó zaj nem okoz interferenciát a végpontot leíró szabályos, egységes másodlagos csúcs megjelenésében. Ez a technika képesnagyon nagy pontossággal és a varianciaefficiens (CVs) kisebb, mint 0,1 areusus. A legújabb termometrikus titrálási hőmérséklet-szondák termisztorral rendelkeznek, amely a Wheatstone-híd egyik karját képezi. a legjobb hőmérő titrationsystem képes megoldani hőmérséklet 10-5 K, ha párosul a nagy felbontású Electronics. Ha a titrálás során a hőmérséklet változik, akkor 0,001 K-nál kisebb lesz, éles ekvivalenciapontot kapunk. Ahol van anenthalpy változás, ez a technika szükségszerűen alkalmazható bármilyen kémiai reakcióra egy folyadékban, bár a reakció kinetikája fontos szerepet játszik a végpont élességének kiszámításában. A titrimetriának ezt a pontját jelentős mértékben alkalmazták a sav-bázis, az EDTA, a REDOX és a csapadék titrálására. Fontospéldák a csapadék titrálására:
- Báriumionokkal végzett Szulfatetitrálás
- magnéziummal Ammóniumoldatban végzett Foszfatetitrálás
- Kloridetitrálás ezüst-nitráttal
- dimetil-Glioximmal végzett Nikkeltitrálás
- alumíniummal végzett Fluoridetitrálás (mint K2NaAlF6)
a nem vizes titrálás könnyen elvégezhető vizes titrálásként, mivel a hőmérséklet-szondát nem kell elektromosan csatlakoztatni az oldathoz, mivel a potenciometrikus titrálásokhoz szükséges. Az erősen zavaros vagy színezett megoldások könnyen elemezhetők hőmérővel, a minta további kezelése nélkül. A szonda karbantartásmentes. Most egy nap a legújabb és nagyon PR-alapú léptetőmotoros büretták használatával a hőmérési titrálás néhány percen belül befejeződik, így ez a technika tökéletes választás, ahol magas laboratóriumi termelésre van szükség.
spektroszkópia:
ebben a típusban spektroszkópiát használnak az ekvivalenciapont meghatározására, ha a reagens, termék vagy titráns spektruma ismert. A termék meghatározott mennyiségeés a reagenst az ekvivalenciapont megkeresésére használják. A szabad titráló jelenlétének nagyon alacsony szintje is meghatározható. Röviden, ezt a módszert alkalmazzáka félvezetők létezésének meghatározására.
Amperometria:
Amperometriaegy detektálási technika, amelyet az áram változásának mérésére használnak.Az amperometriát leginkább azokban a titrálásokban alkalmazzák, ahol a felesleges titrálószer lehetcsökkent. Ez a módszer hasznos a halogenid titrálása közben Ag+ mert a csapadék képződését ez nem befolyásolja.
példák az ekvivalenciapontra:
- erős sav reakciója erős bázissal:
tegyük fel, hogy analitként sósav-HCl-t (erős savat), titrálóként nátrium-hidroxid NaOH-t (erős bázist) veszünk. Ha gráfot ábrázolunk az analit pH és a bürettából hozzáadható NaOH titráló között, akkor egy titrálási gráf alakul ki, mint az alábbiakban:
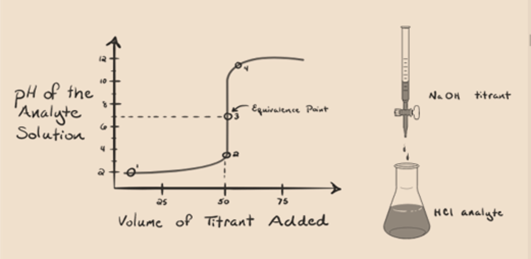
1.1. ábra
a fenti 1.1. ábra az 1. pontban azt mutatja, hogy ha nem adunk hozzá olyan bázist, mint a NaOH. Az analit pH-ja alacsony, mivel többnyire H-t tartalmaz3o+ a HCl elválasztásából.

mivel a nátrium-hidroxid NaOH cseppenként kerül hozzáadásra, az OH– lassan felszívódik, amelyet a NaOH disszociációja termel. Az előállított analit savas lesz a dominánshidróniumionok jelenléte, H3O+.
az 1.1.ábrán a 2. pont azt az időpontot jelöli, amikor a pH-t közvetlenül a semlegesítés teljes végrehajtása előtt rögzítik. Míg a 3. pont megmutatja nekünk az ekvivalencia pontot. Itt a hozzáadott nátrium-hidroxid móljai megegyeznek az analitban lévő hidroxil-klorid móljaival. Ez az a pont, ahol a hidróniumionok, H3O+ hidroxilion, OH–teljesen semlegesítik. Az oldat pH-ja semleges, azaz pH=7, mert só, NaCl és víz H2O.
az 1.1. ábra 4. pontja azt mutatja, hogy a NaOH hozzáadásával az oldat pH-ja a HCl teljes semlegesítése miatt bázikussá válik. Most rengeteg OH-ionok vannak jelen az oldatban, amely disszociál NaOH.
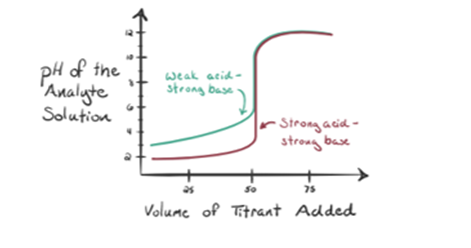
- a gyenge sav reakciója erős bázissal:
Vegyünk egy gyenge savat, egy ecetsavat CH3COOH és egy erős bázisú nátrium-hidroxid NaOH-t titrálónak. Ha ábrázolunk egy grafikont az analit pH-ja és a NaOH térfogata között, akkor egy titrálási görbét kapunk az alábbiak szerint.
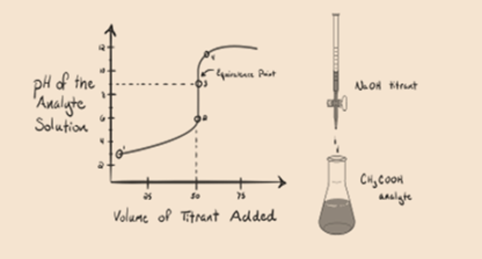
1.2. ábra
az 1.2. ábra az 1.pontban azt mutatja, hogy a NaOH-t még nem adják hozzá, tehát jelenleg az analit pH-ja alacsony, mivel többnyire H-t tartalmaz3o+ amikor CH3COOH disszociál. De mivel az ecetsav gyenge sav, ezért a kezdetben a pH magasabb lesz.

ahogy folyamatosan hozzáadjuk a NaOH-t cseppenként, a H3O+ elkezdi fogyasztani OH-lassan. Ezt a NaOH disszociációja fogja előállítani. De itt az analit még mindig savas a H jelenléte miatt3o+ionok többnyire.
az 1.2.ábra 2. pontja azt a pH-értéket jelzi, amelyet közvetlenül az aneutralizálás előtt rögzítettek.
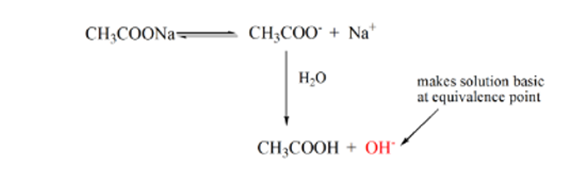
a 3.pont az ekvivalenciapontot jelenti. Ez az a pont, ahol a NaOH molja megegyezik a CH3COOH moljaival egy analitban. A hidróniumionokat hidroxilionok teljesen semlegesítik. Az oldat ezután CH3COONa sót és H2O-t tartalmaz.

Megjegyzés:
Youcan észre különbséget itt, mint egy eset 1 Egy, amelynek strongacid titrált ellen erős bázis. Ebben az esetben (gyenge sav és erősbázis) a pH nem semleges az ekvivalencia pontján. Az oldat pH-ja~9 az ekvivalencia ponton. Kitaláljuk az alábbi okot.
a fenti egyenletből látható, hogy az oldat CH3COONa-t tartalmaz az ekvivalenciapontban. Ez nátrium-és acetátionokká disszociál. Az acetátion a gyenge sav konjugált bázisa CH3COOH. Ezért a CH3COO-viszonylag erős bázis (azaz a gyenge savnak erős konjugált bázisa van), ezért vízzel reagálva hidroxidionokat állítanak elő, amelyek az ekvivalencia pontján közel 9-re növelik a pH-t.
az 1.2. ábra 4. pontja azt mutatja, hogy ha a nátrium-hidroxid nagyobb mennyiségben van, a kapott titrálási görbe megegyezik a HCl-NaOH-val.
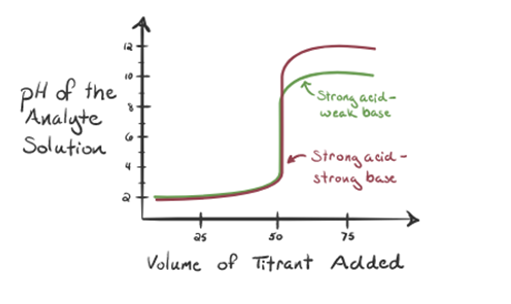
- Erőssav gyenge bázissal:
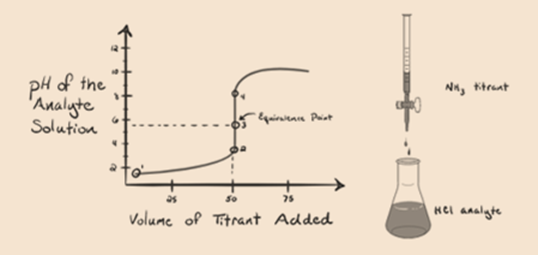
itt tekintsük a sósavat erős savnak, mint analitnak, az ammóniát pedig gyenge bázisnak, mint titránsnak. Ha ábrázolunk egy grafikont a vizsgált oldat pH-ja és az NH3 titráló térfogata között, akkor az alábbiakban megadott titrálási görbét kapjuk:
1.3. ábra
az 1.3.ábra 1. pontja azt mutatja, hogy ammónia hozzáadása nélkül az analit pH-ja alacsony lesz, mivel többnyire a sósav disszociációjából származó H3O+ – t tartalmaz.
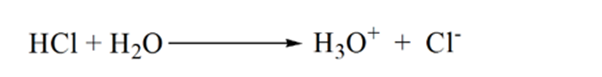
ahogy cseppenként hozzáadják az ammóniát, a H3O + lassan elkezdi fogyasztani az ammóniát. Az analit a H3O+ ionok többsége miatt továbbra is savas lesz.
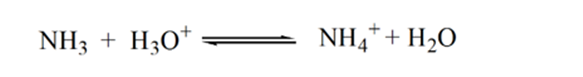
az 1.3. ábra 2. pontja azt jelzi, hogy a pH-t egy ponton rögzítik, közvetlenül az aneutralizáció teljes végrehajtása előtt.
a 3.pont az ekvivalenciapontot mutatja. Itt a hozzáadott NH3 mólok számaegyenlő a HCl móljaival az analitban. A hidróniumionok teljesenaz NH3 semlegesíti.
Megjegyzés:
észrevette, hogy az erős savval szembeni gyenge bázis esetén a pH nem semleges az egyenértékűség pontján. Ezért az elért megoldássavas lesz, amelynek pH-ja 5,5 körül van az egyenértékűség pontján.
ennek az az oka, hogy egy egyenértékűségi ponton az oldatban csak NH4+ ammóniumionok és Cl-kloridionok vannak. Mivel az ammóniumionok egy gyenge bázis konjugált savja, azaz NH3. Ezért az NH4 + erős sav, így az NH4 + vízzel reagálva hidróniumionokat állít elő, amelyek savasvá teszik az oldatot.
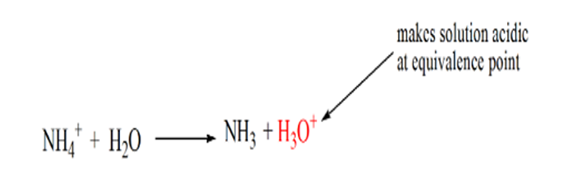
a 4. pont azt mutatja, hogy az ekvivalencia pont elérése után folytatjuk az ammónia hozzáadását, és ha feleslegben van, a pH növekedni kezd. Az ammónia gyenge bázis, tehát pH-ja 7 felett van,de alacsonyabb, mint az 1. esetben bemutatott erős NaOH bázis.
- gyenge bázis gyenge savval:
vizsgáljuk meg az ammóniát, egy gyenge bázist mint analitot, és az ecetsavat, amely gyenge sav, mint titráns. Ha grafikont ábrázolunk az analitoldat pH-ja és az ecetsav mint titráló térfogata között, akkor az alábbiak szerint titrálási görbét kapunk:
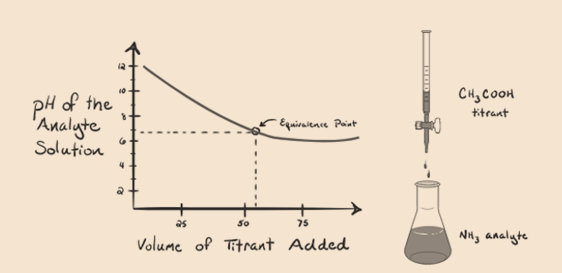
1.4 ábra
észrevettük, hogy ebben a grafikonban nincs meredek. Ez az, amit az ekvivalencia pontján”inflexiós pontnak” nevezünk. A pH szükséges meredek változásának hiánya nem ad sok információt az ilyen fordulaton keresztül.