„a fi sau a nu fi: aceasta este întrebarea.”În timp ce suntem cu toții gata să luăm decizii de viață sau de moarte, această dihotomie existențială este excepțional de puternică pentru celulele embrionare. Moartea celulară programată, numită apoptoză,* este o parte normală a dezvoltării. În nematodul C. elegans, în care putem număra numărul de celule, exact 131 de celule mor conform modelului normal de dezvoltare. Toate celulele acestui nematod sunt „programate” să moară dacă nu li se spune în mod activ să nu sufere apoptoză. La om, până la 1011 celule mor în fiecare adult în fiecare zi și sunt înlocuite cu alte celule. (Într-adevăr, masa celulelor pe care le pierdem în fiecare an prin moartea normală a celulelor este aproape de întreaga noastră greutate corporală! În interiorul uterului, produceam și distrugeam în mod constant celule și am generat de aproximativ trei ori mai mulți neuroni decât am ajuns în cele din urmă când ne-am născut. Lewis Thomas (1992) a remarcat pe bună dreptate,
până când m-am născut, mai mulți dintre mine muriseră decât supraviețuiseră. Nu era de mirare că nu-mi amintesc; în acest timp am trecut prin creier după creier timp de nouă luni, inventând în cele din urmă singurul model care ar putea fi uman, echipat pentru limbaj.
apoptoza este necesară nu numai pentru spațierea și orientarea corectă a neuronilor, ci și pentru generarea spațiului urechii medii, a deschiderii vaginale și a spațiilor dintre degetele și degetele de la picioare Saunders și Fallon 1966roberts și Miller 1998;Rodriguez și colab. 1997. Apoptoza îndepărtează structurile care nu sunt necesare, controlează numărul de celule în anumite țesuturi și sculptează organe complexe.
diferite țesuturi utilizează semnale diferite pentru apoptoză. Unul dintre semnalele utilizate adesea la vertebrate este proteina morfogenetică osoasă 4 (BMP4). Unele țesuturi, cum ar fi țesutul conjunctiv, răspund la BMP4 prin diferențierea în os. Alții, cum ar fi broasca gastrula ectoderm, răspund la BMP4 prin diferențierea în piele. Încă altele, cum ar fi celulele crestei neuronale și primordia dinților, răspund degradându-și ADN-ul și murind. În dintele în curs de dezvoltare, de exemplu, numeroși factori de creștere și diferențiere sunt secretați de nodul smalțului. După ce vârful a crescut, nodul de smalț sintetizează BMP4 și se închide prin apoptoză (vezi capitolul 13; Vaahtokari și colab. 1996b).
în alte țesuturi, celulele sunt” programate „să moară și vor rămâne în viață numai dacă este prezent un factor de creștere sau diferențiere pentru a le” salva”. Acest lucru se întâmplă în timpul dezvoltării globulelor roșii din mamifere. Precursorii globulelor roșii din ficatul de șoarece au nevoie de hormonul eritropoietină pentru a supraviețui. Dacă nu o primesc, suferă apoptoză. Receptorul eritropoietinei acționează prin calea JAK-STAT, activând factorul de transcripție Stat5. În acest fel, cantitatea de eritropoietină prezentă poate determina câte celule roșii din sânge intră în circulație.
una dintre căile de apoptoză a fost în mare parte delimitată prin studii genetice ale C. elegans. S-a constatat că proteinele codificate de genele ced-3 și ced-4 erau esențiale pentru apoptoză, dar că în celulele care nu au suferit apoptoză, acele gene au fost oprite de produsul genei ced-9 (figura 6.27 a; Hengartner și colab. 1992). Proteina CED-4 este un factor de activare a proteazei care activează CED-3, o protează care inițiază distrugerea celulei. Mutațiile care inactivează proteina CED-9 determină numeroase celule care ar supraviețui în mod normal pentru a-și activa genele ced-3 și ced-4 și a muri. Aceasta duce la moartea întregului embrion. În schimb, mutațiile de câștig de funcție ale ced-9 determină producerea proteinei CED-9 în celule care altfel ar muri. Astfel, gena ced-9 pare a fi un comutator binar care reglează alegerea dintre viață și moarte la nivel celular. Este posibil ca fiecare celulă din embrionul nematod să fie gata să moară, iar acele celule care supraviețuiesc sunt salvate prin activarea genei ced-9.
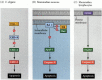
figura 6.27
căi de apoptoză la nematode și mamifere. (A) în C. elegans, proteina CED-4 este un factor de activare a proteazei care poate activa proteaza CED-3. Proteaza CED-3 inițiază evenimentele de distrugere a celulelor. CED-9 poate inhiba CED-4 (și CED-9 poate fi (mai mult…)
proteinele CED-3 și CED-4 formează centrul căii de apoptoză care este comun tuturor animalelor studiate. Declanșatorul apoptozei poate fi un indiciu de dezvoltare, cum ar fi o anumită moleculă (cum ar fi BMP4 sau glucocorticoizi) sau pierderea aderenței la o matrice. Oricare tip de TAC poate activa proteinele CED-3 sau CED-4 sau inactiva moleculele CED-9. La mamifere, omologii proteinei CED-9 sunt membri ai familiei de gene Bcl-2. Această familie include Bcl-2, Bcl-X și gene similare. Asemănările funcționale sunt atât de puternice încât, dacă o genă BCL-2 umană activă este plasată în embrionii C. elegans, aceasta previne decesele celulare care apar în mod normal în embrionii nematode (Vaux și colab. 1992). În dezvoltarea celulelor roșii din sânge vertebrate (menționate mai sus), factorul de transcripție Stat5 activat de eritropoietină funcționează prin legarea la promotorul genei Bcl-X, unde activează sinteza acelei proteine anti-apoptoză (Socolovsky și colab. 1999).
omologul mamifer al CED-4 se numește Apaf-1 (factorul de activare a proteazei apoptotice-1) și participă la activarea dependentă de citocrom C a omologilor CED-3 de mamifere, a proteazelor caspaza-9 și caspaza-3 (Shaham și Horvitz 1996; Cecconi și colab. 1998; Yoshida și colab. 1998). Activarea caspazelor determină autodigestia celulei. Caspazele sunt proteaze puternice și digeră celula din interior. Proteinele celulare sunt scindate și ADN-ul este fragmentat.
în timp ce nematodele cu deficit de apoptoză deficitare pentru CED-4 sunt viabile (în ciuda faptului că au cu 15% mai multe celule decât viermii de tip sălbatic), șoarecii cu mutații ale pierderii funcției fie pentru caspaza-3, fie pentru caspaza-9 mor în jurul nașterii din cauza supraaglomerării masive a celulelor în sistemul nervos (figura 6.28; Kuida și colab. 1996, 1998; Jacobson și colab. 1997). Șoarecii homozigoți pentru ștergerea țintită a Apaf-1 au anomalii craniofaciale severe, supraaglomerarea creierului și chingi între degetele de la picioare.
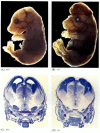
figura 6.28
întreruperea dezvoltării normale a creierului prin blocarea apoptozei. La șoarecii la care caspaza-9 sau Apaf-1 a fost eliminată, apoptoza neuronală normală nu reușește să apară. La șoarecii cu deficit de caspază 9, supraproliferarea neuronilor creierului este evidentă pe un morfologic (mai mult…)
la mamifere, există mai multe căi spre apoptoză. Apoptoza limfocitelor, de exemplu, nu este afectată de eliminarea Apaf-1 sau caspaza-9 și funcționează printr-o cale separată inițiată de proteina CD95 (Figura 6.27B, C) diferite caspaze pot funcționa în diferite tipuri de celule pentru a media semnalele apoptotice (Hakem și colab. 1998; Kuida și colab. 1998).
WEBSITE
6.7 utilizările apoptozei. Apoptoza este utilizată pentru numeroase procese de-a lungul dezvoltării. Acest site explorează rolul apoptozei în fenomene precum dezvoltarea celulelor germinale Drosophila și ochii peștilor de peșteră orbi. http://www.devbio.com/chap06/link0607.shtml
casetă
interacțiuni celulă-celulă și șansă în determinarea tipurilor de celule.
note de subsol
*
apoptoza (ambele”p” sunt pronunțate) provine din cuvântul grecesc pentru procesele naturale ale frunzelor care cad din copaci sau petale din flori. Este activ și poate fi selectat evolutiv. Celălalt tip de moarte celulară, necroza, este o moarte patologică cauzată de factori externi, cum ar fi inflamația sau leziunile toxice.
†
există unele dovezi (vezi Barinaga 1998a,b; Saudou și colab. 1998) că activarea căii de apoptoză la neuronii adulți poate fi responsabilă pentru patologia bolii Alzheimer și a accidentului vascular cerebral. Fragmentarea ADN-ului este una dintre modalitățile majore prin care apoptoza este recunoscută și este observată în regiunile creierului afectate de aceste boli. Fragmentarea sa în bucăți de dimensiuni specifice(protejate și ținute împreună de nucleozomi) poate fi cauzată de digestia poli (ADP-riboză) polimerază (PARP) de caspază-3 (Lazebnik și colab. 1994). PARP recunoaște și repară pauzele de ADN. Pentru mai multe despre alte căi care duc la apoptoză, vezi Verde 1998.