” att vara eller inte vara: det är frågan.”Medan vi alla är redo för beslut om liv eller död, är denna existentiella dikotomi exceptionellt stark för embryonala celler. Programmerad celldöd, kallad apoptos, * är en normal del av utvecklingen. I nematoden C. elegans, där vi kan räkna antalet celler, dör exakt 131 celler enligt det normala utvecklingsmönstret. Alla celler i denna nematod är” programmerade ” att dö om de inte aktivt berättas att inte genomgå apoptos. Hos människor dör så många som 1011 celler i varje vuxen varje dag och ersätts av andra celler. (Faktum är att massan av celler vi förlorar varje år genom normal celldöd ligger nära hela vår kroppsvikt!) I livmodern skapade och förstörde vi ständigt celler, och vi genererade ungefär tre gånger så många neuroner som vi så småningom slutade med när vi föddes. Lewis Thomas (1992) har träffande noterat,
när jag föddes hade mer av mig dött än överlevt. Inte konstigt att jag inte minns; under den tiden gick jag igenom hjärna efter hjärna i nio månader och slutligen konstruerade den enda modellen som kunde vara mänsklig, utrustad för språk.
Apoptos är nödvändig inte bara för korrekt avstånd och orientering av neuroner, men också för att generera mellanöratutrymmet, vaginalöppningen och mellanrummen mellan våra fingrar och tår Saunders och Fallon 1966roberts och Miller 1998;Rodriguez et al. 1997. Apoptos svampar bort onödiga strukturer, kontrollerar antalet celler i synnerhet vävnader och skulpterar komplexa organ.
olika vävnader använder olika signaler för apoptos. En av de signaler som ofta används i ryggradsdjur är benmorfogenetiskt protein 4 (BMP4). Vissa vävnader, såsom bindväv, svarar på BMP4 genom att differentiera till ben. Andra, såsom grodan gastrula ectoderm, svarar på BMP4 genom att differentiera sig i huden. Ytterligare andra, såsom neurala vapenceller och tand primordia, svarar genom att försämra deras DNA och dö. I den utvecklande tanden utsöndras till exempel många tillväxt-och differentieringsfaktorer av emaljknuten. Efter att cusp har vuxit, emaljknuten syntetiserar BMP4 och stänger sig av apoptos (se kapitel 13; Vaahtokari et al. 1996b).
i andra vävnader är cellerna ”programmerade” att dö, och de kommer att förbli levande endast om någon tillväxt-eller differentieringsfaktor är närvarande för att ”rädda” dem. Detta händer under utvecklingen av däggdjursröda blodkroppar. De röda blodkroppsprekursorerna i musleveren behöver hormonet erytropoietin för att överleva. Om de inte får det, genomgår de apoptos. Erytropoietinreceptorn fungerar genom JAK-STAT-vägen och aktiverar Stat5-transkriptionsfaktorn. På detta sätt kan mängden närvarande erytropoietin bestämma hur många röda blodkroppar som kommer in i cirkulationen.
en av vägarna för apoptos avgränsades till stor del genom genetiska studier av C. elegans. Det visade sig att proteinerna kodade av CED-3-och ced-4-generna var väsentliga för apoptos, men att i cellerna som inte genomgick apoptos stängdes dessa gener av produkten av CED-9-genen (figur 6.27 a; Hengartner et al. 1992). CED-4-proteinet är en proteasaktiverande faktor som aktiverar CED-3, ett proteas som initierar förstörelsen av cellen. Mutationer som inaktiverar CED-9-proteinet orsakar många celler som normalt skulle överleva för att aktivera sina CED-3-och ced-4-gener och dö. Detta leder till att hela embryot dör. Omvänt orsakar förstärkningsfunktionsmutationer av ced-9 att CED-9-protein tillverkas i celler som annars skulle dö. Således verkar CED-9-genen vara en binär switch som reglerar valet mellan liv och död på cellulär nivå. Det är möjligt att varje cell i nematodembryot är redo att dö, och de celler som överlever räddas genom aktivering av CED-9-genen.
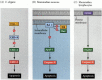
figur 6.27
Apoptosvägar i nematoder och däggdjur. (A) i C. elegans är CED-4-proteinet en proteasaktiverande faktor som kan aktivera CED-3-proteaset. CED-3-proteaset initierar cellförstörelsehändelserna. CED-9 kan hämma CED-4 (och CED-9 kan vara (mer…)
CED-3-och CED-4-proteinerna utgör centrum för apoptosvägen som är gemensam för alla studerade djur. Utlösaren för apoptos kan vara en utvecklings cue såsom en viss molekyl (såsom BMP4 eller glukokortikoider) eller förlust av vidhäftning till en matris. Endera typen av cue kan aktivera CED-3-eller CED-4-proteinerna eller inaktivera CED-9-molekylerna. Hos däggdjur är homologerna av CED-9-proteinet medlemmar i Bcl-2-familjen av gener. Denna familj inkluderar Bcl-2, Bcl-X och liknande gener. De funktionella likheterna är så starka att om en aktiv human BCL-2-gen placeras i C. elegans-embryon, förhindrar det normalt förekommande celldöd i nematodembryonerna (Vaux et al. 1992). Vid utveckling av röda blodkroppar i ryggradsdjur (nämnts ovan) fungerar Stat5-transkriptionsfaktorn aktiverad av erytropoietin genom att binda till promotorn för Bcl-X-genen, där den aktiverar syntesen av det anti-apoptosproteinet (Socolovsky et al. 1999).
däggdjurshomologen för CED-4 kallas Apaf-1 (apoptotisk proteasaktiverande faktor-1), och den deltar i cytokrom C-beroende aktivering av däggdjurshomologerna CED-3, proteaserna caspase-9 och caspase-3 (Shaham och Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). Aktiveringen av kaspaserna orsakar cellens autodigestion. Kaspaser är starka proteaser, och de smälter cellen inifrån. De cellulära proteinerna klyvs och DNA är fragmenterat.
medan apoptosbrist nematoder som är bristfälliga för CED-4 är livskraftiga (trots att de har 15% fler celler än vildtypsmaskar), möss med funktionsförlustmutationer för antingen caspase-3 eller caspase-9 dör runt födseln från massiv cellöverväxt i nervsystemet (figur 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Möss homozygota för riktade borttagningar av Apaf-1 har allvarliga kraniofaciala abnormiteter, överväxt av hjärnan och band mellan tårna.
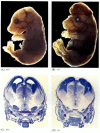
figur 6.28
störning av normal hjärnutveckling genom att blockera apoptos. Hos möss där caspase-9 eller Apaf-1 har slagits ut, misslyckas normal neural apoptos. I caspase 9-bristfälliga möss är överproliferationen av hjärnneuroner uppenbar på en morfologisk (mer…)
hos däggdjur finns det mer än en väg till apoptos. Lymfocyternas apoptos påverkas till exempel inte av borttagningen av Apaf-1 eller caspase-9 och verkar genom en separat väg initierad av CD95-proteinet (Figur 6.27B, C) olika kaspaser kan fungera i olika celltyper för att förmedla de apoptotiska signalerna (Hakem et al. 1998; Kuida et al. 1998).
webbplats
6.7 användningen av apoptos. Apoptos används för många processer under hela utvecklingen. Denna webbplats utforskar apoptosens roll i sådana fenomen som Drosophila bakteriecellutveckling och ögonen på blind grottfisk. http://www.devbio.com/chap06/link0607.shtml
Box
cell-cell interaktioner och chans vid bestämning av celltyper.
fotnoter
*
apoptos (båda”p” s uttalas) kommer från det grekiska ordet för de naturliga processerna av löv som faller från träd eller kronblad från blommor. Det är aktivt och kan evolutionärt väljas. Den andra typen av celldöd, nekros, är en patologisk död orsakad av yttre faktorer som inflammation eller giftig skada.
†
det finns vissa bevis (se Barinaga 1998A, b; Saudou et al. 1998) att aktivering av apoptosvägen hos vuxna neuroner kan vara ansvarig för patologin för Alzheimers sjukdom och stroke. Fragmentering av DNA är ett av de viktigaste sätten att apoptos känns igen, och det ses i regioner i hjärnan som påverkas av dessa sjukdomar. Dess fragmentering i bitar av specifik storlek(skyddad och hålls samman av nukleosomer) kan orsakas av matsmältningen av poly (ADP-ribos) polymeras (PARP) av caspase-3 (Lazebnik et al. 1994). PARP känner igen och reparerar DNA-raster. För mer om andra vägar som leder till apoptos, se Green 1998.