「あるべきか、ないべきか:それが問題です。「私たちは皆、生死の決定に態勢を整えていますが、この実存的な二分法は胚細胞にとって非常に厳しいものです。 アポトーシスと呼ばれるプログラムされた細胞死*は、開発の正常な部分です。 線虫c.elegansでは、細胞の数を数えることができ、正確に131細胞が正常な発達パターンに従って死ぬ。 この線虫のすべての細胞は、アポトーシスを受けないように積極的に言われない限り、死ぬように”プログラム”されています。 ヒトでは、1011もの細胞が毎日各成人で死亡し、他の細胞に置き換えられます。 (確かに、私たちは通常の細胞死を通じて毎年失う細胞の質量は、私たちの全体の体重に近いです!)子宮内では、私たちは常に細胞を作り、破壊していた、と私たちは最終的に私たちが生まれたときに終わったように、我々は約三倍のニューロンを生成しました。 Lewis Thomas(1992)は次のように述べている。,
私が生まれた時には、私の多くは生き残ったよりも死んでいました。 それは私が覚えていないのも不思議ではなかった; その間、私は9ヶ月間脳を経て、最終的に言語を備えた人間である可能性のあるモデルを考案しました。
アポトーシスは、ニューロンの適切な間隔と向きだけでなく、中耳の空間、膣の開口部、および指とつま先の間の空間を生成するためにも必要であるSaunders and Fallon1966roberts and Miller1998;Rodriguez et al. 1997. アポトーシスは、不要な構造を取り除き、特定の組織の細胞の数を制御し、複雑な器官を彫刻する。
異なる組織はアポトーシスのために異なるシグナルを使用する。 脊椎動物でよく使用されるシグナルの一つは、骨形態形成タンパク質4(BMP4)である。 結合組織のようないくつかの組織は、骨に分化することによってBMP4に応答する。 カエル原腸外胚葉のような他のものは、皮膚に分化することによってBMP4に応答する。 さらに、神経堤細胞や歯の原基などの他のものは、DNAを分解して死ぬことによって反応します。 例えば、発達中の歯では、エナメル質の結び目によって多数の成長および分化因子が分泌される。 カスプが成長した後、エナメル結び目はBMP4を合成し、アポトーシスによってそれ自体をシャットダウンする(第13章を参照;Vaahtokari et al. 1996b)。
他の組織では、細胞は死ぬように”プログラム”されており、それらを”救出”するために何らかの成長または分化因子が存在する場合にのみ生きています。 これは、哺乳動物の赤血球の発達中に起こる。 マウス肝臓の赤血球前駆体は、生存するためにホルモンエリスロポエチンを必要とする。 彼らはそれを受信しない場合、彼らはアポトーシスを受けます。 エリスロポエチン受容体はJAK-STAT経路を介して働き、Stat5転写因子を活性化する。 このようにして、存在するエリスロポエチンの量は、どのように多くの赤血球が循環に入るかを決定することができる。
アポトーシスのための経路の一つは、主に線虫C.elegansの遺伝学的研究を通じて描かれました。 Ced-3およびced-4遺伝子によってコードされるタンパク質はアポトーシスに必須であったが、アポトーシスを受けなかった細胞では、これらの遺伝子はced-9遺伝子の産物によってオフになっていたことが分かった(図6.27A;Hengartner et al. 1992). CED-4タンパク質は、細胞の破壊を開始するプロテアーゼであるCED-3を活性化するプロテアーゼ活性化因子である。 CED-9タンパク質を不活性化する突然変異は、ced-3およびced-4遺伝子を活性化して死ぬために通常生き残るであろう多数の細胞を引き起こす。 これは胚全体の死につながる。 逆に、ced-9の機能獲得突然変異は、そうでなければ死ぬであろう細胞内でCED-9タンパク質が作られる原因となる。 したがって、ced-9遺伝子は、細胞レベルでの生と死の間の選択を調節するバイナリスイッチであるように見えます。 線虫胚のすべての細胞が死ぬ態勢を整えており、生き残った細胞はced-9遺伝子の活性化によって救助される可能性があります。
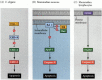
CED-3およびCED-4蛋白質は調査されるすべての動物に共通であるapoptosisの細道の中心を形作ります。 アポトーシスの引き金は、特定の分子(BMP4またはグルココルチコイドなど)またはマトリックスへの接着の喪失などの発生の合図であり得る。 キューのいずれかのタイプは、CED-3またはCED-4タンパク質を活性化したり、CED-9分子を不活性化することができます。 哺乳動物では、CED-9タンパク質の相同体は、遺伝子のBcl-2ファミリーのメンバーである。 このファミリーには、Bcl-2、Bcl-X、および同様の遺伝子が含まれる。 機能的類似性は非常に強いので、活性ヒトBCL−2遺伝子が線虫胚に配置される場合、線虫胚において正常に発生する細胞死を防止する(Vaux e t a l. 1992). 脊椎動物の赤血球発生(上記)では、エリスロポエチンによって活性化されたStat5転写因子は、Bcl-X遺伝子のプロモーターに結合することによって機能し、Bcl-X遺伝子のプロモーターに結合して、その抗アポトーシスタンパク質の合成を活性化する(Socolovsky et al. 1999).
ced-4の哺乳類相同体はApaf-1(apoptotic protease activating factor-1)と呼ばれ、哺乳類CED-3相同体、プロテアーゼcaspase-9およびcaspase-3のシトクロムc依存性活性化に関与している(Shaham and Horvitz1996;Cecconi et al. 1998年、吉田ら。 1998). カスパーゼの活性化は、細胞の自己消化を引き起こす。 カスパーゼは強力なプロテアーゼであり、彼らは内部から細胞を消化します。 細胞タンパク質は切断され、DNAは断片化される。Γ
ced-4を欠損したアポトーシス欠損線虫は生存可能であるが(野生型ワームよりも15%多くの細胞を有するにもかかわらず)、カスパーゼ-3またはカスパーゼ-9のいずれかの機能喪失変異を有するマウスは、神経系における大規模な細胞過増殖から出生時に死ぬ(図6.28;Kuida et al. 1 9 9 6,1 9 9 8;Jacobson e t a l. 1997). Apaf-1の標的とされた欠失のためのホモ接合マウスは、重度の頭蓋顔面異常、脳の過増殖、および彼らのつま先の間のウェビングを持っています。
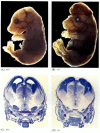
図6.28
アポトーシスを遮断することによる正常な脳発達の破壊。 カスパーゼ-9またはApaf-1がノックアウトされたマウスでは、正常な神経アポトーシスが発生することができません。 カスパーゼ9欠損マウスでは、脳ニューロンの過剰増殖は形態学的に明らかである(もっと。..)
哺乳類では、アポトーシスへの複数の経路があります。 例えば、リンパ球のアポトーシスは、Apaf-1またはカスパーゼ-9の欠失によって影響されず、CD95タンパク質によって開始される別個の経路によって作用する(図6.2 7B、C)異なるカスパーゼが、アポトーシスシグナルを媒介するために異なる細胞型で機能し得る(Hakem e t a l. 1 9 9 8;Kuida e t a l. 1998).
Apoptosisは開発中の多数のプロセスのために使用されます。 このウェブサイトでは、ショウジョウバエの生殖細胞の発達や盲目の洞窟魚の目などの現象におけるアポトーシスの役割を探ります。 http://www.devbio.com/chap06/link0607.shtml
ボックス
細胞間相互作用と細胞型の決定におけるチャンス。
脚注
*
アポトーシス(両方の”p”sが発音されます)は、花から木や花びらから落ちる葉の自然なプロセスのためのギリシャ語から来ています。 それは活発で、進化的に選択することができます。 他のタイプの細胞死、壊死は、炎症または毒性傷害などの外部要因によって引き起こされる病理学的死である。
†
いくつかの証拠がある(Barinaga1 9 9 8a,b;Saudou e t a l. 1998)成人ニューロンにおけるアポトーシス経路の活性化は、アルツハイマー病および脳卒中の病理に関与している可能性があること。 DNAの断片化は、アポトーシスが認識される主要な方法の一つであり、それはこれらの疾患の影響を受ける脳の領域で見られています。 特定のサイズの断片(ヌクレオソームによって保護され、一緒に保持されている)へのその断片化は、カスパーゼ-3によるポリ(ADP-リボース)ポリメラーゼ(PARP)の消化によっ 1994). PARPはDNA切断を認識し、修復します。 アポトーシスにつながる他の経路の詳細については、Green1998を参照してください。