” To be, or not to be: that is the question.”Terwijl we allemaal klaar staan voor beslissingen over leven of dood, is deze existentiële dichotomie uitzonderlijk grimmig voor embryonale cellen. Geprogrammeerde celdood, apoptose genoemd, * is een normaal onderdeel van ontwikkeling. In de nematode C. elegans, waarin we het aantal cellen kunnen tellen, sterven precies 131 cellen volgens het normale ontwikkelingspatroon. Alle cellen van deze nematode zijn “geprogrammeerd” om te sterven, tenzij ze actief worden verteld geen apoptose te ondergaan. Bij mensen sterven elke dag maar liefst 1011 cellen af in elke volwassene en worden vervangen door andere cellen. (Inderdaad, de massa van cellen die we elk jaar verliezen door normale celdood is dicht bij ons hele lichaamsgewicht! In de baarmoeder maakten en vernietigden we voortdurend cellen, en we genereerden ongeveer drie keer zoveel neuronen als we uiteindelijk kregen toen we geboren werden. Lewis Thomas (1992) heeft treffend opgemerkt,
tegen de tijd dat ik geboren werd, waren er meer van mij gestorven dan overleefden. Het was geen wonder dat ik me niet kan herinneren; gedurende die tijd ging ik negen maanden door brein na brein, om uiteindelijk het enige model te bedenken dat menselijk kon zijn, uitgerust voor taal.Apoptose is niet alleen noodzakelijk voor de juiste afstand en oriëntatie van neuronen, maar ook voor het genereren van de middenoorruimte, de vaginale opening en de ruimte tussen onze vingers en tenen Saunders en Fallon 1966Roberts en Miller 1998;Rodriguez et al. 1997. Apoptosis snoeit onnodige structuren weg, controleert het aantal cellen in het bijzonder weefsels, en beeldhouwt complexe organen.
verschillende weefsels gebruiken verschillende signalen voor apoptose. Een van de signalen vaak gebruikt in gewervelde dieren is Bot morfogenetic protein 4 (BMP4). Sommige weefsels, zoals bindweefsel, reageren op BMP4 door te differentiëren in bot. Anderen, zoals de kikker gastrula ectoderm, reageren op BMP4 door te differentiëren naar de huid. Weer anderen, zoals neurale kamcellen en tandprimordia, reageren door hun DNA af te breken en te sterven. In de zich ontwikkelende tand worden bijvoorbeeld tal van groei-en differentiatiefactoren afgescheiden door de glazuurknoop. Nadat de cusp is gegroeid, de emaille knoop synthetiseert BMP4 en sluit zich af door apoptose (zie hoofdstuk 13; Vaahtokari et al. 1996b).
in andere weefsels zijn de cellen ” geprogrammeerd “om af te sterven en blijven zij alleen in leven als er een groei-of differentiatiefactor aanwezig is om hen te” redden”. Dit gebeurt tijdens de ontwikkeling van zoogdierrode bloedcellen. De voorlopers van rode bloedcellen in de muizenlever hebben het hormoon erytropoëtine nodig om te overleven. Als ze het niet ontvangen, ondergaan ze apoptose. De erytropoëtinereceptor werkt via de Jak-STAT-route en activeert de stat5-transcriptiefactor. Op deze manier kan de hoeveelheid aanwezige erytropoëtine bepalen hoeveel rode bloedcellen in de bloedsomloop terechtkomen.Een van de routes voor apoptose werd grotendeels afgebakend door genetische studies van C. elegans. Men vond dat de proteã nen die door de genen ced-3 en ced-4 worden gecodeerd essentieel voor apoptose waren, maar dat in de cellen die geen apoptose ondergingen, die genen door het product van het gen CED-9 werden uitgeschakeld (figuur 6.27 a; Hengartner et al. 1992). Het CED-4-eiwit is een protease-activerende factor die CED-3 activeert, een protease die de vernietiging van de cel in gang zet. Mutaties die het CED-9-eiwit inactiveren veroorzaken talrijke cellen die normaal zouden overleven om hun CED-3-en ced-4-genen te activeren en af te sterven. Dit leidt tot de dood van het hele embryo. Omgekeerd, veroorzaken de winst-van-functieveranderingen van CED-9 proteã ne CED-9 om in cellen worden gemaakt die anders zouden sterven. Aldus, lijkt het gen ced-9 om een binaire schakelaar te zijn die de keus tussen leven en dood op cellulair niveau regelt. Het is mogelijk dat elke cel in het nematodeembryo klaar staat om te sterven, en die cellen die overleven worden gered door de activering van het CED-9-gen.
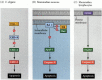
figuur 6.27
apoptose-routes bij nematoden en zoogdieren. (A) In C. elegans is het CED-4-eiwit een protease-activerende factor die het CED-3-protease kan activeren. De CED-3 protease initieert de cel vernietiging gebeurtenissen. CED-9 kan CED-4 remmen (en CED-9 kan zijn (meer…)
de CED-3 en CED-4 proteã nen vormen het centrum van de apoptosisweg die aan alle bestudeerde dieren gemeenschappelijk is. De trekker voor apoptosis kan een ontwikkelingskeu zoals een bepaalde molecule (zoals bmp4 of glucocorticoïden) of het verlies van adhesie aan een matrijs zijn. Of het type cue kan de CED-3 of CED-4 proteã nen activeren of de CED-9 molecules inactiveren. Bij zoogdieren behoren de homologen van het CED-9-eiwit tot de Bcl-2-familie van genen. Deze familie omvat Bcl-2, Bcl-X, en gelijkaardige genen. De functionele overeenkomsten zijn zo sterk dat als een actief menselijk Bcl-2 gen in C. elegans embryo ’s wordt geplaatst, het normaal voorkomende celdood in de nematode embryo’ s voorkomt (Vaux et al. 1992). Bij de ontwikkeling van gewervelde rode bloedcellen (hierboven vermeld), activeert de transcriptiefactor Stat5 die door erytropoëtine wordt geactiveerd door binding aan de promotor van het BCL-X-Gen, waar het de synthese van dat anti-apoptose-eiwit (Socolovsky et al. 1999).
de zoogdierhomoloog van CED-4 wordt Apaf-1 (apoptotische protease activerende factor-1) genoemd en neemt deel aan de cytochroom C-afhankelijke activering van de zoogdierhomologen CED-3, de proteasen caspase-9 en caspase-3 (Shaham and Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). De activering van de caspases veroorzaakt de autodigestie van de cel. Caspases zijn sterke proteasen, en ze verteren de cel van binnenuit. De cellulaire proteã nen worden gespleten en DNA is gefragmenteerd.†
terwijl apoptose-deficiënte nematoden deficiënt voor CED-4 levensvatbaar zijn (ondanks dat ze 15% meer cellen hebben dan wild-type wormen), sterven muizen met functieverlies mutaties voor caspase-3 of caspase-9 rond de geboorte uit massieve celovergroei in het zenuwstelsel (figuur 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Muizen homozygous voor gerichte deleties van Apaf-1 hebben ernstige craniofaciale afwijkingen, hersenen overgroei, en singelbanden tussen hun tenen.
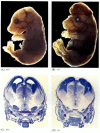
figuur 6.28
verstoring van de normale hersenontwikkeling door blokkering van apoptose. Bij muizen waarbij caspase-9 of Apaf-1 is uitgeschakeld, treedt normale neurale apoptose niet op. Bij caspase 9-deficiënte muizen is de overproliferatie van hersenneuronen duidelijk op een morfologische (meer…)
bij zoogdieren is er meer dan één weg naar apoptosis. De apoptose van de lymfocyten, bijvoorbeeld, wordt niet beà nvloed door de schrapping van Apaf-1 of caspase-9, en werkt door een afzonderlijke weg die door het CD95-eiwit wordt geïnitieerd (Figuur 6.27B, C) verschillende caspasen kunnen functioneren in verschillende celtypen om de apoptotische signalen te bemiddelen (Hakem et al. 1998; Kuida et al. 1998).
WEBSITE
6.7 het gebruik van apoptose. Apoptosis wordt gebruikt voor talrijke processen door ontwikkeling. Deze website onderzoekt de rol van apoptose in verschijnselen als de ontwikkeling van de kiemcellen van Drosophila en de ogen van blinde grotvissen. http://www.devbio.com/chap06/link0607.shtml

kader
cel-Celinteracties en kans bij de bepaling van celtypen.
voetnoten
*
Apoptosis (beide “p”s worden uitgesproken) komt van het Griekse woord voor de natuurlijke processen van bladeren die vallen van bomen of bloemblaadjes van bloemen. Het is actief en kan evolutionair worden geselecteerd. Het andere type van celdood, necrose, is een pathologische dood die door externe factoren zoals ontsteking of toxisch letsel wordt veroorzaakt.
†
er zijn aanwijzingen (zie Barinaga 1998a, b; Saudou et al. 1998) dat de activering van de apoptosisweg in volwassen neuronen van de pathologie van de ziekte van Alzheimer en slag kan de oorzaak zijn. De fragmentatie van DNA is één van de belangrijkste manieren dat apoptosis wordt erkend, en het wordt gezien in gebieden van de hersenen die door deze ziekten worden beà nvloed. De fragmentatie ervan in specifieke stukken (beschermd en bij elkaar gehouden door nucleosomen) kan worden veroorzaakt door de vertering van poly(ADP-ribose) polymerase (PARP) door caspase-3 (Lazebnik et al. 1994). PARP herkent en repareert DNA-breuken. Voor meer informatie over andere wegen die tot apoptosis leiden, zie Green 1998.