«å være, eller ikke å være: det er spørsmålet.»Mens vi alle er klare til liv eller død beslutninger, er denne eksistensielle dikotomi eksepsjonelt sterk for embryonale celler. Programmert celledød, kalt apoptose, * er en normal del av utviklingen. I nematoden c. elegans, der vi kan telle antall celler, dør nøyaktig 131 celler i henhold til det normale utviklingsmønsteret. Alle cellene i denne nematoden er «programmert» til å dø med mindre de blir aktivt fortalt ikke å gjennomgå apoptose. Hos mennesker dør så mange som 1011 celler i hver voksen hver dag og erstattes av andre celler. (Faktisk er massen av celler vi mister hvert år gjennom normal celledød nær hele kroppsvekten vår !) I livmoren lagde vi hele tiden og ødela celler, og vi genererte omtrent tre ganger så mange nevroner som vi til slutt endte med da vi ble født. Lewis Thomas (1992) har treffende bemerket,
Da jeg ble født, hadde flere av meg dødd enn overlevd. Ikke rart jeg ikke husker; i løpet av den tiden gikk jeg gjennom hjernen etter hjernen i ni måneder, endelig contriving en modell som kan være menneske, utstyrt for språk.
Apoptose er nødvendig ikke bare for riktig avstand og orientering av nevroner, Men også for å generere mellomøret, vaginalåpningen Og mellomrommene mellom fingrene Og tærne saunders og Fallon 1966roberts og Miller 1998; Rodriguez et al. 1997. Apoptose svisker bort unødvendige strukturer, styrer antall celler i bestemt vev, og sculpts komplekse organer.
Ulike vev bruker forskjellige signaler for apoptose. Et av signalene som ofte brukes i vertebrater er benmorfogenetisk protein 4 (BMP4). Noen vev, som bindevev, reagerer PÅ BMP4 ved å differensiere i bein. Andre, som frosken gastrula ectoderm, reagerer PÅ BMP4 ved å differensiere i huden. Fortsatt andre, som nevrale kamceller og tann primordia, reagerer ved å forringe DERES DNA og dø. I den utviklende tannen, for eksempel, blir mange vekst-og differensieringsfaktorer utskilt av emaljeknuten. Etter cusp har vokst, emalje knuten syntetiserer BMP4 og slår seg ned ved apoptose (se Kapittel 13; Vaahtokari et al. (1996b).
i andre vev er cellene » programmert «til å dø, og de vil forbli i live bare hvis noen vekst-eller differensieringsfaktor er tilstede for å» redde » dem. Dette skjer under utviklingen av pattedyrs røde blodlegemer. De røde blodcelleforløperne i muselever trenger hormonet erytropoietin for å overleve. Hvis de ikke mottar det, gjennomgår de apoptose. Erytropoietin-reseptoren virker gjennom jak-STAT-banen, og aktiverer stat5 transkripsjonsfaktoren. På denne måten kan mengden erytropoietin tilstede bestemme hvor mange røde blodlegemer som kommer inn i sirkulasjonen.
En av veiene for apoptose ble i stor grad avgrenset gjennom genetiske studier Av C. elegans. Det ble funnet at proteinene kodet av ced-3-og ced-4-genene var essensielle for apoptose, men at i cellene som ikke gjennomgikk apoptose, ble disse genene slått av ved produktet av ced-9-genet (Figur 6.27 A; Hengartner et al. 1992). CED – 4-proteinet er en proteaseaktiverende faktor som aktiverer CED-3, en protease som initierer ødeleggelsen av cellen. Mutasjoner som inaktiverer CED – 9-proteinet forårsaker mange celler som normalt vil overleve for å aktivere sine ced-3-og ced-4-gener og dø. Dette fører til hele embryoens død. Omvendt forårsaker gain-of-function mutasjoner av ced-9 CED – 9 protein å bli laget i celler som ellers ville dø. Dermed ser ced-9-genet ut til å være en binær bryter som regulerer valget mellom liv og død på mobilnivå. Det er mulig at hver celle i nematodeembryoen er klar til å dø, og de cellene som overlever, blir reddet ved aktivering av ced-9-genet.
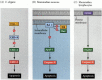
Figur 6.27
apoptoseveier i nematoder og pattedyr. (A) I c. elegans ER CED – 4-proteinet en proteaseaktiverende faktor som kan aktivere CED-3-proteasen. CED – 3 protease initierer celle ødeleggelse hendelser. CED-9 kan hemme CED-4 (OG CED-9 kan bli (mer…)
CED – 3 og CED-4 proteiner danner sentrum av apoptoseveien som er felles for alle dyr som studeres. Utløseren for apoptose kan være en utviklingsmessig cue som et bestemt molekyl (SOM BMP4 eller glukokortikoider) eller tap av adhesjon til en matrise. Enten type cue kan aktivere CED – 3 eller CED-4 proteiner eller inaktivere ced-9 molekyler. I pattedyr er homologene TIL ced-9-proteinet medlemmer av Bcl-2-familien av gener. Denne familien inkluderer Bcl-2,Bcl-X og lignende gener. De funksjonelle likhetene er så sterke at hvis et aktivt humant BCL – 2-gen plasseres I c. elegans-embryoer, forhindrer det normalt forekommende celledød i nematodeembryoene (Vaux et al. 1992). I virveldyr røde blodlegemer utvikling (nevnt ovenfor), stat5 transkripsjonsfaktor aktivert av erytropoietin funksjoner ved binding til promoter Av Bcl – x genet, hvor den aktiverer syntesen av at anti-apoptose protein (Socolovsky et al. 1999).
pattedyrhomologen TIL CED-4 kalles Apaf-1 (apoptotisk proteaseaktiverende faktor-1), og den deltar i cytokrom c-avhengig aktivering av pattedyrhomologene ced-3, proteasene caspase-9 og caspase-3 (Shaham og Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). Aktivering av caspaser forårsaker autodigestion av cellen. Caspaser er sterke proteaser, og de fordøyer cellen fra innsiden. De cellulære proteinene spaltes og DNA er fragmentert.†
mens apoptose-mangelfulle nematoder mangler FOR CED-4 er levedyktige (til tross for at de har 15% flere celler enn villtype ormer), dør mus med tap av funksjon mutasjoner for enten caspase-3 eller caspase-9 rundt fødselen fra massiv celleovervekst i nervesystemet (Figur 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Mus homozygote for målrettede slettinger Av Apaf-1 har alvorlige kraniofaciale abnormiteter, hjerneovervekst og bånd mellom tærne.
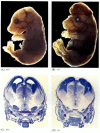
Figur 6.28
Forstyrrelse av normal hjerneutvikling ved å blokkere apoptose. Hos mus der caspase-9 Eller Apaf-1 er slått ut, oppstår ikke normal nevral apoptose. I caspase 9-mangelfulle mus er overproliferasjonen av hjerneneuroner åpenbar på en morfologisk (mer…)
i pattedyr er det mer enn en vei til apoptose. Apoptosen til lymfocyttene påvirkes for eksempel ikke av sletting Av Apaf-1 eller caspase-9, og virker ved en separat vei initiert AV CD95-proteinet(Figur 6 .27B, C) Forskjellige caspaser kan fungere i forskjellige celletyper for å formidle de apoptotiske signalene (Hakem et al. 1998; Kuida et al. 1998).
NETTSTED
6.7 bruken av apoptose. Apoptose brukes til mange prosesser gjennom utvikling. Denne nettsiden utforsker rollen som apoptose i slike fenomener som Drosophila kimcelleutvikling og øynene til blindgrottefisk. http://www.devbio.com/chap06/link0607.shtml
Box
Celle-Celle Interaksjoner og Sjanse I Fastsettelse Av Celletyper.
Fotnoter
*
Apoptose (begge»p» s er uttalt) kommer fra det greske ordet for de naturlige prosessene av blader som faller fra trær eller kronblad fra blomster. Det er aktivt og kan evolusjonært velges. Den andre typen celledød, nekrose, er en patologisk død forårsaket av eksterne faktorer som betennelse eller giftig skade.
†
Det er noen bevis (Se Barinaga 1998a, b; Saudou et al. 1998) at aktivering av apoptoseveien i voksne nevroner kan være ansvarlig for Patologien Til Alzheimers sykdom og slag. Fragmentering AV DNA er en av de viktigste måtene som apoptose er anerkjent, og det er sett i områder av hjernen påvirkes av disse sykdommene. Dens fragmentering i bestemte størrelser (beskyttet og holdt sammen av nukleosomer) kan skyldes fordøyelsen av poly(ADP-ribose) polymerase (PARP) av caspase-3 (Lazebnik et al. 1994). PARP gjenkjenner OG reparerer DNA-brudd. For mer om andre veier som fører til apoptose, Se Grønn 1998.