“To be, or not to be: that is the question.”Enquanto todos estamos preparados para decisões de vida ou morte, esta dicotomia existencial é excepcionalmente stark para células embrionárias. Morte celular programada, chamada apoptose,* é uma parte normal do desenvolvimento. No nematode C. elegans, no qual podemos contar o número de células, exatamente 131 células morrem de acordo com o padrão de desenvolvimento normal. Todas as células deste nemátodo são “programadas” para morrer a menos que elas sejam ativamente instruídas a não passar por apoptose. Em humanos, 1011 células morrem em cada adulto a cada dia e são substituídas por outras células. (De facto, a massa de células que perdemos todos os anos devido à morte normal das células está próxima de todo o nosso peso corporal! Dentro do útero, nós estávamos constantemente fazendo e destruindo células, e nós geramos cerca de três vezes mais neurônios do que nós eventualmente acabamos com quando nascemos. Lewis Thomas (1992) observou apropriadamente,
quando nasci, mais de mim tinha morrido do que sobrevivido. Não admira que não me lembre; durante esse tempo eu passei pelo cérebro após o cérebro por nove meses, finalmente concebendo o único modelo que poderia ser humano, equipado para a linguagem.
Apoptose é necessário não apenas para o espaçamento adequado e orientação dos neurônios, mas também para a geração de ouvido médio espaço, a abertura vaginal, e os espaços entre os nossos dedos e dedos do pé Saunders e Fallon 1966Roberts e Miller, 1998;Rodriguez et al. 1997. Apoptose seca estruturas sem necessidade, controla o número de células em tecidos particulares, e esculpe órgãos complexos.
diferentes tecidos usam sinais diferentes para apoptose. Um dos sinais frequentemente utilizados em vertebrados é a proteína morfogenética óssea 4 (BMP4). Alguns tecidos, como o tecido conjuntivo, respondem ao BMP4 diferenciando-se em osso. Outros, como a gastrula da rà ectoderm, respondem ao BMP4 diferenciando-se em pele. Outros ainda, como células da crista neural e primórdios dentários, respondem degradando seu DNA e morrendo. No dente em desenvolvimento, por exemplo, numerosos fatores de crescimento e diferenciação são segregados pelo nó esmalte. Após a cúspide ter crescido, o nó esmalte sintetiza BMP4 e fecha-se por apoptose (ver Capítulo 13; Vaahtokari et al. 1996b).
em outros tecidos, as células são “programadas” para morrer, e elas permanecerão vivas apenas se algum fator de crescimento ou diferenciação estiver presente para “resgatá-las”. Isto acontece durante o desenvolvimento de células vermelhas do sangue de mamíferos. Os precursores dos glóbulos vermelhos no fígado do rato necessitam da hormona eritropoietina para sobreviver. Se não o receberem, são submetidos a apoptose. O receptor da eritropoietina actua através da via JAK-STAT, activando o factor de transcrição Stat5. Desta forma, a quantidade de eritropoetina presente pode determinar quantos glóbulos vermelhos entram na circulação.
uma das vias para a apoptose foi largamente delineada através de estudos genéticos de C. elegans. Verificou-se que as proteínas codificadas pelos genes ced-3 e ced-4 eram essenciais para a apoptose, mas que nas células que não foram submetidas a apoptose, esses genes foram desligados pelo produto do gene ced-9 (figura 6.27 A; Hengartner et al. 1992). A proteína CED-4 é um fator ativador da protease que ativa o CED-3, uma protease que inicia a destruição da célula. Mutações que inativam a proteína CED-9 causam numerosas células que normalmente sobreviveriam para ativar seus genes ced-3 e ced-4 e morrer. Isto leva à morte de todo o embrião. Inversamente, mutações de ganho de função de ced-9 fazem com que a proteína CED-9 seja feita em células que de outra forma morreriam. Assim, o gene ced-9 parece ser um interruptor binário que regula a escolha entre a vida e a morte no nível celular. É possível que cada célula do embrião de nemátodo esteja prestes a morrer, e as células que sobrevivem são resgatadas pela ativação do gene ced-9.
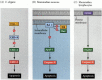
figura 6.27
vias de apoptose em nemátodos e mamíferos. (A) In C. elegans, the CED-4 protein is a protease activating factor that can activate the CED-3 protease. A protease CED-3 inicia os eventos de destruição celular. CED-9 pode inibir CED-4 (e CED-9 pode ser (mais…)
as proteínas CED-3 e CED-4 formam o centro da via da apoptose que é comum a todos os animais estudados. O gatilho para a apoptose pode ser um taco de desenvolvimento, como uma molécula particular (como bmp4 ou glucocorticóides) ou a perda de aderência a uma matriz. Qualquer tipo de cue pode ativar as proteínas CED-3 ou CED-4 ou inativar as moléculas CED-9. Em mamíferos, os homólogos da proteína CED-9 são membros da família Bcl-2 de genes. Esta família inclui genes Bcl-2,Bcl-X e similares. As semelhanças funcionais são tão fortes que se um gene Bcl-2 humano ativo é colocado em embriões C. elegans, ele previne a morte celular normal nos embriões do nemátodo (Vaux et al. 1992). No desenvolvimento dos glóbulos vermelhos em vertebrados (acima mencionado), o factor de transcrição Stat5 activado pelas funções eritropoetina, ligando-se ao promotor do gene Bcl-X, onde activa a síntese dessa proteína anti-apoptose (Socolovsky et al. 1999).
o homólogo de CED-4 em mamíferos é chamado Apaf-1( protease activadora da protease apoptótica factor-1), e participa na activação dependente do citocromo C dos homólogos de CED-3 em mamíferos, das proteases caspase-9 e caspase-3 (SHHAM e Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). A ativação das caspases provoca a autodigestão da célula. As Caspases são proteases fortes, e elas digerem a célula de dentro. As proteínas celulares são clivadas e o DNA está fragmentado.†
embora os nemátodos deficientes em apoptose para a CED-4 sejam viáveis (apesar de terem 15% mais células do que os vermes do tipo selvagem), os ratinhos com mutações de perda de função para a caspase-3 ou caspase-9 morrem à volta do nascimento devido ao crescimento maciço de células no sistema nervoso (figura 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Os ratos homozigóticos para supressões direcionadas do Apaf-1 têm anomalias craniofaciais graves, crescimento cerebral e cintas entre os dedos dos pés.
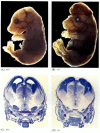
figura 6.28
interrupção do desenvolvimento cerebral normal através do bloqueio da apoptose. Em ratinhos nos quais caspase-9 ou Apaf-1 foram eliminados, a apoptose neural normal não ocorre. Na caspase, ratos deficientes em 9, A sobre-proliferação de neurônios cerebrais é óbvia em uma morfologia (mais…)
em mamíferos, há mais de uma via para a apoptose. A apoptose dos linfócitos, por exemplo, não é afectada pela eliminação do Apaf-1 ou da caspase-9, e funciona por uma via separada iniciada pela proteína CD95 (Figura 6.27B, C) diferentes caspases podem estar funcionando em diferentes tipos de células para mediar os sinais apoptóticos (Hakem et al. 1998; Kuida et al. 1998).
WEBSITE
6.7 the uses of apoptosis. A apoptose é utilizada para vários processos ao longo do desenvolvimento. Este site explora o papel da apoptose em fenômenos como o desenvolvimento de células germinais de Drosophila e os olhos de peixes-caverna cegos. http://www.devbio.com/chap06/link0607.shtml
Box
Cell-Cell Interactions and Chance in the Determination of Cell Types.
notas de rodapé
*
apoptose (ambos”p” S são pronunciados) vem da palavra grega para os processos naturais de folhas caindo de árvores ou pétalas de flores. Ele é ativo e pode ser evolutivamente selecionado. O outro tipo de morte celular, necrose, é uma morte patológica causada por fatores externos, tais como inflamação ou lesão tóxica.
†
existem algumas evidências (ver Barinaga 1998a, b; Saudou et al. 1998) essa ativação da via de apoptose em neurônios adultos pode ser responsável pela patologia da doença de Alzheimer e acidente vascular cerebral. A fragmentação do DNA é uma das principais maneiras que a apoptose é reconhecida, e é vista em regiões do cérebro afetadas por essas doenças. Sua fragmentação em pedaços de tamanho específico(protegidos e mantidos juntos por nucleossomas) pode ser causada pela digestão da Poli (ADP-ribose) polimerase (PARP) pela caspase-3 (Lazebnik et al. 1994). A PARP reconhece e repara quebras de ADN. Para mais informações sobre outras vias conducentes à apoptose, ver Green 1998.