“Essere, o non essere: questa è la domanda.”Mentre siamo tutti pronti a decisioni di vita o di morte, questa dicotomia esistenziale è eccezionalmente dura per le cellule embrionali. La morte cellulare programmata, chiamata apoptosi, * è una parte normale dello sviluppo. Nel nematode C. elegans, in cui possiamo contare il numero di cellule, esattamente 131 cellule muoiono secondo il normale schema di sviluppo. Tutte le cellule di questo nematode sono “programmate” per morire a meno che non venga loro detto attivamente di non sottoporsi all’apoptosi. Negli esseri umani, ben 1011 cellule muoiono in ogni adulto ogni giorno e vengono sostituite da altre cellule. (In effetti, la massa di cellule che perdiamo ogni anno attraverso la normale morte cellulare è vicina a tutto il nostro peso corporeo! All’interno dell’utero, creavamo e distruggevamo costantemente cellule, e generavamo circa tre volte più neuroni di quanti ne avevamo alla fine quando eravamo nati. Lewis Thomas (1992) ha giustamente notato,
Quando sono nato, più di me era morto che sopravvissuto. Non c’era da meravigliarsi che non riesco a ricordare; durante quel periodo ho attraversato cervello dopo cervello per nove mesi, finalmente escogitando l’unico modello che potrebbe essere umano, attrezzato per il linguaggio.
L’apoptosi è necessaria non solo per la corretta spaziatura e orientamento dei neuroni, ma anche per generare lo spazio dell’orecchio medio, l’apertura vaginale e gli spazi tra le dita delle mani e dei piedi Saunders e Fallon 1966Roberts e Miller 1998;Rodriguez et al. 1997. L’apoptosi elimina le strutture non necessarie, controlla il numero di cellule in particolari tessuti e scolpisce organi complessi.
Diversi tessuti utilizzano segnali diversi per l’apoptosi. Uno dei segnali spesso utilizzati nei vertebrati è la proteina morfogenetica ossea 4 (BMP4). Alcuni tessuti, come il tessuto connettivo, rispondono alla BMP4 differenziandosi in osso. Altri, come la rana gastrula ectoderma, rispondono al BMP4 differenziando in pelle. Altri ancora, come le cellule della cresta neurale e le primordie dei denti, rispondono degradando il loro DNA e morendo. Nel dente in via di sviluppo, ad esempio, numerosi fattori di crescita e differenziazione sono secreti dal nodo dello smalto. Dopo che la cuspide è cresciuta, il nodo dello smalto sintetizza BMP4 e si chiude per apoptosi (vedi Capitolo 13; Vaahtokari et al. 1996b).
In altri tessuti, le cellule sono” programmate “per morire e rimarranno in vita solo se è presente un fattore di crescita o differenziazione per” salvarle”. Questo accade durante lo sviluppo dei globuli rossi dei mammiferi. I precursori dei globuli rossi nel fegato di topo hanno bisogno dell’ormone eritropoietina per sopravvivere. Se non lo ricevono, subiscono l’apoptosi. Il recettore dell’eritropoietina funziona attraverso la via JAK-STAT, attivando il fattore di trascrizione Stat5. In questo modo, la quantità di eritropoietina presente può determinare quanti globuli rossi entrano nella circolazione.
Uno dei percorsi per l’apoptosi è stato in gran parte delineato attraverso studi genetici di C. elegans. Si è scoperto che le proteine codificate dai geni ced-3 e ced-4 erano essenziali per l’apoptosi, ma che nelle cellule che non subivano l’apoptosi, quei geni erano disattivati dal prodotto del gene ced – 9 (Figura 6.27 A; Hengartner et al. 1992). La proteina CED-4 è un fattore di attivazione della proteasi che attiva CED-3, una proteasi che inizia la distruzione della cellula. Le mutazioni che inattivano la proteina CED – 9 causano numerose cellule che normalmente sopravviverebbero per attivare i loro geni ced-3 e ced-4 e morire. Questo porta alla morte dell’intero embrione. Al contrario, le mutazioni del guadagno di funzione di ced-9 causano la produzione di proteine CED-9 in cellule che altrimenti morirebbero. Pertanto, il gene ced-9 sembra essere un interruttore binario che regola la scelta tra vita e morte a livello cellulare. È possibile che ogni cellula dell’embrione nematode sia pronta a morire e che quelle cellule che sopravvivono vengano salvate dall’attivazione del gene ced-9.
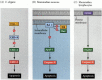
Figura 6.27
Vie di apoptosi nei nematodi e nei mammiferi. (A) In C. elegans, la proteina CED-4 è un fattore di attivazione della proteasi che può attivare la proteasi CED-3. La proteasi CED-3 avvia gli eventi di distruzione cellulare. CED-9 può inibire CED-4 (e CED-9 può essere (più…)
Le proteine CED – 3 e CED – 4 formano il centro della via dell’apoptosi comune a tutti gli animali studiati. L’innesco per l’apoptosi può essere un segnale di sviluppo come una particolare molecola (come BMP4 o glucocorticoidi) o la perdita di adesione a una matrice. Entrambi i tipi di cue possono attivare le proteine CED-3 o CED-4 o inattivare le molecole CED-9. Nei mammiferi, gli omologhi della proteina CED-9 sono membri della famiglia di geni Bcl-2. Questa famiglia include Bcl-2, Bcl-X e geni simili. Le somiglianze funzionali sono così forti che se un gene BCL-2 umano attivo viene inserito negli embrioni di C. elegans, impedisce che si verifichino normalmente morti cellulari negli embrioni di nematodi (Vaux et al. 1992). Nello sviluppo dei globuli rossi vertebrati (menzionato sopra), il fattore di trascrizione Stat5 attivato dall’eritropoietina funziona legandosi al promotore del gene Bcl-X, dove attiva la sintesi di quella proteina anti-apoptosi (Socolovsky et al. 1999).
L’omologo mammifero di CED-4 è chiamato Apaf-1 (fattore di attivazione della proteasi apoptotica-1) e partecipa all’attivazione citocromo c-dipendente degli omologhi CED-3 dei mammiferi, le proteasi caspasi-9 e caspasi-3 (Shaham e Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). L’attivazione delle caspasi causa l’autodigestione della cellula. Le caspasi sono forti proteasi e digeriscono la cellula dall’interno. Le proteine cellulari sono scisse e il DNA è frammentato.†
Mentre i nematodi carenti di apoptosi per CED-4 sono vitali (nonostante abbiano il 15% in più di cellule rispetto ai vermi selvatici), i topi con mutazioni di perdita di funzione per caspasi-3 o caspasi-9 muoiono intorno alla nascita dalla massiccia crescita eccessiva delle cellule nel sistema nervoso (Figura 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). I topi omozigoti per eliminazioni mirate di Apaf-1 hanno gravi anomalie craniofacciali, crescita eccessiva del cervello e tessitura tra le dita dei piedi.
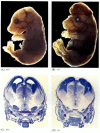
Figura 6.28
Interruzione del normale sviluppo cerebrale bloccando l’apoptosi. Nei topi in cui caspasi – 9 o Apaf-1 è stato eliminato, l’apoptosi neurale normale non si verifica. In caspase 9-i topi carenti, la iperproliferazione di neuroni cerebrali è ovvia su un morfologico (più…)
Nei mammiferi, c’è più di una via per l’apoptosi. L’apoptosi dei linfociti, per esempio, non è influenzata dalla delezione di Apaf-1 o caspasi-9, e funziona da una via separata iniziata dalla proteina CD95 (Figura 6.27B, C) Diverse caspasi possono funzionare in diversi tipi di cellule per mediare i segnali apoptotici (Hakem et al. 1998; Kuida et al. 1998).
SITO WEB
6.7 Gli usi dell’apoptosi. L’apoptosi viene utilizzata per numerosi processi durante lo sviluppo. Questo sito web esplora il ruolo dell’apoptosi in fenomeni come lo sviluppo delle cellule germinali della drosophila e gli occhi dei pesci ciechi delle caverne. http://www.devbio.com/chap06/link0607.shtml
Box
Interazioni cellula-cellula e possibilità nella determinazione dei tipi cellulari.
Note in calce
*
L’apoptosi (entrambe le”p” sono pronunciate) deriva dalla parola greca per i processi naturali delle foglie che cadono dagli alberi o dai petali dei fiori. È attivo e può essere selezionato evolutivamente. L’altro tipo di morte cellulare, la necrosi, è una morte patologica causata da fattori esterni come infiammazione o lesioni tossiche.
†
Ci sono alcune prove (vedi Barinaga 1998a, b; Saudou et al. 1998) che l’attivazione della via dell’apoptosi nei neuroni adulti può essere responsabile della patologia della malattia di Alzheimer e dell’ictus. La frammentazione del DNA è uno dei principali modi in cui viene riconosciuta l’apoptosi e si vede nelle regioni del cervello colpite da queste malattie. La sua frammentazione in pezzi di dimensioni specifiche (protetti e tenuti insieme dai nucleosomi) può essere causata dalla digestione della poli(ADP-ribosio) polimerasi (PARP) da caspasi-3 (Lazebnik et al. 1994). PARP riconosce e ripara le rotture del DNA. Per ulteriori informazioni su altri percorsi che portano all’apoptosi, vedere Green 1998.