„Sein oder nicht sein: das ist die Frage.“ Während wir alle vor Entscheidungen über Leben oder Tod stehen, ist diese existenzielle Dichotomie für embryonale Zellen außergewöhnlich stark. Der programmierte Zelltod, Apoptose genannt, * ist ein normaler Teil der Entwicklung. Im Nematoden C. elegans, in dem wir die Anzahl der Zellen zählen können, sterben genau 131 Zellen nach dem normalen Entwicklungsmuster. Alle Zellen dieses Nematoden sind „programmiert“ zu sterben, es sei denn, sie werden aktiv angewiesen, sich keiner Apoptose zu unterziehen. Beim Menschen sterben bis zu 1011 Zellen in jedem Erwachsenen jeden Tag und werden durch andere Zellen ersetzt. (In der Tat ist die Masse der Zellen, die wir jedes Jahr durch normalen Zelltod verlieren, nahe an unserem gesamten Körpergewicht! Innerhalb der Gebärmutter produzierten und zerstörten wir ständig Zellen, und wir erzeugten ungefähr dreimal so viele Neuronen, wie wir schließlich hatten, als wir geboren wurden. Lewis Thomas (1992) hat treffend bemerkt,
Als ich geboren wurde, waren mehr von mir gestorben als überlebt. Kein Wunder, dass ich mich nicht erinnern kann; während dieser Zeit ging ich neun Monate lang Gehirn für Gehirn durch und erfand schließlich das eine Modell, das menschlich sein könnte, ausgestattet für Sprache.
Apoptose ist nicht nur für den richtigen Abstand und die richtige Ausrichtung der Neuronen notwendig, sondern auch für die Erzeugung des Mittelohrraums, der Vaginalöffnung und der Räume zwischen unseren Fingern und Zehen Saunders und Fallon 1966Roberts und Miller 1998;Rodriguez et al. 1997. Apoptose entfernt unnötige Strukturen, kontrolliert die Anzahl der Zellen in bestimmten Geweben und formt komplexe Organe.
Verschiedene Gewebe verwenden unterschiedliche Signale für die Apoptose. Eines der bei Wirbeltieren häufig verwendeten Signale ist das knochenmorphogenetische Protein 4 (BMP4). Einige Gewebe, wie Bindegewebe, reagieren auf BMP4, indem sie sich in Knochen differenzieren. Andere, wie der Frosch Gastrula Ektoderm, reagieren auf BMP4 durch Differenzierung in die Haut. Wieder andere, wie Neuralleistenzellen und Zahnprimordien, reagieren, indem sie ihre DNA abbauen und sterben. Im sich entwickelnden Zahn werden beispielsweise zahlreiche Wachstums- und Differenzierungsfaktoren durch den Schmelzknoten sezerniert. Nachdem der Höcker gewachsen ist, synthetisiert der Schmelzknoten BMP4 und schaltet sich durch Apoptose ab (siehe Kapitel 13; Vaahtokari et al. 1996b).
In anderen Geweben sind die Zellen zum Absterben „programmiert“, und sie bleiben nur dann am Leben, wenn ein Wachstums- oder Differenzierungsfaktor vorhanden ist, um sie zu „retten“. Dies geschieht während der Entwicklung von roten Blutkörperchen von Säugetieren. Die Vorläufer der roten Blutkörperchen in der Mausleber benötigen das Hormon Erythropoetin, um zu überleben. Wenn sie es nicht erhalten, erleiden sie Apoptose. Der Erythropoietinrezeptor arbeitet über den JAK-STAT-Signalweg und aktiviert den Stat5-Transkriptionsfaktor. Auf diese Weise kann die Menge an vorhandenem Erythropoetin bestimmen, wie viele rote Blutkörperchen in den Kreislauf gelangen.
Einer der Wege für Apoptose wurde weitgehend durch genetische Studien von C. elegans abgegrenzt. Es wurde festgestellt, dass die von den ced-3- und ced-4-Genen kodierten Proteine für die Apoptose essentiell waren, dass jedoch in den Zellen, die keiner Apoptose unterzogen wurden, diese Gene durch das Produkt des ced-9-Gens ausgeschaltet wurden (Abbildung 6.27A; Hengartner et al. 1992). Das CED-4-Protein ist ein Protease-Aktivierungsfaktor, der CED-3 aktiviert, eine Protease, die die Zerstörung der Zelle initiiert. Mutationen, die das CED-9-Protein inaktivieren, führen dazu, dass zahlreiche Zellen, die normalerweise überleben würden, ihre ced-3- und ced-4-Gene aktivieren und sterben. Dies führt zum Tod des gesamten Embryos. Umgekehrt bewirken Gain-of-Function-Mutationen von ced-9, dass CED-9-Protein in Zellen gebildet wird, die sonst absterben würden. Somit scheint das ced-9-Gen ein binärer Schalter zu sein, der die Wahl zwischen Leben und Tod auf zellulärer Ebene reguliert. Es ist möglich, dass jede Zelle im Nematodenembryo kurz vor dem Tod steht und die Zellen, die überleben, durch die Aktivierung des ced-9-Gens gerettet werden.
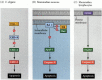
Abbildung 6.27
Apoptosepfade bei Nematoden und Säugetieren. (A) In C. elegans ist das CED-4-Protein ein Protease-aktivierender Faktor, der die CED-3-Protease aktivieren kann. Die CED-3-Protease initiiert die Zellzerstörung. CED-9 kann CED-4 hemmen (und CED-9 kann (mehr…)
Die Proteine CED-3 und CED-4 bilden das Zentrum des Apoptose-Signalwegs, der allen untersuchten Tieren gemeinsam ist. Der Auslöser für Apoptose kann ein Entwicklungshinweis wie ein bestimmtes Molekül (wie BMP4 oder Glukokortikoide) oder der Verlust der Adhäsion an eine Matrix sein. Jede Art von Cue kann die CED-3- oder CED-4-Proteine aktivieren oder die CED-9-Moleküle inaktivieren. Bei Säugetieren sind die Homologen des CED-9-Proteins Mitglieder der Bcl-2-Genfamilie. Diese Familie umfasst Bcl-2, Bcl-X und ähnliche Gene. Die funktionellen Ähnlichkeiten sind so stark, dass, wenn ein aktives menschliches BCL-2-Gen in C. elegans-Embryonen platziert wird, es normalerweise auftretende Zelltote in den Nematodenembryonen verhindert (Vaux et al. 1992). Bei der Entwicklung roter Blutkörperchen von Wirbeltieren (oben erwähnt) bindet der durch Erythropoetin aktivierte Stat5-Transkriptionsfaktor an den Promotor des Bcl-X-Gens, wo er die Synthese dieses Anti-Apoptose-Proteins aktiviert (Socolovsky et al. 1999).
Das Säugetierhomolog von CED-4 heißt Apaf-1 (apoptotic protease activating factor-1) und beteiligt sich an der Cytochrom c-abhängigen Aktivierung der Säugetier-CED-3-Homologe, der Proteasen Caspase-9 und Caspase-3 (Shaham und Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). Die Aktivierung der Caspasen bewirkt die Autoverdauung der Zelle. Caspasen sind starke Proteasen und verdauen die Zelle von innen. Die zellulären Proteine werden gespalten und die DNA fragmentiert.†
Während Apoptose-defiziente Nematoden, die für CED-4 defizient sind, lebensfähig sind (obwohl sie 15% mehr Zellen als Wildtyp-Würmer haben), sterben Mäuse mit Funktionsverlustmutationen für Caspase-3 oder Caspase-9 um die Geburt an massivem Zellwachstum im Nervensystem (Abbildung 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Mäuse, die homozygot für gezielte Deletionen von Apaf-1 sind, haben schwere kraniofaziale Anomalien, Überwachsen des Gehirns und Gurtband zwischen ihren Zehen.
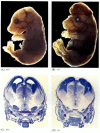
Abbildung 6.28
Störung der normalen Gehirnentwicklung durch Blockierung der Apoptose. Bei Mäusen, bei denen Caspase-9 oder Apaf-1 ausgeschaltet wurde, tritt keine normale neurale Apoptose auf. In Caspase-9-defizienten Mäusen ist die Überproliferation von Gehirnneuronen auf morphologischer (mehr…)
Bei Säugetieren gibt es mehr als einen Weg zur Apoptose. Die Apoptose der Lymphozyten wird beispielsweise nicht durch die Deletion von Apaf-1 oder Caspase-9 beeinflusst und funktioniert über einen separaten Weg, der vom CD95-Protein initiiert wird (Abbildung 6.27B, C) Verschiedene Caspasen können in verschiedenen Zelltypen funktionieren, um die apoptotischen Signale zu vermitteln (Hakem et al. 1998; Kuida et al. 1998).
WEBSEITE
6.7 Die Verwendung von Apoptose. Apoptose wird für zahlreiche Prozesse während der Entwicklung verwendet. Diese Website untersucht die Rolle der Apoptose bei Phänomenen wie der Entwicklung von Drosophila-Keimzellen und den Augen blinder Höhlenfische. http://www.devbio.com/chap06/link0607.shtml
Box
Zell-Zell-Interaktionen und Zufall bei der Bestimmung von Zelltypen.
Fußnoten
*
Apoptose (beide „p“ s werden ausgesprochen) kommt vom griechischen Wort für die natürlichen Prozesse von Blättern, die von Bäumen oder Blütenblättern von Blumen fallen. Es ist aktiv und kann evolutionär selektiert werden. Die andere Art des Zelltods, Nekrose, ist ein pathologischer Tod, der durch äußere Faktoren wie Entzündungen oder toxische Verletzungen verursacht wird.
†
Es gibt einige Hinweise (siehe Barinaga 1998a, b; Saudou et al. 1998), dass die Aktivierung des Apoptoseweges in adulten Neuronen für die Pathologie der Alzheimer-Krankheit und des Schlaganfalls verantwortlich sein könnte. Fragmentierung der DNA ist eine der wichtigsten Möglichkeiten, dass Apoptose erkannt wird, und es ist in Regionen des Gehirns von diesen Krankheiten betroffen gesehen. Seine Fragmentierung in spezifisch große Stücke (geschützt und zusammengehalten durch Nukleosomen) kann durch den Aufschluss von Poly (ADP-Ribose) Polymerase (PARP) durch Caspase-3 verursacht werden (Lazebnik et al. 1994). PARP erkennt und repariert DNA-Brüche. Weitere Informationen zu anderen Wegen, die zur Apoptose führen, finden Sie unter Green 1998.