» Ser o no ser: esa es la pregunta.»Si bien todos estamos preparados para tomar decisiones de vida o muerte, esta dicotomía existencial es excepcionalmente dura para las células embrionarias. La muerte celular programada, llamada apoptosis, * es una parte normal del desarrollo. En el nematodo C. elegans, en el que podemos contar el número de células, mueren exactamente 131 células de acuerdo con el patrón de desarrollo normal. Todas las células de este nematodo están «programadas» para morir a menos que se les diga activamente que no sufran apoptosis. En los seres humanos, hasta 1011 células mueren en cada adulto cada día y son reemplazadas por otras células. (¡De hecho, la masa de células que perdemos cada año a través de la muerte celular normal está cerca de todo nuestro peso corporal! Dentro del útero, estábamos constantemente creando y destruyendo células, y generamos alrededor de tres veces más neuronas de las que finalmente terminamos cuando nacimos. Lewis Thomas (1992) ha señalado acertadamente,
Para cuando nací, más de mí había muerto que sobrevivido. No es de extrañar que no pueda recordar; durante ese tiempo pasé por cerebro tras cerebro durante nueve meses, finalmente inventando el único modelo que podría ser humano, equipado para el lenguaje.
La apoptosis es necesaria no solo para el espaciado y la orientación adecuados de las neuronas, sino también para generar el espacio del oído medio, la abertura vaginal y los espacios entre los dedos de las manos y de los pies Saunders y Fallon 1966Roberts y Miller 1998;Rodriguez et al. 1997. La apoptosis poda estructuras innecesarias, controla el número de células en tejidos particulares y esculpe órganos complejos.
Diferentes tejidos utilizan señales diferentes para la apoptosis. Una de las señales utilizadas a menudo en los vertebrados es la proteína morfogenética ósea 4 (BMP4). Algunos tejidos, como el tejido conectivo, responden a la BMP4 diferenciándose en hueso. Otros, como el ectodermo gastrula de rana, responden a la BMP4 diferenciándose en la piel. Otras, como las células de la cresta neural y los primordios dentales, responden degradando su ADN y muriendo. En el diente en desarrollo, por ejemplo, numerosos factores de crecimiento y diferenciación son secretados por el nudo del esmalte. Después de que la cúspide ha crecido, el nudo de esmalte sintetiza BMP4 y se cierra por apoptosis (ver Capítulo 13; Vaahtokari et al. 1996b).
En otros tejidos, las células están » programadas «para morir, y solo permanecerán vivas si existe algún factor de crecimiento o diferenciación para» rescatarlas». Esto ocurre durante el desarrollo de glóbulos rojos de mamíferos. Los precursores de glóbulos rojos en el hígado de ratón necesitan la hormona eritropoyetina para sobrevivir. Si no lo reciben, se someten a apoptosis. El receptor de eritropoyetina actúa a través de la vía JAK-STAT, activando el factor de transcripción Stat5. De esta manera, la cantidad de eritropoyetina presente puede determinar cuántos glóbulos rojos entran en la circulación.
Una de las vías de apoptosis se delineó en gran medida a través de estudios genéticos de C. elegans. Se encontró que las proteínas codificadas por los genes ced-3 y ced-4 eran esenciales para la apoptosis, pero que en las células que no sufrieron apoptosis, esos genes se desactivaron por el producto del gen ced-9 (Figura 6.27 A; Hengartner et al. 1992). La proteína CED-4 es un factor activador de la proteasa que activa la CED-3, una proteasa que inicia la destrucción de la célula. Las mutaciones que inactivan la proteína CED-9 causan numerosas células que normalmente sobrevivirían para activar sus genes ced-3 y ced-4 y morir. Esto conduce a la muerte de todo el embrión. Por el contrario, las mutaciones de ganancia de función de ced-9 hacen que la proteína CED-9 se produzca en células que de otro modo morirían. Por lo tanto, el gen ced-9 parece ser un interruptor binario que regula la elección entre la vida y la muerte a nivel celular. Es posible que cada célula del embrión de nematodo esté a punto de morir, y que las células que sobreviven sean rescatadas por la activación del gen ced-9.
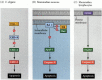
Figura 6.27
Vías de apoptosis en nematodos y mamíferos. (A) En C. elegans, la proteína CED-4 es un factor activador de la proteasa que puede activar la proteasa CED-3. La proteasa CED-3 inicia los eventos de destrucción celular. CED-9 puede inhibir CED-4 (y CED-9 puede ser (más…)
Las proteínas CED-3 y CED-4 forman el centro de la vía de apoptosis que es común a todos los animales estudiados. El desencadenante de la apoptosis puede ser una señal de desarrollo, como una molécula en particular (como BMP4 o glucocorticoides) o la pérdida de adhesión a una matriz. Cualquier tipo de cue puede activar las proteínas CED-3 o CED-4 o inactivar las moléculas CED-9. En los mamíferos, los homólogos de la proteína CED-9 son miembros de la familia de genes Bcl-2. Esta familia incluye Bcl-2, Bcl-X y genes similares. Las similitudes funcionales son tan fuertes que si se coloca un gen BCL-2 humano activo en los embriones de C. elegans, previene las muertes celulares que ocurren normalmente en los embriones de nematodos (Vaux et al. 1992). En el desarrollo de glóbulos rojos de vertebrados (mencionado anteriormente), el factor de transcripción Stat5 activado por eritropoyetina funciona al unirse al promotor del gen Bcl-X, donde activa la síntesis de esa proteína antiapoptosis (Socolovsky et al. 1999).
El homólogo mamífero del CED-4 se llama Apaf-1 (factor activador de la proteasa apoptótica-1), y participa en la activación dependiente del citocromo c de los homólogos mamíferos del CED-3, las proteasas caspasa-9 y caspasa-3 (Shaham y Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). La activación de las caspasas provoca la autodigestión de la célula. Las caspasas son proteasas fuertes, y digieren la célula desde dentro. Las proteínas celulares se rompen y el ADN se fragmenta.†
Mientras que los nematodos deficientes en apoptosis deficientes para CED-4 son viables (a pesar de tener un 15% más de células que los gusanos silvestres), los ratones con mutaciones de pérdida de función para caspasa-3 o caspasa-9 mueren alrededor del nacimiento a causa de un crecimiento masivo de células en el sistema nervioso (Figura 6.28; Kuida et al. 1996, 1998; Jacobson et al. 1997). Los ratones homocigotos para deleciones específicas de Apaf-1 tienen anomalías craneofaciales graves, crecimiento excesivo del cerebro y correas entre los dedos de los pies.
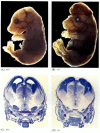
Figura 6.28
Interrupción del desarrollo normal del cerebro mediante el bloqueo de la apoptosis. En ratones en los que la caspasa-9 o Apaf-1 ha sido eliminada, la apoptosis neural normal no ocurre. En ratones con deficiencia de caspasa 9, la sobre proliferación de neuronas cerebrales es obvia en una morfología (más…)
En los mamíferos, hay más de una vía hacia la apoptosis. La apoptosis de los linfocitos, por ejemplo, no se ve afectada por la deleción de Apaf-1 o caspasa-9, y funciona por una vía separada iniciada por la proteína CD95 (Figura 6.27B, C) Diferentes caspasas pueden estar funcionando en diferentes tipos celulares para mediar las señales apoptóticas (Hakem et al. 1998; Kuida et al. 1998).
SITIO WEB
6.7 Los usos de la apoptosis. La apoptosis se utiliza para numerosos procesos a lo largo del desarrollo. Este sitio web explora el papel de la apoptosis en fenómenos como el desarrollo de células germinales de Drosophila y los ojos de los peces ciegos de las cavernas. http://www.devbio.com/chap06/link0607.shtml
Caja
Interacciones Célula-Célula y Probabilidad en la Determinación de Tipos de Células.
Notas de Pie de Página
*
Apoptosis (ambas»p» se pronuncian) proviene de la palabra griega para los procesos naturales de caída de hojas de árboles o pétalos de flores. Es activo y puede ser seleccionado evolutivamente. El otro tipo de muerte celular, la necrosis, es una muerte patológica causada por factores externos como inflamación o lesión tóxica.
†
Hay algunas pruebas (véase Barinaga 1998a, b; Saudou et al. 1998) que la activación de la vía de apoptosis en neuronas adultas puede ser responsable de la patología de la enfermedad de Alzheimer y el accidente cerebrovascular. La fragmentación del ADN es una de las principales formas en que se reconoce la apoptosis, y se observa en regiones del cerebro afectadas por estas enfermedades. Su fragmentación en piezas de tamaño específico (protegidas y unidas por nucleosomas) puede ser causada por la digestión de la poli(ADP-ribosa) polimerasa (PARP) por caspasa-3 (Lazebnik et al. 1994). PARP reconoce y repara roturas de ADN. Para más información sobre otras vías que conducen a la apoptosis, ver Green 1998.