“lenni vagy nem lenni: ez a kérdés.”Bár mindannyian készen állunk az élet-halál döntésére, ez az egzisztenciális kettősség kivételesen éles az embrionális sejtek számára. A programozott sejthalál, az úgynevezett apoptózis* a fejlődés normális része. A C. elegans fonálféregben, amelyben megszámolhatjuk a sejtek számát, pontosan 131 sejt hal meg a normál fejlődési minta szerint. Ennek a fonálféregnek az összes sejtje “be van programozva”, hogy meghaljon, kivéve, ha aktívan azt mondják nekik, hogy ne essenek át apoptózison. Az emberekben naponta 1011 sejt hal meg minden felnőttben, és ezeket más sejtek helyettesítik. (Valójában a sejtek tömege, amelyet évente elveszítünk a normális sejthalál miatt, közel áll a teljes testtömegünkhöz! A méhben folyamatosan sejteket hoztunk létre és pusztítottunk el, és körülbelül háromszor annyi idegsejtet hoztunk létre, mint amennyi végül a születésünkkor keletkezett. Lewis Thomas (1992) találóan megjegyezte,
mire megszülettem, többen haltak meg, mint amennyien túlélték. Nem csoda, hogy nem emlékszem; ez idő alatt kilenc hónapig agyról agyra jártam, végül kitaláltam az egyetlen modellt, amely emberi lehet, felszerelve a nyelvhez.
az apoptózis nemcsak a neuronok megfelelő távolságához és orientációjához szükséges, hanem a középfül tér, a hüvelynyílás és az ujjak és lábujjak közötti terek létrehozásához is Saunders és Fallon 1966roberts and Miller 1998;Rodriguez et al. 1997. Az apoptózis eltünteti a felesleges struktúrákat, szabályozza a sejtek számát bizonyos szövetekben, és összetett szerveket formál.
a különböző szövetek különböző jeleket használnak az apoptózishoz. A gerinceseknél gyakran használt jelek egyike a csont morfogenetikus fehérje 4 (BMP4). Egyes szövetek, például a kötőszövet, a BMP4-re úgy reagálnak, hogy csontokká differenciálódnak. Mások, például a béka gastrula ectoderma, a BMP4-re úgy reagálnak, hogy bőrré differenciálódnak. Megint mások, mint például a neurális címer sejtek és a fogak primordia, válaszolnak a DNS lebontásával és a haldoklással. A fejlődő fogban például számos növekedési és differenciálódási tényezőt választ ki a zománccsomó. Miután a csúcs nőtt, a zománccsomó szintetizálja a BMP4 – et, és apoptózissal leállítja magát (lásd a 13.fejezetet; Vaahtokari et al. 1996b).
más szövetekben a sejteket “beprogramozták”, hogy elpusztuljanak, és csak akkor maradnak életben, ha valamilyen növekedési vagy differenciálódási tényező van jelen, hogy “megmentse” őket. Ez az emlős vörösvérsejtek fejlődése során történik. Az egérmáj vörösvérsejt-prekurzorainak a túléléshez szükségük van az eritropoetin hormonra. Ha nem kapják meg, apoptózison mennek keresztül. Az eritropoetin receptor a JAK-STAT útvonalon keresztül működik, aktiválva a Stat5 transzkripciós faktort. Ily módon a jelen lévő eritropoietin mennyisége meghatározhatja, hogy hány vörösvértest kerül a keringésbe.
az apoptózis egyik útját nagyrészt a C. elegans genetikai tanulmányai határozták meg. Megállapították, hogy a CED-3 és ced-4 gének által kódolt fehérjék nélkülözhetetlenek az apoptózishoz, de azokban a sejtekben, amelyek nem estek át apoptózison, ezeket a géneket a ced-9 gén terméke kikapcsolta (6.27 a ábra; Hengartner et al. 1992). A CED-4 fehérje egy proteáz aktiváló faktor, amely aktiválja a CED-3-at, egy proteázt, amely elindítja a sejt pusztulását. A CED-9 fehérjét inaktiváló mutációk számos sejtet okoznak, amelyek normális esetben túlélnék a ced-3 és ced-4 gének aktiválását és elpusztulását. Ez az egész embrió halálához vezet. Ezzel szemben a CED-9 funkciónyerési mutációi miatt a CED-9 fehérje olyan sejtekben termelődik, amelyek egyébként meghalnának. Így a ced – 9 gén úgy tűnik, hogy egy bináris kapcsoló, amely szabályozza a választást az élet és a halál között a sejtek szintjén. Lehetséges, hogy a fonálféreg embrió minden sejtje elpusztul, és a túlélő sejteket a ced-9 gén aktiválása menti meg.
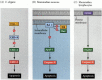
6.27.ábra
apoptózis utak fonálférgekben és emlősökben. (A) A C. elegans-ban a CED-4 fehérje egy proteáz aktiváló faktor, amely aktiválhatja a CED-3 proteázt. A CED – 3 proteáz elindítja a sejtpusztító eseményeket. A CED-9 gátolhatja a CED-4-et (és a CED-9 lehet (több…)
a CED-3 és CED-4 fehérjék képezik az apoptózis útvonalának központját, amely minden vizsgált állat esetében közös. Az apoptózis kiváltója lehet egy fejlődési jel, például egy adott molekula (például BMP4 vagy glükokortikoidok) vagy a mátrixhoz való tapadás elvesztése. Bármelyik típusú cue aktiválhatja a CED-3 vagy CED-4 fehérjéket, vagy inaktiválhatja a CED-9 molekulákat. Emlősökben a CED-9 fehérje homológjai a Bcl-2 géncsalád tagjai. Ez a család magában foglalja a Bcl-2, Bcl-X és hasonló géneket. A funkcionális hasonlóságok olyan erősek, hogy ha egy aktív humán BCL-2 gént helyeznek a C. elegans embriókba, megakadályozza a fonálféreg embriókban a normálisan előforduló sejthalálokat (Vaux et al. 1992). A gerinces vörösvértestek fejlődésében (fent említettük) az eritropoietin által aktivált Stat5 transzkripciós faktor úgy működik, hogy kötődik a BCL-X gén promoteréhez, ahol aktiválja az anti-apoptózis fehérje szintézisét (Socolovsky et al. 1999).
a CED-4 emlős homológját Apaf-1-nek (apoptotikus proteáz aktiváló faktor-1) nevezik, és részt vesz az emlős CED-3 homológok, a kaszpáz-9 és a kaszpáz-3 proteázok citokróm C-függő aktiválásában (Shaham and Horvitz 1996; Cecconi et al. 1998; Yoshida et al. 1998). A kaszpázok aktiválása a sejt automatikus emésztését okozza. A kaszpázok erős proteázok, amelyek belülről emésztik a sejtet. A sejtfehérjék hasadnak, a DNS pedig fragmentálódik.6902>
míg a CED-4 esetében az apoptózis-hiányos fonálférgek életképesek (annak ellenére, hogy 15%-kal több sejtjük van, mint a vad típusú férgeknek), a kaszpáz-3 vagy kaszpáz-9 funkcióvesztéses mutációival rendelkező egerek születésük körül meghalnak az idegrendszer hatalmas sejtnövekedése miatt (6.28.ábra; Kuida et al. 1996, 1998; Jacobson et al. 1997). Az Apaf-1 célzott törlésére homozigóta egereknek súlyos craniofacialis rendellenességei vannak, az agy túlnövekedése és a lábujjak közötti heveder.
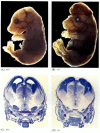
6.28 ábra
az agy normális fejlődésének megzavarása az apoptózis blokkolásával. Egerekben, amelyekben a kaszpáz-9 vagy az Apaf-1 kiütésre került, a normál idegi apoptózis nem fordul elő. A kaszpáz 9-hiányos egerekben az agyi neuronok túlproliferációja nyilvánvaló morfológiai (több…)
emlősökben az apoptózisnak több útja is van. A lymphocyták apoptózisát például nem befolyásolja az Apaf-1 vagy kaszpáz-9 deléciója, és a CD95 fehérje által elindított külön útvonalon működik (6.ábra.27B, C) különböző kaszpázok működhetnek különböző sejttípusokban az apoptotikus jelek közvetítésére (Hakem et al. 1998; Kuida et al. 1998).
weboldal
6.7 az apoptózis felhasználása. Az apoptózist számos folyamatban használják a fejlődés során. Ez a weboldal az apoptózis szerepét vizsgálja olyan jelenségekben, mint a Drosophila csírasejtek fejlődése és a vak barlangi halak szeme. http://www.devbio.com/chap06/link0607.shtml
doboz
sejt-sejt kölcsönhatások és esély a sejttípusok meghatározásában.
lábjegyzetek
*
az apoptózis (mindkét ” p ” – t kiejtik) a görög szóból származik, amely a fákról vagy a virágokból származó szirmokból származó levelek természetes folyamatait jelenti. Aktív és evolúciósan választható. A sejthalál másik típusa, a nekrózis olyan kóros halál, amelyet külső tényezők, például gyulladás vagy toxikus sérülés okoznak.
†
van néhány bizonyíték (lásd Barinaga 1998a, B; Saudou et al. 1998), hogy az apoptózis út aktiválása a felnőtt neuronokban felelős lehet az Alzheimer-kór és a stroke patológiájáért. A DNS fragmentációja az apoptózis felismerésének egyik fő módja, és az agy ezen betegségek által érintett régióiban látható. Fragmentálódását specifikus méretű darabokra (nukleoszómák védik és tartják össze) okozhatja a poli(ADP-ribóz) polimeráz (PARP) kaszpáz-3 általi emésztése (Lazebnik et al. 1994). A PARP felismeri és javítja a DNS-töréseket. Az apoptózishoz vezető egyéb utakról bővebben lásd Green 1998.