prostaglandiner udviser en bred vifte af biologiske effekter, og deres handlinger er blandt de mest varierede af alle naturligt forekommende forbindelser. På trods af denne observation viser denne gruppe af lipider en markant struktur-aktivitetsspecificitet, som hovedsageligt bestemmes af cyclopentanonringsubstitutioner og graden af umætning af prostansyre-sidekæderne. Det cellulære respons på prostaglandiner medieres af deres interaktion med plasmamembranreceptorer.
PG-receptorer blev oprindeligt klassificeret på basis af funktionelle aktiviteter af naturlige og syntetiske agonister, og antagonister blev klassificeret i følgende kategorier: DP, EP, FP, IP og TP. Det første bogstav angiver prostaglandintypen, og bogstavet P står for “prostanoid.”30 senere bekræftede undersøgelser ved bindingsanalyse og molekylær kloning tilstedeværelsen af forskellige receptortyper såvel som tre eller fire undertyper af EP (EP1–4). Plasmamembranprostaglandinreceptorer hører til superfamilien af G-proteinkoblede receptorer, der er kendetegnet ved syv transmembran-spændende regioner.31 intracellulære anden budbringere af prostaglandinreceptorer inkluderer cAMP, proteinkinase C og calcium.30,31 de forskellige receptorer viser bemærkelsesværdig specificitet for eicosanoid, med mindst en 100 gange præference for liganden. Ved høje koncentrationer interagerer PGE2 og PGF2a med DP-receptoren; tilsvarende vil PGF2a aktivere EP-receptoren, mens PGD2 og PGE2 vil interagere med FP-receptoren ved høje koncentrationer. De fleste væv indeholder en blanding af receptorer, som synes at være grundlaget for de ofte modsatte virkninger af et bestemt prostaglandin i forskellige doser.
Prostaglandins rolle i gonadotropinsekretion
nylige data, der implicerer en fysiologisk rolle af prostaglandiner i reguleringen af gonadotropinfrigivende hormon (GnRH) sekretion er blevet offentliggjort.32,33 en række rapporter antyder nu, at prostaglandiner, især PGE2, udøver stimulerende indflydelse på gonadotropinfrigivelse, en effekt, der ser ud til at være medieret af en handling på niveauet af hypothalamus. PGE2 har vist sig at stimulere frigivelsen af GnRH fra hypothalamus, og forbehandling af dyr med antisera for at neutralisere endogen GnRH forhindrer PGE2-induceret frigivelse af LH.34 derudover synes PGE1 og PGE2 at være de mest potente stimulatorer for væksthormonfrigivelse fra dyrkede adenohypofyseale celler.35 PGB, PGA1, PGA2, PGB2, PGF1 og PGF2 er også aktive stimulatorer, men deres virkninger ses ikke ved fysiologiske doser. Generelt synes prostaglandiner ikke at stimulere gonadotropinsekretion ved en direkte virkning på hypofysen.
yderligere beviser, der tyder på, at prostaglandiner kan påvirke gonadotropinsekretionen (ved at virke direkte på hypothalamus) leveres fra undersøgelser, der bruger prostaglandinsyntetasehæmmere, såsom indomethacin, som tilsyneladende reducerer gonadotropinsekretionen.36 at prostaglandiner virker ved hjælp af hypothalamisk frigivende faktorer er tydeligt på grundlag af to observationer:
- forbehandling af hun-og hanrotter med antiserum til LH-frigivende hormon (LHRH) nedsatte PGE2 ‘ s evne (100 mg pr.36
- direkte administration af PGE2 i ventriklen i hjernen hos rotten efterlignede den intravenøse virkning af prostaglandiner på stimulering af gonadotropinsekretion.36
yderligere fund giver overbevisende støtte til konceptet om, at PGE2 fungerer på niveau med median fremtrædende for at fremkalde frigivelse af LHRH. Denne påstand bekræftes yderligere af konstateringen af, at median eminensvæv indeholder større mængder endogene prostaglandiner end basale hypothalamiske regioner. Data opnået fra in vitro-inkubationer af median eminensfragmenter opnået fra hanrotter har vist, at noradrenalin og dopamin stimulerer samtidig frigivelse af LHRH og PGF2a. Denne effekt er blokeret af indomethacin, hvilket antyder, at intraneuronalt producerede prostaglandiner er mediatorerne for catecholamin-stimuleret LHRH-frigivelse. Disse interessante fund diskuteres mere detaljeret i en gennemgang af Ojeda og kolleger.36
ægløsning og prostaglandiner
efter opdagelsen af,at indomethacin og aspirin (inhibitorer af prostaglandinsyntese) kunne blokere ægløsning,33, 37 blev det antydet, at prostaglandiner var involveret i ovariefollikulær brudproces. Denne påstand blev yderligere styrket af konstateringen af, at intraovarisk injektion af PGF2a antiserum også hæmmede ægløsning.38 Der er nu en betydelig mængde beviser, der indikerer, at follikulær prostaglandindannelse forbedres under ægløsning, og at denne forhøjelse er afhængig af gonadotropiner.39
midtcyklusbølgen af gonadotropiner stimulerer follikulær eicosanoidbiosyntese ved en cAMP-medieret proces, der er afhængig af genaktivering, men uafhængig af steroidogenese. LH ser ud til at være den dominerende fysiologiske hypofysegonadotropin, der er ansvarlig for induktion af ægløsning, og det forekommer sandsynligt, at virkningerne af LH på follikulært brud kan medieres af leukocytter, der udskiller proteolytiske stoffer, iltradikaler, og prostaglandiner. Indomethacin, for eksempel, vil blokere ægløsning normalt induceret af store doser af humant choriongonadotropin in vivo. Prostaglandiner kan formidle de stimulerende virkninger af LH på” ovulatoriske symptomer”, såsom protease eller kollagenase.40 Der er også mulighed for,at prostaglandiner kan fremkalde en kontraktil respons i follikelvæggen, 41 som nu vides at indeholde kontraktile elementer, såsom myosin og actin. Plasminogenaktivator eller en anden protease ser ud til at være iboende involveret i follikelbrud,42 og det er tydeligt, at sekretion af dette protein er forbundet med den LH-inducerede stigning i follikulær prostaglandinbiosyntese, skønt det er blevet påpeget, at disse to begivenheder muligvis ikke er indbyrdes afhængige. En mulig mekanisme for prostaglandinvirkning i follikulært brud er vist i figur 6.
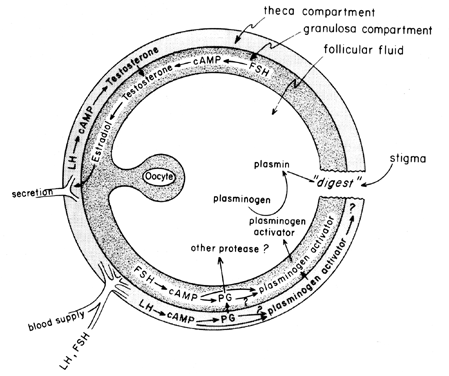 Fig. 6. Mulig mekanisme for prostaglandinvirkning i follikulær ruptur.(Behrman HR: prostaglandiner i hypothalamus-hypofyse-og ovariefunktion. Ann Rev Physiol 41:685, 1979)
Fig. 6. Mulig mekanisme for prostaglandinvirkning i follikulær ruptur.(Behrman HR: prostaglandiner i hypothalamus-hypofyse-og ovariefunktion. Ann Rev Physiol 41:685, 1979)
Prostaglandins rolle i Luteal funktion: Luteolyse og Menstruation
mekanismen, hvormed det menneskelige corpus luteum regresserer 10 til 12 dage efter dets dannelse, er et mysterium. Siden den tidlige konstatering af,at PGF2a var luteolytisk hos rotten og mange andre subprimatarter, 43 Der er gjort en stor forskningsindsats for at undersøge muligheden for menstruationsregulering med PGF2a.PGF2a inducerer funktionel regression af corpus luteum ved en receptormedieret proces, der oprindeligt er uafhængig af ændringer i Ovarie-eller luteal blodgennemstrømning.32 inden for få minutter udtømmer PGF2a ascorbinsyre, 44 afkobler den besatte LH-receptor fra adenylatcyclase og nedsætter transporten af gonadotropin fra kapillærer til lutealcellen.
en gennemgang af den relevante litteratur afslører mange modstridende rapporter om virkningerne af PGF2a hos mennesker. Nogle undersøgelser har registreret forbigående fald i cirkulerende niveauer af progesteron af PGF2a,45 selvom andre undersøgelser ikke har vist en sådan effekt hos normalt ægløsning kvinder.46,47 I betragtning af eksistensen af formodede PGF2a-receptorer i det humane corpus luteum 48 blev det begrundet,at manglende opnåelse af luteolyse med intravenøse infusioner af PGF2a måske skyldtes hurtig lungemetabolisme. Efterfølgende undersøgelser, der involverede direkte injektion af PGF2a i det humane corpus luteum, inducerede progesteronudtagning, hvis nadir faldt sammen med begyndelsen af tidlige menstruationer.49 disse fund antyder, at endogene ovarieprostaglandiner (eller et andet luteolytisk middel) kan være påkrævet til luteal regression. Dette synes muligt i betragtning af observationen af, at menneskelig luteal funktion ser ud til at være uafhængig af livmoderkontrol, da hverken hysterektomi50 eller medfødt fravær af livmoderen, vagina eller æggeleder påvirker ovariecyklicitet.51 humant lutealvæv er bestemt i stand til at producere prostaglandiner, som vist ved in vitro-eksperimenter52; forsøg på at korrelere øgede PGF2a-niveauer i æggestokken med luteal regression i den sene luteale fase har imidlertid ikke været vellykkede.53 Det ser ud til, at den eneste gang ovarie PGF2a-produktionen forbedres i den menneskelige menstruationscyklus, er kort efter ægløsning.54 det er imidlertid også tydeligt, at koncentrationerne af PGF2a altid er højere i ovariestromalvæv gennem tidlige, mid-og sene luteale faser.
i modsætning til in vivo-virkningerne af PGF2a har in vitro-undersøgelser vist både forbigående og vedvarende luteolytiske virkninger i humant lutealvæv.55,56,57 det er den generelle konsensus, at en tidlig begivenhed i PGF2a-induceret luteolyse er ophævelsen af gonadotropinfølsom cAMP-produktion afledt af undersøgelser i rotte corpus luteum.58,59 denne ophævelse vil sandsynligvis ske ved en direkte hæmning af adenylcyclase ved stigninger i intracellulær Ca2+.60 nylige beviser fra neurovidenskabsområdet indikerer, at prostaglandiner stimulerer frigivelsen af intracellulær Ca2+ ved at øge hydrolysen af phosphoinositol til diacylglycerol og inositoltriphosphat.61 i overensstemmelse med fund hos forsøgsdyr blev det vist, at regression af det humane corpus luteum også er forbundet med et tab af LH-receptorer.62
det er velkendt, at det nydannede corpus luteum af mange arter er ildfast over for den lytiske virkning af PGF2a63; denne observation ser også ud til at strække sig til det humane corpus luteum.64 Henderson og McNatty65 foreslog, at PGF2a-receptorer i det nydannede corpus luteum på en eller anden måde kan maskeres af besatte LH-receptorer, og at gradvis dissociation af LH fra dens receptor kan øge følsomheden af corpus luteum til PGF2a. En alternativ hypotese blev tilbudt af andre efterforskere,65, der antyder, at følsomheden af det humane corpus luteum over for PGF2a kan være afhængig af ovarie noradrenalinniveauer, som stiger i lutealfasen. Denne stigning i catecholaminer ser ud til at tillade den antigonadotrope virkning af PGF2a på humant corpus luteum.66
prostaglandiner i livmoderen
i modsætning til myometrium, der hovedsageligt producerer BGB 2, producerer det ikke-gravide endometrium overvejende PGF2a og PGE2. Syntesen af prostaglandiner er større i kirtelepitelet end i endometriumets stroma og i sekretorisk fase end i den proliferative fase af cyklussen.67,68 både PGF2a og PGE2, gennem deres interaktion med specifikke receptorer, er kendt for at stimulere myometrial kontraktilitet, hvilket fører til en stigning i intracellulær Ca2+. En sådan mekanisme af prostaglandin-induceret uterin hyperkontraktilitet er blevet impliceret i patogenesen af primær dysmenorrhea. Forhøjede niveauer af PGF2a og PGE2 er blevet identificeret i endometrium og menstruationsvæske hos kvinder med dysmenorrhea, og antiprostaglandin-midler har vist sig at resultere i en markant reduktion i smerte hos disse patienter.
forskellige prostaglandiner produceres også i livmoderhalsen, og receptorsteder for både PGE og PGF er til stede i livmoderhalsen.69 den øgede produktion af prostaglandiner eller deres lokale administration er forbundet med cervikal modning hos gravide kvinder.69
prostaglandiner og fødsel
en række observationer indirekte implicerer involvering af prostaglandiner i fødsel. Det er for eksempel kendt, at administrationen af indomethacin eller andre ikke-steroide antiinflammatoriske lægemidler, såsom aspirin, forlænger svangerskabet.69 desuden er prostaglandiner, især PGF2a, kendt for at være potente stimulatorer af uterin kontraktilitet og inducere cykliske sammentrækninger af den gravide livmoder. Forhøjede prostaglandinkoncentrationer er forbundet med begyndelsen af spontan arbejdskraft hos mennesker. Desuden er tidsperioden forud for begyndelsen af sammentrækninger karakteriseret ved plasma PGF2a niveauer, der svarer til dem hos ikke-gravide kvinder. Immunisering mod PGF2a forsinker også starten på fødslen.70 prostaglandiner bruges nu til at inducere tidlig fødsel og abort; faktisk er prostaglandin det valgte lægemiddel til udførelse af midtrimesteraborter.69,71
baseret på omfattende undersøgelser hos får ser det ud til, at prostaglandiner syntetiseret lokalt i livmoderen indleder arbejde ved direkte at virke på myometrium for at fremme livmoderkontraktioner. Et fald i lokal, placental progesteron kombineret med en stigning i østrogen resulterer i frigivelse af Ca2+ fra lysosomer, der er blevet skrøbelige. Denne Ca2 + – frigivelse stimulerer prostaglandinsyntese ved at øge phospholipaseaktiviteten. Det ser ud til at lette, snarere end at indlede, østrogen-og progesteroneffekterne.72 fostermembraner, decidua vera og myometrium kan alle deltage i dannelsen af prostaglandiner.73,74
et nyligt forslag er, at prostaglandinproduktion med intrauterint væv hæmmes tonisk under human graviditet, og at en sådan hæmning gradvist fjernes, når udtrykket nærmer sig. Selvom mekanismerne, der påvirker den toniske inhibering af prostaglandinsyntese, ikke er blevet fastslået,er der fundet flere antiphospholipase-peptider i human placenta, amnion, 75 og chorion.76 En anden mulighed er, at prostaglandinsyntese stimuleres parallelt med fjernelse af synteseinhibering. Potentielle signaler for øget syntese af prostaglandiner er flere vækstfaktorer og blodpladeaktiverende faktor. Føtal lunge-og nyrevæv udskiller blodpladeaktiverende faktor, som er i stand til at stimulere prostaglandinproduktion ved human amnion.77
prostaglandiner og Ductus Arteriosus
vedligeholdelse af åbenhed (afslapning af vasodilatation) af ductus arteriosus er afgørende for at kontrollere iltning af væv i fosteret. Efter fødslen bliver ductus arteriosus normalt indsnævret eller mister sin patency. Mekanismen, hvormed denne lukning forekommer, er uklar, skønt iltspænding i blodet menes at være en vigtig faktor (Fig. 7). Den primære funktion af ductus arteriosus i fosteret er at opretholde en vis grad af venstre mod højre arteriel blodskiftning og derved kontrollere mængden af venøs tilbagevenden til lungerne. Lukning af ductus på sigt er en vigtig fysiologisk proces, der, hvis ufuldstændig, fører til åndedrætsbesvær og cyanose/hypoksi—syndromer, der er ansvarlige for den høje sygelighed og dødelighed hos mange premature spædbørn, der lider af patent ductus arteriosus. Af denne grund er der stor interesse for mekanismen(E) til kontrol af ductus arteriosus-funktionen. Denne interesse er særlig akut inden for prostaglandinforskning, hvor der nu er en betydelig mængde beviser, der tyder på involvering af prostaglandiner i kontrol af ductus arteriosus patency på sigt.
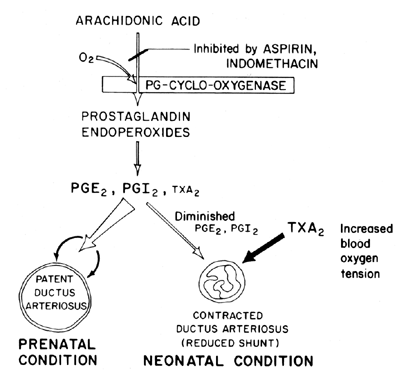 Fig. 7. Ordning for prostaglandinmodulation af patency af ductus arteriosus hos foster og nyfødte som en funktion af iltspænding.
Fig. 7. Ordning for prostaglandinmodulation af patency af ductus arteriosus hos foster og nyfødte som en funktion af iltspænding.
dette bevis er baseret på følgende række observationer:
ductus arteriosus hos fosteret med kardiopulmonal forringelse og hyalinmembransygdom kan lukkes ved administration af prostaglandinsyntetasehæmmere.78
Indomethacin kan inducere sammentrækning af det hypoksiske kar, som det fremgår af dets virkninger hos dyr på kort sigt.79
Administration af PGE2 (og PGE1) inducerer afslapning (tab af åbenhed) af isolerede føtale lam ductus arteriosus-præparater (cirkulære strimler) i et miljø med lavt iltindhold (PO2 mindre end 14 mmHg).80
det forekommer sandsynligt, at prostaglandiner i E-serien sammen med prostaglandinantagonister og prostaglandin-syntetaseblokkere (aspirin) kan vise sig at være ønskelige ikke-kirurgiske behandlinger for premature spædbørn med potentielt dødelig patent ductus arteriosus. Nylige beviser tyder på en balance mellem ductus patency og indsnævring, der opretholdes ved syntese af dilaterende prostaglandiner (PGI2 og PGE2) og indsnævring af prostaglandin (TKSA2). Hos lammefosteret syntetiserer både ductus arteriosus og lungen PGI2 og PGE2; derefter, når udtrykket nærmer sig, skifter lungen mod tksa2-syntese.81 yderligere information om prostaglandin involvering i kontrol af ductus arteriosus funktion er tilgængelig.82