Objectifs
Le but de ces directives est de faciliter la prise de décision dans le traitement des patients atteints d’un nodule pulmonaire solitaire (SPN).1-3 Ces lignes directrices ne se veulent pas rigides, car le traitement de la NPS est un exemple de la façon dont l’estimation de la probabilité de malignité (PM), l’accès aux différentes techniques diagnostiques et thérapeutiques et les préférences des patients travaillent ensemble pour façonner la décision optimale. Ce processus doit être individualisé dans le cadre clinique et pour chaque situation particulière. L’accessibilité à certaines techniques de diagnostic pouvant varier selon les paramètres, un algorithme stratégique général est proposé (Fig. 1) avec deux variantes, en fonction du degré d’accessibilité à la tomographie par émission de positons (TEP) (Fig. 2 et 3). Les recommandations ont été classées en fonction de la force (forte 1, faible 2) en fonction de la relation entre les bénéfices prévisibles et les risques pour le patient; et la qualité des preuves scientifiques, comme élevée (A), modérée (B), faible (C) ou très faible (D), selon le système de NOTATION.4 Un résumé de ces recommandations2,4,6 figure au tableau 1. La version étendue de ces recommandations est disponible sous forme de supplément en ligne, accompagnée de tableaux et de figures supplémentaires (Annexe 1).
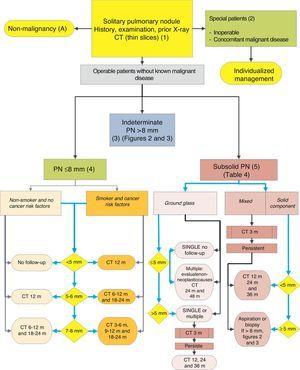
pour la gestion du PN: classification initiale et observation du SPN≤8 mm et du SPN subsolide. m: mois, PN: nodule pulmonaire; SPN: nodule pulmonaire solitaire; CT: tomodensitométrie, y compris les coupes minces. Suivi par tomodensitométrie à faible rayonnement, à condition qu’aucune croissance ne soit détectée. Les chiffres et les lettres entre parenthèses renvoient aux sections du texte où ils sont discutés.
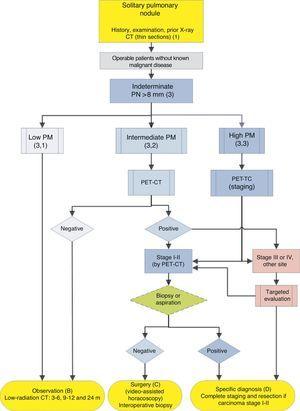
pour la prise en charge de PN > 8mm: cadre clinique avec un accès facile à la TEP-CT. m: mois, PN: nodule pulmonaire; SPN: nodule pulmonaire solitaire; TEP-CT: tomographie par émission de positons avec tomodensitométrie; PM: probabilité de tumeur maligne; CT: tomodensitométrie thoracique, y compris les coupes minces. Suivi par tomodensitométrie à faible rayonnement, à condition qu’aucune croissance ne soit détectée. Les chiffres et les lettres entre parenthèses renvoient aux sections du texte où ils sont discutés.
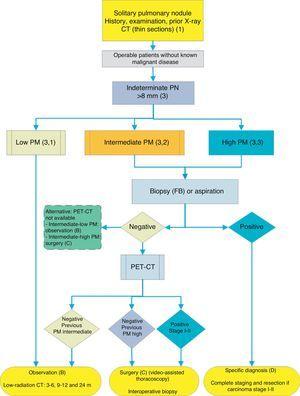
pour la prise en charge de la PN > 8mm: cadre clinique avec accès difficile à la TEP-CT ou préférence pour l’étude cytohistologique de la SPN. FB: bronchoscopie fibroptique et biopsie guidée; m: mois; SPN: nodule pulmonaire solitaire; TEP-CT: tomographie par émission de positons avec tomodensitométrie; PM: probabilité de tumeur maligne; CT: tomodensitométrie thoracique, y compris les coupes minces. Suivi par tomodensitométrie à faible rayonnement, à condition qu’aucune croissance ne soit détectée. Les chiffres et les lettres entre parenthèses renvoient aux sections du texte où ils sont discutés.
Recommandations pour la Prise en charge du Nodule pulmonaire Solitaire.
| Recommandation | Gradea |
| Évaluation initiale du RPS | |
| Toutes les décisions concernant la prise en charge d’un NPS doivent inclure l’opinion et les préférences du patient correctement informé | 1C |
| Évaluer la stabilité ou la croissance dans des études radiologiques antérieures si elles sont disponibles | 1C |
| La stabilité pendant plus de 2 ans dans le SPN solide et la calcification bénigne indiquent une bénignité et ne nécessitent pas d’évaluation plus approfondie | 2C |
| La tomodensitométrie, avec des sections minces à travers la lésion d’intérêt, est essentielle pour l’évaluation initiale du SPN indéterminé | 1B |
| La NSP chez les patients présentant une malignité antérieure ou concomitante nécessite une prise en charge et une évaluation individualisées | 1C |
| Les SNPS chez les patients inopérables nécessitent une prise en charge individualisée | 1C |
| Les SPN seront classés comme nodules solides > 8 mm, nodules solides≤8 mm et nodules subsolides | 1B |
| Nodules solides > 8 mm | |
| Devrait être classé selon PM: faible ( (>65%) | 2C |
| SPN à faibles PM: observation radiologique | 2C |
| Observation radiologique: tomodensitométrie à faible rayonnement sans contraste à 3-6, 9-12 et 24 mois | 2C |
| SPN avec PM intermédiaire: PET-CT | 1B |
| TEP-TDM négative : observation radiologique | 2C |
| SPN avec PM intermédiaire: la biopsie-aspiration est une alternative acceptable | 2C |
| Pas de diagnostic histologique: TEP-CT | 1B |
| Une biopsie ou une aspiration est recommandée en cas de discordance entre les PM cliniques et les tests d’imagerie | 2C |
| Étiologie suspectée nécessitant un traitement médical (par exemple, tuberculose) | |
| Patients refusant ou s’opposant à une chirurgie diagnostique | |
| SPN avec PM élevé: prise en charge selon le diagnostic présumé de carcinome à un stade précoce | 2C |
| SPN avec PM élevé: FB avec examen bronchique et biopsie transbronchique | 2D |
| SPN non diagnostiquée avec PM supérieure à faible chez les patients opérables: résection SPN | 2C |
| Technique recommandée: thoracoscopie assistée par vidéo | 1C |
| Biopsie interopératoire pour établir le type de résection | |
| Le SNP sous-centimètre associé à la NSP ne doit pas être une contre-indication à la chirurgie curative du carcinome à moins qu’il n’y ait confirmation de métastases. | 2C |
| Certs: CE, ISO9001 | |
| Stratégie d’observation suivant les recommandations de la Société Fleischner (Fig. 1) | 2C |
| Tomodensitométrie à faible dose sans contraste | 1C |
| SPNs sous-solides | |
| Intervention selon les recommandations de la Société Fleischner (Tableau 2) | 1B à 2C |
| Tomodensitométrie à faible dose sans contraste | 1C |
FB: fibroscopie; PN: nodule pulmonaire; SPN: nodule pulmonaire solitaire; TEP: tomographie par émission de positons; PM: probabilité de tumeur maligne; CT: tomodensitométrie.
Note de recommandation selon la force (forte 1 ou faible 2) et la qualité des preuves scientifiques comme élevée (A), modérée (B), faible (C) ou très faible (D), selon le système de NOTES.
Introduction: Concept et étiologie
La NPS est définie comme une opacité radiologique unique, sphérique et distincte avec un grand axe ≤30 mm, principalement entourée d’un poumon aéré et sans atélectasie associée, hypertrophie hilaire ou épanchement pleural.1-3 SPNS peuvent être observés sur la radiographie thoracique ou la tomodensitométrie thoracique (CT) réalisée pour étudier d’autres maladies ou pour le dépistage diagnostique du cancer du poumon (LC).3,6,7 Nodules millimétriques (≤8 mm de diamètre) 1,2,6 et nodules subsolides (SSNs) 2,5 (Fig. 4), nécessitant une gestion différente, 5-7 peuvent être détectés sur CT (Fig. 1). Les SSN comprennent à la fois des nodules de verre broyés et des nodules partiellement solides qui combinent un composant de verre broyé avec un composant solide.2,5–7
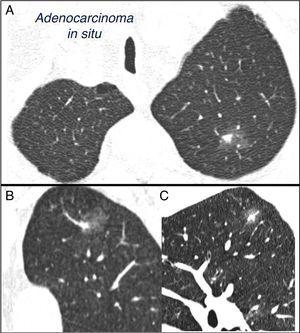
Nodule pulmonaire solitaire subsolide mixte dans le lobe supérieur gauche. Tomodensitométrie thoracique avec des sections minces de 2 mm chez un patient présentant un nodule pulmonaire solitaire dans le lobe supérieur gauche. Tranche axiale (A) dans les lobes supérieurs et reconstructions coronales (B) et sagittales (C) dans le lobe supérieur gauche. Un nodule pulmonaire solitaire en verre broyé de 18 mm est observé, avec un composant solide de 7 mm à l’intérieur. La résection par thoracoscopie assistée par vidéo a révélé un adénocarcinome.
On estime que les nodules se produisent à un taux de 1 ou 2 pour 1000 rayons X.1,3,8 La prévalence des nodules sur les STC chez les fumeurs adultes pour le dépistage de la LC est très élevée, entre 20% et 50%, et sont généralement de taille inférieure à 10 mm; l’incidence des STC annuelles successives est de 10%.1,3,6,7
Lors de l’évaluation des SPN avec CT, d’autres petits nodules sont souvent trouvés. Lorsqu’ils sont peu nombreux ou qu’un est clairement dominant, ils doivent être considérés comme des SPN indépendants, car, même si la situation est LC, les nodules sous-centimétriques qui les accompagnent sont généralement bénins.1,2,6,7 De plus, dans jusqu’à 20% des cas, le nodule malin n’est pas le plus gros.7
Le SPN est la manifestation radiologique de nombreuses maladies3 (Annexe en ligne – Tableau 1S). Cependant, la plupart des nodules sont causés par des tumeurs malignes pulmonaires, des granulomes et des hamartomes.1 La prévalence de la malignité varie entre les séries8,9: entre 5% et 70%, selon que les chiffres proviennent de contrôles de santé ou d’études de techniques de diagnostic, et dans une moindre mesure dans les SPN détectés dans les programmes de dépistage de la LC, où la prévalence est de 1% à 10%, en fonction de la taille des nodules.3,7 La PM des SPNs augmente notamment chez les patients atteints d’une maladie tumorale antérieure.3,10
La plupart des SPN malins sont des LC, le plus souvent des adénocarcinomes et des carcinomes à grandes cellules.2,3 Dans le SSN malin, les souches les plus courantes se situent dans le spectre des adénocarcinomes, 5, 11, 12 allant de l’hyperplasie adénomateuse atypique dans les plus petits nodules, de l’adénocarcinome in situ, de l’adénocarcinome mini-invasif et des adénocarcinomes invasifs, si un composant solide est présent, en particulier dans les nodules mucineux et ceux à croissance lépidique.5,11,12
Techniques de diagnostic dans l’étude de la tomodensitométrie Nodulaire pulmonaire solitaire
Cette technique est largement supérieure à la radiographie standard dans l’évaluation des SPN.2,3 Il peut détecter d’autres nodules et lymphadénopathies médiastinales, diagnostiquer des pseudonodules (lésions extraparenchymateuses) et aider à planifier une biopsie ou une aspiration de nodules. Dans certains cas, il peut fournir un diagnostic spécifique, tel que des malformations artérioveineuses, des mycétomes, une atélectasie arrondie ou des hamartomes. En conséquence, la tomodensitométrie est essentielle en tant qu’examen d’indice pour l’étude des SPN.2
L’amélioration des nodules ou l’absorption de matériaux de contraste ont montré une sensibilité de 98% à la malignité avec une coupure de > 15 unités de Hounsfield (HU) et une spécificité de 58%.13 Ceci s’applique aux SPN sphériques homogènes > 8 mm, sans graisse, cavitation calcique ni nécrose. Cela peut être utile dans les centres spécialisés dans cette technique, mais en raison de l’introduction du PET, son utilisation n’est pas généralisée.3
Tomographie par émission de positons
L’une des principales indications de la TEP-CT avec 18F-désoxy-d-glucose est l’étude des SPN. La sensibilité moyenne pour les SPN solides > 10-15mm est de 0.93 (intervalle de confiance 0,90–0,95), et la spécificité moyenne est de 0,8 (IC 0,74–0,85).2,14,15 Les faux négatifs sur TEP-CT sont associés à une technique défectueuse, à un diamètre tumoral de 7 mm, à des tumeurs carcinoïdes, à des nodules subsolides et à certains adénocarcinomes, en particulier in situ, mini-invasifs, à une croissance lépidique ou à des adénocarcinomes mucineux.2,3 Les faux positifs sont plus fréquents et comprennent des lésions inflammatoires et infectieuses, telles que les granulomes, la tuberculose, les mycoses ou les pneumonies.2,16
La TEP-CT est la plus utilisée dans les SPN > 8 mm avec des particules intermédiaires: une étude négative réduit considérablement les PARTICULES.3 Dans un TEP-TDM positif, une valeur d’absorption standardisée (SUV) plus élevée indique une plus grande agressivité tumorale et un pronostic moins favorable pour le patient, bien que sa spécificité réduite, et donc le risque d’un faux positif, doit être prise en compte.17,18 Il peut également aider à sélectionner le site de biopsie le plus efficace et le plus accessible et aider, si nécessaire, à planifier la radiothérapie.19 La TEP-TDM contribue au stade du cancer2,3 en évaluant les métastases médiastinales et systémiques, et est recommandée dans de nombreuses lignes directrices sur la prise en charge de la LC.17,18,20 Dans ces recommandations, la TEP-TDM est utilisée de deux manières: en tant qu’outil pour caractériser le SPN et en tant que technique de mise en scène dans les SPN à PM élevé.
Prélèvement Cytohistologique de Nodules Pulmonaires Solitaires Tomodensitométrie, Radioscopie ou Aspiration Transthoracique à Aiguille Fine Guidée par Ultrasons
Une analyse de la littérature sur 48 études montre une bonne sensibilité, 86% (IC 84%-88%), pour le diagnostic de malignité et une très bonne spécificité, 99% (IC 98%-99%).21 Dans les SPN inférieurs à 15 mm, la sensibilité est plus faible, à 70%-82%.2,22 Dans les maladies bénignes, la spécificité est également plus faible.21 Le taux moyen de pneumothorax était de 15 %, dont 7% nécessitaient un drainage.2,21,23 L’aspiration transthoracique est contre-indiquée en cas de mauvaise collaboration du patient, de fonction respiratoire très compromise ou de diathèse pulmonaire ou hémorragique unique, et en présence d’emphysème ou de bulles étendues dans la région du nodule. Entre 4% et 50% des résultats ne fournissent pas de diagnostic et jusqu’à 20% sont de faux négatifs.2 Si PM est élevé, le taux de vrais négatifs est le même que celui des faux négatifs, il n’est donc pas utile pour exclure la malignité.2
Bronchoscopie fibroptique et Techniques associées
En LC, le rendement diagnostique de l’aspiration transbronchique guidée par CT (TBA) pour cibler le nodule varie, selon la série, de 20% à 80%, et est inférieur dans les SPN inférieurs à 20 mm, où le rendement moyen est de 30%.2 Dans les SPN bénins, le rendement est de 10%. Cette technique est plus efficace dans les nodules centraux plus grands (> 20 mm) en utilisant un bronchogramme à air.2,24 Il y a peu de risque de TBA: pneumothorax, 2%, 2 et plus rarement, hémoptysie ou hématomes. Bien que le rendement diagnostique pour les SPN soit inférieur à celui obtenu avec une biopsie par aspiration à l’aiguille fine transthoracique (FNAB), un examen endobronchique peut être effectué avant de planifier une chirurgie LC.25 bronchoscopies ultra-fines pour un meilleur accès aux lésions, gaines de guidage pour le positionnement de la pince, endobronchoscopie par ultrasons à sonde radiale, bronchoscopie de navigation électromagnétique et bronchoscopie de navigation sont à l’étude, techniques permettant de guider la pince vers le nodule, améliorant ainsi le rendement.2,26 Ces techniques ont été comparées dans une méta-analyse26: le rendement combiné était de 70%, meilleur que dans les séries précédentes guidées par radioscopie, et les rendements des techniques individuelles variaient de 68,5% à 73%, bien qu’une grande variabilité et hétérogénéité aient été observées parmi les études. Le rendement était plus faible en SPNs20mm, 61% contre 80% en > 20mm. La combinaison de techniques peut améliorer quelque peu le rendement.2 Comme il ressort de ces données, aucune technique en particulier ne surpasse les autres en termes de rendement, et il est recommandé que chaque centre utilise les techniques pour lesquelles il existe à la fois des équipements et des compétences.
La thoracoscopie assistée par vidéo et la thoracotomie
les SPN peuvent être réséqués à l’aide de ces techniques.2 Si les SPN sont petits ou situés profondément dans le parenchyme, ils peuvent être préalablement teints ou marqués avec un fil à crochet, généralement avec une ponction transthoracique guidée par CT. Les risques de thoracoscopie assistée par vidéo sont faibles et la mortalité est très rare (moins de 1%), la morbidité est faible et le rendement diagnostique est bon, similaire à la thoracotomie mais avec une mortalité plus faible.2 Lorsque le SPN est LC, si la situation clinique du patient le permet, une résection anatomique est indiquée: en général, la lobectomie et la dissection des ganglions médiastinaux sont recommandées.2,20,27
Estimation de la probabilité de tumeur maligne
Les SPN malins diffèrent des SPN bénins dans certains aspects cliniques et radiologiques, décrits plus en détail dans la version étendue de ces lignes directrices (voir supplément en ligne). Les facteurs les plus étroitement associés à la malignité sont la taille du SPN, les caractéristiques de la marge, la densité, l’âge du patient, la consommation de tabac accumulée, l’existence d’autres malignités et la détection de la croissance.2,3,6,7,10,28 – 30 La calcification centrale, laminaire ou totale du SPN est considérée comme un bon critère de bénignité, 2, 3 de même que la stabilité radiologique pendant plus de 24 mois, ce qui implique un temps de doublement de plus de 730 jours. Ce critère n’est pas valable pour le SSN, pour lequel l’observation doit être étendue à au moins 3 ans.1-3,5
La plupart des cliniciens estiment les PM de manière intuitive, mais plusieurs modèles SPN et règles de classification ont été proposés7,28-32 et il existe même des calculatrices disponibles en ligne (Annexe en ligne – Tableau 2S) ou sous forme d’application pour smartphone (calculateur médical Medcalc). Le tableau 2S de l’annexe en ligne donne un ensemble de formules obtenues à partir de différents modèles logistiques et la figure 1S est un nomogramme valide pour les SPN dans la radiographie pulmonaire.
Cette estimation de PM guide le processus de diagnostic ultérieur.1,2,31 Logiquement, lors de la prédiction de la malignité, les résultats de toutes les techniques d’examen sont revus, y compris les résultats de TEP-CT, 31, 32 les résultats de biopsie ou d’aspiration et l’évaluation de la croissance, si des images appropriées sont disponibles.
Avec les PM, les avantages et les risques prévisibles du traitement doivent être évalués. Il existe un seuil PM indiquant l’observation, c’est-à-dire toute PM pour laquelle l’option la plus raisonnable est l’observation prospective de la stabilité ou de la croissance du SPN; et un seuil pour la chirurgie, pour lequel une intervention chirurgicale est clairement recommandée car la probabilité d’un cancer à un stade précoce est élevée. Ces seuils dépendent des bénéfices attendus; par exemple, la probabilité de guérison ou la réponse au traitement en cas de maladie maligne, les risques chirurgicaux, qui peuvent varier selon les patients et l’attitude personnelle et la préférence du patient.1
Évaluation séquentielle du Nodule pulmonaire solitaire
Le but de l’évaluation d’un NPS est de diagnostiquer et de traiter les NPS qui représentent une maladie active, en particulier la LC, puisque la survie à 5 ans est de 70% à 80% en stade précoce de la maladie.20 Un autre objectif est d’éviter de soumettre les patients atteints de granulomes, d’hamartomes et d’autres lésions bénignes à des traitements coûteux et risqués. Il n’y a pas de procédure unique acceptée. Les éléments clés de l’évaluation sont l’estimation de la probabilité de malignité, l’accessibilité aux différents tests diagnostiques et l’expertise des cliniciens dans ces techniques, ainsi que les préférences du patient.1,2
Fig. 1-3 montrent l’évaluation séquentielle proposée de SPN: Fig. 1 décrit la classification initiale par taille SPN, densité et solidité ou sous-solidité, en séparant les patients nécessitant une prise en charge individualisée et ceux pouvant être diagnostiqués dès le départ. Figue. 2 et 3 décrivent la stratégie proposée pour les SPN solides indéterminés > 8 mm, selon que l’accès à la TEP-CT est facile ou non (Fig. 2) ou plus difficile (Fig. 3).
Évaluation radiologique clinique et initiale (1)
L’examen initial comprend l’historique, l’examen et l’évaluation des caractéristiques radiologiques, ainsi que la comparaison avec toutes les radiographies antérieures disponibles2,31: grade de recommandation, 1C.
S’il n’y a aucune preuve de stabilité pendant > 2 ans ou de calcification bénigne, la tomodensitométrie avec des sections minces à travers le nodule d’intérêt est indiqué2: grade de recommandation, 1B.
Certains nodules peuvent être classés dans cette phase comme bénins s’ils sont considérés comme stables pendant plus de 2 ans ou à partir de leurs caractéristiques sur CT2, 31: grade de recommandation, 2C.
Dans les SPN indéterminés, la surveillance se poursuivra, en fonction des caractéristiques du patient et des caractéristiques radiologiques du nodule.
Patients en Situation particulière (2)
La situation d’un patient peut être considérée comme particulière en raison d’une modification de la fréquence étiologique ou de la PM du SPN, ou parce que la procédure est limitée à des techniques non invasives en raison de risques chirurgicaux.
Patients présentant une maladie maligne antérieure ou concomitante. La PM des nodules pulmonaires, qu’ils soient simples ou multiples, augmente considérablement chez ces patients, 3, 10 même s’ils sont petits.6 La possibilité de métastases est encore plus grande si les SPN n’étaient pas présents auparavant. Néanmoins, lorsque les SPN sont sous-centimétriques, jusqu’à un tiers sont bénins, le diagnostic doit donc être confirmé par biopsie, aspiration ou thoracoscopie assistée par vidéo avant de refuser les traitements potentiellement curatifs: grade de recommandation, 2C.2,10 SPNs chez les patients immunodéprimés nécessiteront une évaluation individualisée, et une biopsie ou une aspiration est préférable.33
Chez les patients inopérables, l’évaluation de la NPS est limitée. Une biopsie ou une aspiration est indiquée dans les cas où les PM sont élevées ou les résultats positifs sur la TEP, pour guider la chimiothérapie ou la radiothérapie si un traitement de la LC est nécessaire: grade de recommandation, 2C.
Nodule pulmonaire solitaire > 8mm (3) (Fig. 2 et 3)
La première étape consiste à classer le patient en fonction de la PM estimée : faible (??5%), intermédiaire ou élevé (> 65%) 1,2,29,31: grade de recommandation, 1C.
Faible Probabilité de malignité (3, 1)
Faible PM est celle estimée à moins de 5%.2,31 Cela inclut les SPN qui sont encore petits (
mm), avec des marges distinctes, les patients plus jeunes (2,28–32,34 Dans ces cas, une observation radiologique est recommandée2,31: grade de recommandation, 2C.
Sont également inclus les SPN avec PM intermédiaire et TEP-CT négative ou ceux évalués avec FNAB montrant une non-malignité2: grade de recommandation, 2C.
Probabilité intermédiaire de malignité (3,2)
Une PM de entre 5% et 65% est considéré comme intermédiaire.2,28 – 32,34 Dans ces cas, la TEP-TDM, non invasive, à faible risque et à fort pouvoir discriminatoire, est recommandée (Fig. 2): note de recommandation, 1B. Un résultat négatif réduit considérablement les PARTICULES, et une observation peut être recommandée; un résultat positif augmente les PARTICULES et les classe comme élevées.2,31
Selon l’accessibilité et les temps d’attente pour effectuer la TEP-CT, une procédure alternative est la FNAB guidée par CT ou la bronchoscopie fibéroptique (FB) – TBA guidée par radioscopie, endoscopie échographique ou navigation électromagnétique ou virtuelle (Fig. 3) : grade de recommandation, 2C. L’option de biopsie est particulièrement recommandée lorsque la PM clinique et les résultats des tests d’imagerie sont discordants, lorsque des étiologies nécessitant un traitement médical spécifique (par exemple, la tuberculose) sont suspectées ou si le patient est défavorable à la chirurgie2: grade de recommandation, 2C.
Répéter des techniques de biopsie ou d’aspiration en cas de négativité initiale n’est recommandé que lorsque la PM du SPN est élevée et que le diagnostic avant la chirurgie est jugé nécessaire, ou lorsque la chirurgie est contre-indiquée.
Si le résultat est négatif, TEP-CT serait recommandé (Fig. 3): note de recommandation, 1B. Si aucun TEP-TDM n’est disponible, l’alternative serait la surveillance par TDM, en particulier si le FNAB était négatif, ou une intervention chirurgicale.
Forte probabilité de malignité (3, 3)
PM est élevée chez les patients de plus de 50 ans, ayant des antécédents de tabagisme ou des caractéristiques radiologiques de malignité: SPN > 15 mm, marges spéculées ou densité hétérogène. Les SPN hypermétaboliques sur TEP-CT, ceux qui ont augmenté de taille ou changé de forme et ceux dont la cytologie ou la biopsie pulmonaire suggère une tumeur maligne présentent également des MP élevées.2,28- 32,34
Dans ces cas, certains auteurs recommandent une chirurgie diagnostique-thérapeutique directe et d’autres préfèrent les techniques de biopsie.2,31 Dans la population sélectionnée par cet algorithme, lorsque les patients atteints d’autres cancers ont été exclus, la plupart des SPN sont des cancers du poumon. Ainsi, la recommandation est qu’ils soient gérés comme tels,2 avec la TEP-CT recommandée comme méthode pour l’échelon17,18: grade de recommandation, 2C.
Le diagnostic histologique pré-chirurgical peut être déterminé à l’aide de FB-TBA, une technique qui permet également une évaluation de l’arbre bronchique avant d’entreprendre une intervention chirurgicale, ou par FNAB. Un résultat négatif ne réduit pas suffisamment les PARTICULES pour empêcher la résection du SPN. L’efficacité de la tentative de diagnostic pré-chirurgical de SPN avec PM élevée, au stade clinique I ou II avec CT et TEP-CT, à condition que le patient soit opérable, n’a pas été étudiée. Pour cette raison, ceci est proposé en option dans l’algorithme (Fig. 2), bien que l’évaluation pré-chirurgicale avec FB soit une pratique standard: grade de recommandation, 2C.
Si la TEP-CT révèle des remontées médiastinales ou extrathoraciques suggérant des métastases, celles-ci doivent être évaluées avant la chirurgie de résection.17,18 Si le SPN avec une PM élevée est négatif sur la TEP-CT, la PM n’est pas suffisamment réduite pour recommander l’observation,2 et une résection par thoracoscopie assistée par vidéo est recommandée: grade de recommandation, 2C. Une absorption plus faible suggère cependant un meilleur pronostic et une probabilité de dissémination moindre, ce qui peut être pris en compte si le patient a une forte objection à la chirurgie.3,31
Dans la stratégie proposée, l’évaluation d’un NPS à PM élevée doit se conclure par un diagnostic spécifique ou une résection diagnostique-thérapeutique (Fig. 2 et 3).
Nodule pulmonaire solitaire mm (4)
La prévalence de ces SNPS est très élevée dans les études de tomodensitométrie et la MP est faible, sauf s’il existe des antécédents de tumeur métastasante antérieure ou concomitante.2,6 Ils sont difficiles d’accès pour obtenir des biopsies et la TEP-CT et la TDM dynamique ont une sensibilité très faible.2,6 Une stratégie d’observation suivant les recommandations de la Société Fleischner6 (Fig. 1) est proposé, en tenant compte des patients asymptomatiques sans maladie maligne concomitante: grade de recommandation, 2C.
Le suivi est effectué avec CT6 à faible dose et sans contraste: grade de recommandation, 1C. Là encore, le patient doit être informé et ses préférences doivent être prises en compte.2
Nodule pulmonaire subsolide (5)
Ce sont des nodules de verre broyé, purs ou avec un composant solide5 (Fig. 4). La détermination d’un nodule sous-solide nécessite des sections minces, de préférence de 1 mm, car de petits SPN solides en tranches CT de 5 mm peuvent apparaître sous forme de verre broyé.2,5
Les SSN sont difficiles d’accès pour la biopsie ou l’aspiration et la sensibilité de la TEP-CT est faible.5,35 En revanche, leur PM est relativement élevée, 15% ou plus dans le cas de SPN de verre broyé et plus de 50% pour un nodule mixte.5 Il est également plus difficile d’établir des changements de taille ou de volume de ces lésions lors de la surveillance, et les tumeurs malignes qui apparaissent sous cette forme peuvent être indolentes pendant une période prolongée, raison pour laquelle la période d’observation doit être plus longue, 5 c’est-à-dire au moins 3 ans.
Comme de nombreuses étiologies bénignes sont des processus aigus ou subaiguës, une stratégie d’observation initiale avec CT à 3 mois est proposée, car certains SPN peuvent disparaître. S’ils persistent, la stratégie sera déterminée par la taille du SPN, s’ils ont un composant solide et s’ils sont simples ou multiples (Fig. 1). Le tableau 2 présente en détail les recommandations proposées par la Société Fleischner.5
Gestion des Nodules subsolides.
| Catégorie de Recommandationa | ||||
| Verre moulu SPN | ||||
| ≤ 5mm | Pas de suivi | 1C | ||
| > 5mm | CT à 3 mois | Persistant | CT annuel Suivi > 3 ans | 1B |
| SPN partiellement solide (partie solide) | ||||
| mm | CT à 3 mois | Persistant | CT annuel Suivi > 3 ans | 2C |
| ≥ 5mm | CT à 3 mois | Persistant | Biopsie, résection, TEP-CT si partie solide > 10mm | 1B |
| Verre moulu multiple PN | ||||
| ≤ 5mm | Considérez les causes non malignes | CT à 2 et 4 ans | 1C | |
| > 5mm | CT à 3 mois | Persistant | CT annuel Suivi > 3 ans | 1B |
| PN multiple avec composant solide | CT 3 mois | Persistant | Biopsie, résection, surtout si partie solide > 5mm | 1C |
PN: nodule pulmonaire; SPN: nodule pulmonaire solitaire; TEP: tomographie par émission de positons; TDM: tomodensitométrie. La note de recommandation est celle proposée par la Société Fleischner5, basée sur le système de NOTES. Les recommandations de l’American College of Chest Physicians2 réduisent la force de la recommandation d’une note. La tomodensitométrie pour l’évaluation doit être une tomodensitométrie fine et une tomodensitométrie à faible dose de suivi.
Note de recommandation selon la force (forte 1 ou faible 2) et la qualité des preuves scientifiques comme élevée (A), modérée (B), faible (C) ou très faible (D), selon le système de NOTES.
Possibilités Finales Après Évaluation
- A.
Diagnostic de bénignité: Patients présentant un diagnostic spécifique de TDM, tels que des hamartomes, des malformations artérioveineuses, des lésions kystiques, une atélectasie arrondie, des mycétomes, des pseudonodules ou des nodules calcifiés, ou qui ont des critères de bénignité, par exemple une stabilité documentée pendant au moins 2 ans, dans le cas de nodules solides, ou au moins 3 ans pour les nodules subsolides2,3: grade de recommandation, 2C.
- B.
Observation radiologique: Indiquée dans les SPN avec des PM faibles, ou avec des PM intermédiaires lorsque la TEP-TDM est négative, grade de recommandation, 2C. Ceci peut également être indiqué dans les SPN non diagnostiqués si le risque de chirurgie est très élevé ou si le patient refuse la chirurgie: grade de recommandation, 2C.
Pour les SPN > 8mm avec des PM faibles, une surveillance CT est recommandée à 3-6 mois, à nouveau à 9-12 mois et à nouveau à 24 mois.2 Il existe des stratégies spécifiques pour SPN≤8 mm et SSN2,5, 6 (Fig. 1 et tableau 2): grade de recommandation, 2C. Les STC de surveillance doivent être effectuées avec une faible dose et sans contraste: grade de recommandation, 1C.
- C.
Chirurgie diagnostique et thérapeutique: Les patients opérables avec une SPN et une PM non diagnostiquées supérieures à la faible devraient se voir proposer une résection: grade de recommandation, 2C. Bien que la thoracoscopie assistée par vidéo soit la méthode de choix (grade de recommandation, 1C), chaque équipe chirurgicale décidera de la meilleure approche. La biopsie peropératoire est recommandée pour compléter la résection appropriée dans le cas de LC: grade de recommandation, 1C.
- D.
Diagnostic spécifique: Il s’agit du diagnostic étiologique de SPN. Si la LC est diagnostiquée, des protocoles de stadification et de traitement locaux spécifiques seront appliqués.20
L’algorithme ne peut être complété sans souligner à nouveau que la décision optimale doit inclure l’opinion et les préférences du patient correctement informé2: grade de recommandation, 1C.
Conflit d’intérêts
Les auteurs affirment qu’ils n’ont pas de conflit d’intérêts.