célkitűzések
ezen irányelvek célja a döntéshozatal megkönnyítése a solitary pulmonalis Nodulus (SPN) betegek kezelésében.1-3 ezeknek az irányelveknek nem célja, hogy merevek legyenek, mivel az SPN kezelése példa arra, hogy a malignitás valószínűségének becslése (PM), a különböző diagnosztikai és terápiás technikákhoz való hozzáférés és a beteg preferenciái hogyan működnek együtt az optimális döntés kialakításában. Ezt a folyamatot egyénre kell szabni a klinikai környezetben és minden egyes helyzetben. Mivel egyes diagnosztikai technikák hozzáférhetősége a beállítástól függően változhat, általános stratégiai algoritmust javasolunk (ábra. 1) két alternatívával, a pozitron emissziós tomográfia (PET) hozzáférhetőségének mértékétől függően (ábra. 2 és 3). Az ajánlásokat erősség szerint osztályozták (erős 1, gyenge 2) az előrelátható előnyök és a betegre gyakorolt kockázatok közötti kapcsolat alapján; és a tudományos bizonyítékok minősége, mint magas (A), közepes (B), alacsony (C) vagy nagyon alacsony (D), az osztályozási rendszer szerint.4 Ezen ajánlások összefoglalása2, 4, 6 az 1.táblázatban található. Ezen ajánlások kibővített változata online kiegészítésként, további táblázatokkal és ábrákkal együtt Elérhető (1.függelék).
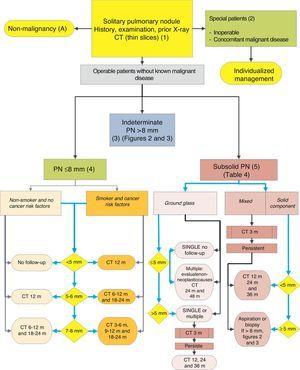
algoritmus a PN kezelésére: az SPN kezdeti osztályozása és megfigyelése 6 mm és subszilárd SPN. m: hónapok, PN: tüdőcsomó; SPN: magányos tüdőcsomó; CT: számítógépes tomográfia, beleértve a vékony szakaszokat is. Nyomon követés alacsony sugárzású CT-vel, feltéve, hogy nem észlelhető növekedés. A zárójelben lévő számok és betűk a szöveg azon szakaszaira utalnak, ahol azokat tárgyalják.
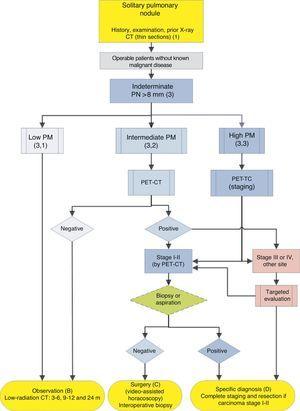
algoritmus a PN>8mm kezelésére: klinikai beállítás, könnyű hozzáféréssel a PET-CT-hez. m: hónapok, PN: tüdőcsomó; SPN: magányos tüdőcsomó; PET-CT: pozitron emissziós tomográfia számítógépes tomográfiával; PM: rosszindulatú daganat valószínűsége; CT: mellkasi számítógépes tomográfia, beleértve a vékony szakaszokat is. Nyomon követés alacsony sugárzású CT-vel, feltéve, hogy nem észlelhető növekedés. A zárójelben lévő számok és betűk a szöveg azon szakaszaira utalnak, ahol azokat tárgyalják.
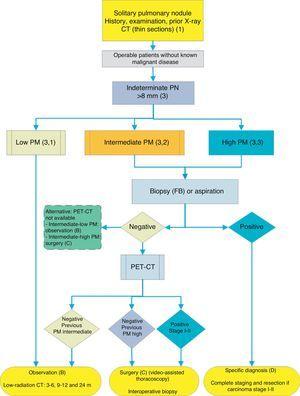
algoritmus a PN>8mm kezelésére: klinikai beállítás a PET-CT-hez való nehéz hozzáféréssel vagy az SPN citohisztológiai vizsgálatának előnyben részesítésével. FB: fiberoptic bronchoszkópia és irányított biopszia; m: hónapok; SPN: magányos pulmonalis csomó; PET-CT: pozitron emissziós tomográfia számítógépes tomográfiával; PM: malignitás valószínűsége; CT: mellkasi számítógépes tomográfia, beleértve a vékony szakaszokat is. Nyomon követés alacsony sugárzású CT-vel, feltéve, hogy nem észlelhető növekedés. A zárójelben lévő számok és betűk a szöveg azon szakaszaira utalnak, ahol azokat tárgyalják.
ajánlások a magányos Tüdőcsomó kezelésére.
| ajánlás | Gradea |
| SPN kezdeti értékelés | |
| az SPN kezelésével kapcsolatos valamennyi döntésnek tartalmaznia kell a megfelelően tájékozott beteg véleményét és preferenciáit | 1C |
| a korábbi radiológiai vizsgálatok stabilitásának vagy növekedésének értékelése, ha rendelkezésre áll | 1C |
| a szilárd SPN-ben több mint 2 évig tartó stabilitás és a jóindulatú meszesedés jóindulatot jelez, és nem igényel további értékelést | 2C |
| a CT, vékony szakaszokkal az érdekes elváltozáson keresztül, elengedhetetlen a határozatlan SPN | 1b kezdeti értékeléséhez |
| SPN betegek korábbi vagy egyidejű malignitás igényel egyénre szabott kezelése és értékelése | 1C |
| az inoperábilis betegek SPN-je individualizált kezelést igényel | 1C |
| az SPN-ek a következők lesznek: szilárd csomók> 8 mm, szilárd csomók 6 mm-esek és szubszilárd csomók | 1b |
| szilárd csomók > 8mm | |
| a PM szerint kell osztályozni: alacsony ( (>65%) | 2C |
| SPN alacsony PM: radiológiai megfigyelés | 2C |
| radiológiai megfigyelés: alacsony sugárzású CT kontraszt nélkül a 3-6., 9-12. és 24. hónapban | 2C |
| SPN közbenső PM-vel: PET-CT | 1B |
| negatív PET-CT: radiológiai megfigyelés | 2C |
| SPN-ek köztes PM-vel: a biopszia-aspiráció elfogadható alternatíva | 2C |
| nincs szövettani diagnózis: PET-CT | 1B |
| biopszia vagy aspiráció javasolt a klinikai PM és a képalkotó vizsgálatok közötti eltérés esetén | 2C |
| orvosi kezelést igénylő feltételezett etiológia (pl. tuberkulózis) | |
| a diagnosztikai műtétet elutasító vagy kifogásoló betegek | |
| SPN magas PM-vel: kezelés a korai stádiumú karcinóma feltételezett diagnózisa szerint | 2C |
| SPN magas PM-vel: FB bronchiális vizsgálattal és transzbronchiális biopsziával | 2D |
| nem diagnosztizált SPN, amelynek PM-je nagyobb, mint alacsony operálható betegeknél: SPN reszekció | 2C |
| ajánlott technika: video-asszisztált thoracoscopy | 1C |
| Interoperatív biopszia a reszekció típusának megállapításához | |
| az SPN-hez társított PNS Szubcentiméter nem lehet ellenjavallat a gyógyító karcinóma műtétre, kivéve, ha megerősítést nyer a metasztázis. | 2C |
| Spnm | |
| megfigyelési stratégia a Fleischner Társaság ajánlásait követve (ábra. 1) | 2C |
| alacsony dózisú, kontrasztmentes CT megfigyelés | 1C |
| Szubszilárd SPN-ek | |
| beavatkozás a Fleischner Társaság ajánlásai szerint (2. táblázat) | 1b-2C |
| alacsony dózisú, kontrasztmentes CT megfigyelés | 1C |
FB: fibroszkópia; PN: pulmonalis csomó; SPN: magányos pulmonalis csomó; PET: pozitron emissziós tomográfia; PM: malignitás valószínűsége; CT: számítógépes tomográfia.
ajánlási fokozat erősség (erős 1 vagy gyenge 2) és a tudományos bizonyítékok minősége szerint magas (a), közepes (B), alacsony (C) vagy nagyon alacsony (D), A besorolási rendszer szerint.
Bevezetés: koncepció és etiológia
az SPN-t egyetlen, gömb alakú, különálló radiológiai átlátszatlanságként definiálják, amelynek hosszú tengelye 30 mm, elsősorban levegőztetett tüdő veszi körül, társult atelektázis, hiláris megnagyobbodás vagy pleurális folyadékgyülem nélkül.1-3 SPNs figyelhető meg mellkasröntgen vagy mellkasi komputertomográfia (CT) más betegségek tanulmányozására vagy a tüdőrák (LC) diagnosztikai szűrésére.3,6,7 milliméteres csomók (6 mm átmérőjű) 1,2,6 és szubszilárd csomók (SSNs) 2,5 (ábra. 4), igénylő különböző menedzsment, 5-7 lehet kimutatni CT (ábra. 1). Az SSN-k magukban foglalják mind az őrölt üvegcsomókat, mind a részben szilárd csomókat, amelyek egyesítik az őrölt üvegkomponenst egy szilárd komponenssel.2,5–7
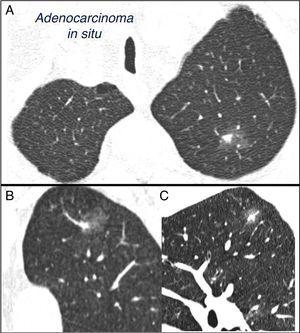
vegyes szubszilárd magányos tüdőcsomó a bal felső lebenyben. Mellkasi számítógépes tomográfia 2 mm-es vékony szakaszokkal egy olyan betegben, akinek a bal felső lebenyében magányos tüdőcsomó van. Axiális szelet (a) a felső lebenyben és koronális (B) és sagittalis (C) rekonstrukciók a bal felső lebenyben. Megfigyelhető egy 18 mm-es őrölt üveg magányos tüdőcsomó, amelynek belsejében 7 mm-es szilárd alkatrész található. A video-asszisztált torakoszkópiával végzett reszekció adenokarcinómát tárt fel.
a becslések szerint a csomók 1 vagy 2 / 1000 röntgen sebességgel fordulnak elő.1,3,8 a felnőtt dohányosoknál az LC szűrésre végzett CTS-ben a csomók prevalenciája nagyon magas, 20% és 50% között van, és általában 10 mm-nél kisebb méretűek; az egymást követő éves CTs előfordulási gyakorisága 10%.1,3,6,7
az SPNs CT-vel történő értékelésekor gyakran más kis csomók találhatók. Ha kevés vagy egy egyértelműen domináns, akkor független SPN-nek kell tekinteni őket, mivel még akkor is, ha a helyzet LC, a kísérő szubcentiméteres csomók általában jóindulatúak.1,2,6,7 ezenkívül az esetek legfeljebb 20% – ában a rosszindulatú csomó nem a legnagyobb.7
az SPN számos betegség radiológiai megnyilvánulása3 (online függelék–1s táblázat). A legtöbb csomót azonban tüdő rosszindulatú daganatok, granulomák és hamartomák okozzák.1 a malignitás prevalenciája sorozatonként változik8,9: 5% és 70% között, attól függően, hogy az adatokat az egészségügyi ellenőrzésekből vagy a diagnosztikai technikák vizsgálataiból szerezték-e be, és kisebb mértékben az LC szűrőprogramokban kimutatott SPNs-ekben, ahol a prevalencia 1% -10%, a csomó méretétől függően.3,7 az SPNs PM-je jelentősen növekszik a korábbi daganatos betegségben szenvedő betegeknél.3,10
a legtöbb rosszindulatú SPN LC, leggyakrabban adenokarcinóma és nagysejtes karcinóma.2,3 a malignus SSN-ben a leggyakoribb törzsek az adenocarcinoma spektrumban vannak,5,11,12 a legkisebb csomók atipikus adenomatosus hyperplasiája, az in situ adenocarcinoma, a minimálisan invazív adenocarcinoma és az invazív adenocarcinoma között, ha szilárd komponens van jelen, különösen a mucinosus csomókban és a lepidikus növekedésű törzsekben.5,11,12
diagnosztikai technikák a magányos pulmonalis NoduleChest számítógépes tomográfia vizsgálatában
ez a technika jelentősen felülmúlja a standard röntgenfelvételt az SPNs értékelésében.2,3 képes kimutatni más csomókat és mediastinalis lymphadenopathiákat, diagnosztizálni pseudonodulákat (extraparenchymás elváltozások), és segíteni a csomóbiopszia vagy aspiráció tervezésében. Bizonyos esetekben specifikus diagnózist adhat, például arteriovenosus rendellenességeket, mycetomákat, lekerekített atelectasiát vagy hamartomákat. Ennek megfelelően a CT elengedhetetlen, mint indexvizsgálat az SPNs vizsgálatához.2
a Nodulus enhancement vagy a kontrasztanyag felvétel 98% – os érzékenységet mutatott malignitás esetén, a határérték > 15 Hounsfield egység (HU) és a specificitás 58% volt.13 Ez alkalmazható gömb alakú, homogén SPN>8mm, zsír, kalcium kavitáció vagy nekrózis nélkül. Ez értékes lehet az ebben a technikában jártas központokban, de a PET bevezetése miatt használata nem terjedt el széles körben.3
pozitron emissziós tomográfia
A 18F-dezoxi-d-glükózzal végzett PET-CT egyik fő indikációja az SPNs vizsgálata. A szilárd SPN-ek átlagos érzékenysége> 10 – 15mm 0.93 (konfidencia intervallum 0,90-0,95) és az átlagos specificitás 0,8 (CI 0,74–0,85).2,14,15 a PET-CT hamis negatívjai hibás technikával, 7 mm-es tumorátmérővel, karcinoid tumorokkal, szubszilárd csomókkal és néhány adenokarcinómával társulnak, különösen in situ, minimálisan invazív, lepidikus növekedés vagy mucinosus adenokarcinómák.2,3 a hamis pozitív eredmények gyakoribbak, és magukban foglalják a gyulladásos és fertőző léziókat, mint például a granulomákat, a tuberkulózist, a mycosisot vagy a pneumoniákat.2,16
a PET-CT a leggyakrabban használt SPNs-ben> 8 mm közbenső PM-vel: a negatív vizsgálat nagymértékben csökkenti a PM-t.3. pozitív PET-CT esetén a nagyobb standardizált felvételi érték (SUV) nagyobb tumor agresszivitást és rosszabb prognózist jelez a beteg számára, bár a csökkent specificitást, és így a hamis pozitív esélyét figyelembe kell venni.17,18 segíthet a biopszia leghatékonyabb és legkönnyebben hozzáférhető helyének kiválasztásában, és szükség esetén a sugárterápia tervezésében is.19 A PET-CT hozzájárul a rák stádiumához2,3 a mediastinalis és a szisztémás metasztázis értékelésével, és számos LC kezelési útmutatóban ajánlott.17,18,20 ezekben az ajánlásokban a PET-CT-t kétféle módon használják: mint az SPN jellemzésének eszköze, valamint a magas PM-vel rendelkező SPN-ek staging technikájaként.
Citohisztológiai mintavétel magányos pulmonalis Nodulekomputált tomográfia, Radioszkópia vagy ultrahang-vezérelt finom tű transthoracikus aspiráció
a szakirodalom elemzése 48 vizsgálatról jó érzékenységet mutat, 86% (CI 84% -88%) a rosszindulatú daganatok diagnosztizálására és nagyon jó specificitásra, 99% (CI 98% -99%).21 15 mm-nél kisebb SPN-ekben az érzékenység alacsonyabb, 70% -82%.2,22 jóindulatú betegségben a specifitás is alacsonyabb.21 a pneumothorax átlagos aránya 15% volt, amelynek 7% – a vízelvezetést igényelt.2,21,23 a transthoracikus aspiráció ellenjavallt a betegek rossz együttműködése, nagyon sérült légzési funkció vagy egyetlen tüdő vagy vérzéses diatézis esetén, valamint emphysema vagy kiterjedt bullae jelenlétében a csomó régiójában. Az eredmények 4-50% – a nem ad diagnózist, legfeljebb 20% hamis negatív.2 ha a PM magas, akkor a valódi negatívok aránya megegyezik a hamis negatívok arányával, ezért nem hasznos a rosszindulatú daganatok kizárására.2
Fiberoptikus bronchoszkópia és kapcsolódó technikák
LC-ben a CT-vezérelt transzbronchiális aspiráció (TBA) diagnosztikai hozama a csomó megcélzására a sorozat szerint 20% – tól 80% – ig terjed, és alacsonyabb a 20 mm-nél kisebb SPN-eknél, ahol az átlagos hozam 30%.2 jóindulatú SPN-ekben a hozam 10%. Ez a technika hatékonyabb nagyobb központi csomókban (>20 mm) levegő bronchogram segítségével.2,24 kevés a TBA kockázata: pneumothorax, 2%,2 vagy ritkábban, hemoptysis vagy hematomák. Bár az SPNs diagnosztikai hozama kisebb, mint a transthoracikus finom tű aspirációs biopsziával (FNAB) kapott, endobronchialis vizsgálat elvégezhető az LC műtét megtervezése előtt.25 ultrafinom bronchoszkópia a sérülésekhez való jobb hozzáférés érdekében, vezetőhüvelyek a csipeszek elhelyezéséhez, radiális szonda ultrahang endobronchoszkópia, elektromágneses navigációs bronchoszkópia és navigációs bronchoszkópia mind értékelés alatt állnak, olyan technikák, amelyek lehetővé teszik a csipeszek vezetését a csomó felé, ezáltal javítva a hozamot.2,26 ezeket a technikákat metaanalízissel hasonlították26: a kombinált hozam 70% volt, jobb, mint a korábbi radioszkópiával irányított sorozatokban, és az egyes technikák hozama 68,5% és 73% között mozgott, bár a vizsgálatok között nagy variabilitást és heterogenitást figyeltek meg. A hozam alacsonyabb volt az SPNs20mm – ben, 61%, szemben a 80% – kal >20mm-ben. a technikák kombinálása némileg javíthatja a hozamot.2 amint az ezekből az adatokból kitűnik, a hozam szempontjából egyik technika sem múlja felül a többieket, és az ajánlás az, hogy minden Központ használja azokat a technikákat, amelyekhez mind a felszerelés, mind a szakértelem rendelkezésre áll.
Video-assisted Thoracoscopy és thoracotomia
az SPNs-ek reszekálhatók ezekkel a technikákkal.2. ha az SPN-ek kicsiek vagy a parenchyma mélyén helyezkednek el, akkor korábban festhetők vagy horoghuzallal jelölhetők, általában CT-vezérelt transthoracikus punkcióval. A video-asszisztált torakoszkópia kockázata alacsony, a mortalitás Nagyon ritka (kevesebb, mint 1%), a morbiditás alacsony, és a diagnosztikai hozam jó, hasonló a thoracotomiához, de alacsonyabb mortalitással.2 ha az SPN LC, ha a beteg klinikai helyzete megengedi, anatómiai reszekciót jeleznek: általában ajánlott a lobectomia és a mediastinalis csomópont boncolása.2,20,27
a malignitás valószínűségének becslése
a malignus SPN-ek bizonyos klinikai és radiológiai szempontból különböznek a benignus SPN-ektől, amelyeket részletesebben ismertetünk ezen irányelvek kibővített változatában (lásd az online kiegészítést). A malignitással leginkább összefüggő tényezők az SPN mérete, a margó jellemzői, a sűrűség, a beteg kora, a felhalmozódott dohányfogyasztás, egyéb malignitás megléte és a növekedés kimutatása.Az SPN 2,3,6,7,10,28-30 központi, lamináris vagy teljes meszesedése jó kritériumnak tekinthető a jóindulat szempontjából, 2,3 mint a radiológiai stabilitás több mint 24 hónapig, ami 730 nap feletti megduplázódási időt jelent. Ez a kritérium nem érvényes az SSN-re, amely esetében a megfigyelést legalább 3 évre kell meghosszabbítani.1-3, 5
a legtöbb klinikus intuitív módon becsüli meg a PM–t,de számos SPN modellt és osztályozási szabályt javasoltak7, 28-32 és még számológépek is elérhetők online (online függelék-2s Táblázat) vagy okostelefon alkalmazásként (Medcalc orvosi számológép). Az online függelék 2S táblázata különböző logisztikai modellekből nyert képleteket tartalmaz, az 1s ábra pedig érvényes nomogram a mellkasröntgen SPN-jére.
ez a PM-becslés irányítja a későbbi diagnosztikai folyamatot.1,2,31 logikusan, a malignitás előrejelzésekor az összes vizsgálati technika eredményeit felülvizsgálják, beleértve a PET-CT eredményeket, 31,32 a biopsziás vagy aspirációs eredményeket, valamint a növekedés értékelését, ha megfelelő képek állnak rendelkezésre.
a PM mellett értékelni kell a kezelés várható előnyeit és kockázatait. Van egy PM küszöbérték, amely jelzi a megfigyelést, azaz minden olyan PM, amelynél a legésszerűbb lehetőség az SPN stabilitásának vagy növekedésének prospektív megfigyelése; és a műtét küszöbértéke, amelyre a műtét egyértelműen ajánlott, mivel a korai stádiumú rák valószínűsége magas. Ezek a küszöbértékek a várható előnyöktől függenek; például a gyógyulás valószínűsége vagy a kezelésre adott válasz rosszindulatú betegség esetén, a műtéti kockázatok, amelyek betegenként változhatnak, valamint a beteg személyes hozzáállása és preferenciája.1
a magányos Tüdőcsomó szekvenciális értékelése
az SPN értékelésének célja az aktív betegséget, különösen az LC-t képviselő SPNs diagnosztizálása és kezelése, mivel az 5 éves túlélés 70% -80% a korai stádiumban betegség.20 Egy másik cél a granulomákkal, hamartómákkal és más jóindulatú elváltozásokkal rendelkező betegek költséges és kockázatos kezeléseknek való alávetésének elkerülése. Nincs külön elfogadott eljárás. Az értékelés legfontosabb elemei a malignitás valószínűségének becslése, a különböző diagnosztikai tesztekhez való hozzáférés és a klinikusok szakértelme ezekben a technikákban, valamint a beteg preferenciái.1,2
füge. 1-3 mutassa be az SPN javasolt szekvenciális értékelését: ábra. Az 1. ábra leírja a kezdeti osztályozást SPN méret, sűrűség és szilárdság vagy szubszoliditás szerint, elkülönítve azokat a betegeket, akik személyre szabott kezelést igényelnek, és azokat, akiket a kezdetektől diagnosztizálni lehet. Füge. A 2.és 3. ábra leírja a meghatározatlan szilárd SPN-ek javasolt stratégiáját>8 mm, attól függően, hogy a PET-CT-hez való hozzáférés könnyű-e (ábra. 2) vagy nehezebb (ábra. 3).
klinikai és kezdeti radiológiai Értékelés (1)
a kezdeti vizsgálat magában foglalja a kórtörténetet, a vizsgálatot és a radiológiai jellemzők értékelését, valamint az összes rendelkezésre álló korábbi röntgensugárral való összehasonlítást2,31: ajánlási fokozat, 1C.
ha nincs bizonyíték a >2 év stabilitására vagy jóindulatú meszesedésre, akkor a CT-t vékony szakaszokkal jelölik az érdekes csomón keresztül2: ajánlási fokozat, 1b.
egyes csomók ebben a fázisban jóindulatúnak minősíthetők, ha több mint 2 évig stabilnak tűnnek,vagy a CT2, 31 jellemzői alapján: ajánlási fokozat, 2C.
határozatlan SPN-ekben a megfigyelés folytatódik, a beteg jellemzőitől és a csomó radiológiai jellemzőitől függően.
különleges helyzetben lévő betegek (2)
a beteg helyzete különlegesnek tekinthető az SPN etiológiai gyakoriságának vagy PM-jének megváltozása miatt, vagy azért, mert az eljárás a műtéti kockázatok miatt nem invazív technikákra korlátozódik.
korábban vagy egyidejűleg malignus betegségben szenvedő betegek. A pulmonalis csomók PM-je, akár egyszeri, akár többszörös,ezekben a betegekben jelentősen megnő,3, 10, még akkor is, ha kicsi.6 a metasztázis lehetősége még nagyobb, ha az SPNs korábban nem volt jelen. Ennek ellenére, ha az SPNs szubcentimetrikus, legfeljebb egyharmada jóindulatú, ezért a diagnózist biopsziával, aspirációval vagy video-asszisztált torakoszkópiával kell megerősíteni, mielőtt megtagadnák a potenciálisan gyógyító kezeléseket: ajánlási fokozat, 2C.2,10 SPNs immunhiányos betegeknél személyre szabott értékelést igényel, és a biopszia vagy aspiráció előnyös.33
inoperábilis betegeknél az SPN értékelése korlátozott. A biopszia vagy aspiráció magas PM-vel vagy pozitív eredménnyel járó esetekben javallt pet, kemoterápia vagy sugárterápia irányítására, ha LC kezelésre van szükség: ajánlási fokozat, 2C.
magányos Tüdőcsomó>8 mm (3) (ábra. 2. és 3.)
az első lépés a beteg besorolása a becsült PM szerint: alacsony (??5%), közepes vagy magas (> 65%) 1,2,29,31: ajánlási fokozat, 1C.
a rosszindulatú daganatok alacsony valószínűsége (3, 1)
az alacsony PM értéke kevesebb, mint 5%.2,31 ide tartoznak a még mindig kicsi (
mm) SPN–ek, különálló margókkal, fiatalabb betegek (2,28-32,34 ezekben az esetekben radiológiai megfigyelés ajánlott2, 31: ajánlási fokozat,2C.
ide tartoznak a közbenső PM-vel és negatív PET-CT-vel rendelkező SPN-k is, vagy azok, amelyeket fnab-val értékeltek, amelyek nem rosszindulatú daganatot mutatnak2: ajánlási fokozat, 2C.
a malignitás közepes valószínűsége (3, 2)
a PM közötti 5% és 65% köztes.2,28 – 32,34 ezekben az esetekben a PET-CT nem invazív, alacsony kockázatú és nagy diszkriminatív hatású (ábra. 2): ajánlási fokozat, 1B. a negatív eredmény jelentősen csökkenti a PM-t, és megfigyelés ajánlható; a pozitív eredmény növeli a PM-t, és magasnak minősíti.2,31
a PET-CT elvégzésének elérhetőségétől és várakozási idejétől függően alternatív eljárás a CT-vezérelt FNAB vagy fiberoptic bronchoszkópia (FB)-TBA radioszkópiával, ultrahang endoszkópiával vagy elektromágneses vagy virtuális navigációval (ábra. 3): ajánlási fokozat, 2C. A biopsziás lehetőség különösen akkor ajánlott, ha a klinikai PM és a képalkotó vizsgálatok eredményei ellentmondásosak, ha speciális orvosi kezelést igénylő etiológiák (pl. tuberkulózis) gyanúja merül fel, vagy ha a beteg kedvezőtlen a műtétre2: ajánlási fokozat, 2C.
a biopszia vagy aspirációs technikák megismétlése kezdeti negativitás esetén csak akkor ajánlott, ha az SPN PM-je magas, és a műtét előtti diagnózist szükségesnek tartják, vagy ha a műtét ellenjavallt.
ha az eredmény negatív, PET-CT ajánlott (ábra. 3): ajánlási fokozat, 1B. ha nem áll rendelkezésre PET-CT, az alternatíva a CT-vel történő monitorozás lenne, különösen, ha az FNAB negatív volt, vagy műtét.
a malignitás nagy valószínűsége (3, 3)
PM magas az 50 évesnél idősebb betegeknél, akiknek kórtörténetében dohányzás vagy a malignitás radiológiai jellemzői vannak: SPN>15 mm, spekulált margók vagy heterogén sűrűség. A PET-CT-n hipermetabolikus SPNs-ek, azok, amelyek mérete megnőtt vagy megváltozott, valamint azok, akiknek citológiai vagy tüdőbiopsziája rosszindulatú daganatra utal, szintén magas PM-vel rendelkeznek.2,28-32,34
ezekben az esetekben egyes szerzők közvetlen diagnosztikai-terápiás műtétet javasolnak, mások pedig a biopsziás technikákat részesítik előnyben.2,31 az algoritmus által kiválasztott populációban, amikor más rákos betegeket kizártak, a legtöbb SPN tüdőrák. Így az ajánlás az,hogy ilyen módon kezeljék őket, 2 A PET-CT-t ajánlották módszerként a staging17,18: ajánlási fokozat, 2C.
a műtét előtti szövettani diagnózis meghatározható az FB-TBA alkalmazásával, amely technika lehetővé teszi a hörgőfa értékelését a műtét megkezdése előtt, vagy az FNAB segítségével. A negatív eredmény nem csökkenti eléggé a PM-t, hogy kizárja az SPN reszekcióját. Az SPN műtét előtti diagnosztizálásának hatékonyságát magas PM-vel, az I. vagy II.klinikai stádiumban CT-vel és PET-CT-vel, feltéve, hogy a beteg operálható, nem vizsgálták. Ezért ezt opcióként kínálják az algoritmusban (ábra. 2), bár a műtét előtti értékelés az FB-vel szokásos gyakorlat: ajánlási fokozat, 2C.
ha a PET-CT metasztázisra utaló mediastinalis vagy extrathoracikus emelkedéseket tár fel, ezeket ki kell értékelni a reszekció előtt műtét.17,18 ha a magas PM-vel rendelkező SPN negatív a PET-CT-n, a PM nem eléggé csökken a megfigyelés ajánlásához, 2 és reszekció video-asszisztált torakoszkópiával ajánlott: ajánlási fokozat, 2C. az alacsonyabb felvétel azonban jobb prognózist és kisebb terjesztési valószínűséget sugall, ami figyelembe vehető, ha a betegnek erős kifogása van a műtét ellen.3,31
a javasolt stratégiában a magas PM-vel rendelkező SPN értékelésének specifikus diagnózissal vagy diagnosztikai-terápiás reszekcióval kell zárulnia (ábra. 2 és 3).
magányos pulmonalis csomó mm (4)
ezeknek az SPN-knek a prevalenciája nagyon magas a CT-vizsgálatokban, a PM pedig alacsony, kivéve, ha kórtörténetében korábbi vagy egyidejű áttétes daganat szerepel.2,6 a biopsziák megszerzéséhez nehezen hozzáférhetők, a PET-CT és a dinamikus CT érzékenysége pedig nagyon alacsony.2,6 a Fleischner Társaság ajánlásait követő megfigyelési stratégia6 (ábra. 1) javasolt, figyelembe véve tünetmentes betegek egyidejű rosszindulatú betegség nélkül: ajánlási fokozat, 2C.
a nyomon követést alacsony dózisú, kontrasztmentes CT6: ajánlási fokozat, 1C. ismét tájékoztatni kell a beteget, és figyelembe kell venni preferenciáit.2
Szubszilárd pulmonalis csomó (5)
ezek tiszta vagy szilárd komponensű őrölt üvegcsomók5 (ábra. 4). A szubszilárd csomó meghatározásához vékony, előnyösen 1 mm-es szakaszokra van szükség, mivel az 5 mm-es CT szeletekben lévő kis szilárd SPN-ek őrölt üvegként jelenhetnek meg.2,5
az SSN-k nehezen hozzáférhetők biopsziához vagy aspirációhoz, és a PET-CT érzékenysége alacsony.5,35 ezzel szemben a PM-jük viszonylag magas, 15% vagy több az őrölt üveg SPN esetében, és több mint 50% a kevert csomó esetében.5 ezen elváltozások méretének vagy térfogatának változását is nehezebb megállapítani a megfigyelés során, és az ebben a formában megjelenő rosszindulatú daganatok hosszabb ideig indolensek lehetnek,ezért a megfigyelési időszaknak hosszabbnak, 5-nek, azaz legalább 3 évnek kell lennie.
mivel sok jóindulatú etiológia akut vagy szubakut folyamat, javasolt egy kezdeti megfigyelési stratégia CT-vel 3 hónapon belül, mivel egyes SPN-k eltűnhetnek. Ha továbbra is fennállnak, a stratégiát az SPN mérete határozza meg, ha szilárd komponensük van, és ha egy vagy több (ábra. 1). A 2. táblázat részletesen felsorolja a Fleischner Társaság által javasolt ajánlásokat.5
Szubszilárd csomók kezelése.
| ajánlási fokozata | ||||
| földi üveg SPN | ||||
| ≤5mm | nincs nyomon követés | 1C | ||
| >5mm | CT 3 hónapnál | perzisztens | éves Ctkövetés >3 év | 1B |
| részben szilárd SPN (szilárd rész) | ||||
| mm | CT 3 hónapnál | perzisztens | éves Ctkövetés >3 év | 2C |
| ≥5mm | CT 3 hónapnál | perzisztens | biopszia, reszekció, PET-CT, ha szilárd rész >10mm | 1B |
| több őrölt üveg PN | ||||
| ≤5mm | fontolja meg a nem rosszindulatú okokat | CT 2 és 4 éves korban | 1C | |
| >5mm | CT 3 hónapnál | perzisztens | éves Ctkövetés > 3 év | 1B |
| többszörös PN szilárd komponenssel | CT 3 hónap | tartós | biopszia, reszekció, különösen, ha szilárd rész >5mm | 1C |
PN: tüdőcsomó; SPN: magányos tüdőcsomó; PET: pozitron emissziós tomográfia; CT: számítógépes tomográfia. Az ajánlási fokozat a Fleischner Társaság által javasolt, 5 az osztályozási rendszer alapján. Az American College of Chest Physicians ajánlásai2 csökkenti az ajánlás erősségét egy fokozattal. Az értékeléshez szükséges CT-nek finom szeletnek kell lennie, a nyomon követés pedig alacsony dózisú CT.
ajánlási fokozat erősség (erős 1 vagy gyenge 2) és a tudományos bizonyítékok minősége szerint magas (a), közepes (B), alacsony (C) vagy nagyon alacsony (D), A besorolási rendszer szerint.
végső lehetőségek Az értékelés után
- A.
a jóindulat diagnózisa: A CT-n specifikus diagnózissal rendelkező betegek, például hamartomák, arteriovenosus rendellenességek, cisztás elváltozások, lekerekített atelectasis, mycetomák, pseudonodules vagy meszesedett csomók, vagy akiknek jóindulati kritériumai vannak, pl. dokumentált stabilitás legalább 2 évig, szilárd csomók esetén, vagy legalább 3 év szubszilárd csomók esetén2,3: ajánlási fokozat, 2C.
- B.
radiológiai megfigyelés: SPNs-ben alacsony PM-vel vagy köztes PM-vel jelölve, ha a PET-CT negatív, ajánlási fokozat, 2C. Ez a nem diagnosztizált SPN-ekben is jelezhető, ha a műtét kockázata nagyon magas, vagy ha a beteg megtagadja a műtétet: ajánlási fokozat, 2C.
alacsony PM-vel rendelkező SPN>8 mm esetén a CT-monitorozás ajánlott 3-6 hónapon belül, ismét 9-12 hónapon belül, majd ismét 24 hónapon belül.2 Vannak speciális stratégiák SPN 6mm és SSN2, 5 ,6 (ábra. 1 és 2. táblázat): ajánlási fokozat, 2C. a felügyeleti CTs-t alacsony dózisú és kontrasztmentes: ajánlási fokozat, 1C.
- C.
diagnosztikai-terápiás sebészet: Operálható betegek diagnosztizálatlan SPN-vel és PM-vel az alacsonynál nagyobb reszekciót kell felajánlani: ajánlási fokozat, 2C. bár a video-asszisztált thoracoscopy a választott módszer (ajánlási fokozat, 1C), minden műtéti csapat dönt a legjobb megközelítésről. Intraoperatív biopszia ajánlott a megfelelő reszekció befejezéséhez LC esetén: ajánlási fokozat, 1C.
- D.
specifikus diagnózis: ez az SPN etiológiai diagnózisa. Ha LC-t diagnosztizálnak, specifikus helyi stádiumot és kezelési protokollokat alkalmaznak.20
az algoritmus nem fejezhető be anélkül, hogy újra hangsúlyoznánk, hogy az optimális döntésnek tartalmaznia kell a megfelelően tájékozott beteg véleményét és preferenciáit2: ajánlási fokozat, 1C.
összeférhetetlenség
a szerzők kijelentik, hogy nincs összeférhetetlenségük.