Ziele
Ziel dieser Leitlinien ist es, die Entscheidungsfindung bei der Behandlung von Patienten mit einem solitären Lungenknoten (SPN) zu erleichtern.1-3 Diese Richtlinien sollen nicht starr sein, da die Behandlung von SPN ein Beispiel dafür ist, wie Schätzung der Wahrscheinlichkeit von Malignität (PM), Zugang zu den verschiedenen diagnostischen und therapeutischen Techniken und Patientenpräferenzen wirken zusammen, um die optimale Entscheidung zu treffen. Dieser Prozess sollte im klinischen Umfeld und für jede einzelne Situation individualisiert werden. Da die Zugänglichkeit zu einigen Diagnosetechniken je nach Einstellung variieren kann, wird ein allgemeiner strategischer Algorithmus vorgeschlagen (Abb. 1) mit zwei Alternativen, je nach Zugänglichkeit zur Positronen-Emissions-Tomographie (PET) (Fig. 2 und 3). Die Empfehlungen wurden nach Stärke (stark 1, schwach 2) basierend auf dem Verhältnis zwischen dem vorhersehbaren Nutzen und den Risiken für den Patienten bewertet; und die Qualität der wissenschaftlichen Beweise, wie hoch (A), moderat (B), niedrig (C) oder sehr niedrig (D), nach dem Notensystem.4 Eine Zusammenfassung dieser Empfehlungen2,4,6 ist in Tabelle 1 wiedergegeben. Die erweiterte Version dieser Empfehlungen ist als Online-Beilage zusammen mit zusätzlichen Tabellen und Abbildungen (Anlage 1) verfügbar.
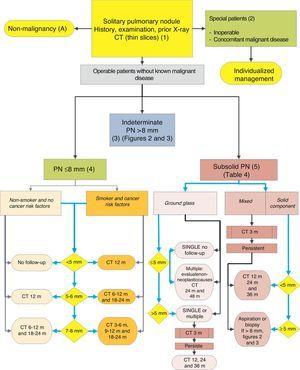
Algorithmus für das Management von PN: anfängliche Klassifizierung und Beobachtung von SPN≤8mm und subsolid SPN. m: Monate, PN: Lungenknoten; SPN: solitärer Lungenknoten; CT: Computertomographie, einschließlich Dünnschnitte. Follow-up mit strahlungsarmer CT, sofern kein Wachstum festgestellt wird. Zahlen und Buchstaben in Klammern beziehen sich auf die Abschnitte im Text, in denen sie besprochen werden.
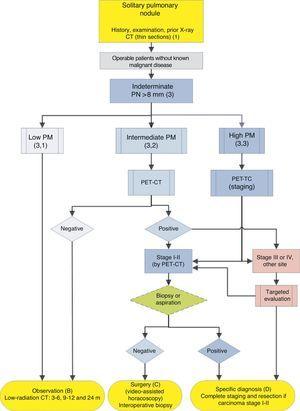
Algorithmus für das Management von PN>8mm: klinisches Setting mit einfachem Zugang zu PET-CT. m: Monate, PN: Lungenknoten; SPN: solitärer Lungenknoten; PET-CT: Positronen-Emissions-Tomographie mit Computertomographie; PM: Wahrscheinlichkeit einer Malignität; CT: Brust-Computertomographie, einschließlich Dünnschnitte. Follow-up mit strahlungsarmer CT, sofern kein Wachstum festgestellt wird. Zahlen und Buchstaben in Klammern beziehen sich auf die Abschnitte im Text, in denen sie besprochen werden.
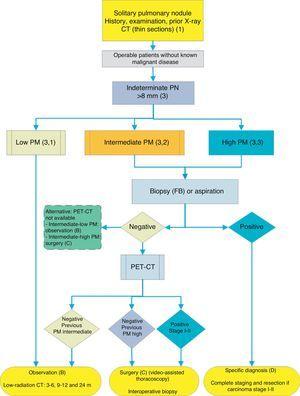
Algorithmus für das Management von PN>8mm: klinisches Setting mit schwierigem Zugang zu PET-CT oder Präferenz für zytohistologische Untersuchung von SPN. FB: faseroptische Bronchoskopie und geführte Biopsie; m: Monate; SPN: solitärer Lungenknoten; PET-CT: Positronen-Emissions-Tomographie mit Computertomographie; PM: Wahrscheinlichkeit einer Malignität; CT: Brust-Computertomographie, einschließlich Dünnschnitte. Follow-up mit strahlungsarmer CT, sofern kein Wachstum festgestellt wird. Zahlen und Buchstaben in Klammern beziehen sich auf die Abschnitte im Text, in denen sie besprochen werden.
Empfehlungen für die Behandlung von solitären Lungenknoten.
| Empfehlung | Gradea |
| SPN Erstbewertung | |
| Alle Entscheidungen über das Management eines SPN müssen die Meinung und Präferenzen des entsprechend informierten Patienten enthalten | 1C |
| Bewerten Sie die Stabilität oder das Wachstum in früheren radiologischen Studien, falls verfügbar | 1C |
| Stabilität für mehr als 2 Jahre in festem SPN und gutartiger Verkalkung weisen auf eine Gutartigkeit hin und erfordern keine weitere Bewertung | 2C |
| Die CT mit Dünnschnitten durch die interessierende Läsion ist für die Erstbewertung des unbestimmten SPN | 1B |
| SPN bei Patienten mit vorheriger oder gleichzeitiger Malignität erfordern eine individuelle Behandlung und Bewertung | 1C |
| SPNs bei inoperablen Patienten erfordern eine individuelle Behandlung | 1C |
| SPNs werden klassifiziert als feste Knötchen > 8 mm, feste Knötchen≤8 mm und subsolide Knötchen | 1B |
| Feste Knötchen>8mm | |
| Sollte nach PM klassifiziert werden: niedrig ( (>65%) | 2C |
| SPN mit niedriger PM: radiologische Beobachtung | 2C |
| Radiologische Beobachtung: strahlungsarme CT ohne Kontrast nach 3-6, 9-12 und 24 Monaten | 2C |
| SPN mit Zwischen-PM: PET-CT | 1B |
| Negative PET-CT: radiologische Beobachtung | 2C |
| SPNs mit intermediärem PM: biopsie-Aspiration ist eine akzeptable Alternative | 2C |
| Keine histologische Diagnose: PET-CT | 1B |
| Eine Biopsie oder Aspiration ist ratsam, wenn die klinischen PM- und Bildgebungstests nicht übereinstimmen | 2C |
| Vermutete Ätiologie, die eine medizinische Behandlung erfordert (z. B. Tuberkulose) | |
| Patienten, die eine diagnostische Operation ablehnen oder ablehnen | |
| SPN mit hohem PM: management gemäß vermuteter Diagnose eines Karzinoms im Frühstadium | 2C |
| SPN mit hoher PM: FB mit Bronchialuntersuchung und transbronchialer Biopsie | 2D |
| Nicht diagnostizierter SPN mit PM größer als niedrig bei operierbaren Patienten: SPN-Resektion | 2C |
| Empfohlene Technik: videogestützte Thorakoskopie | 1C |
| Interoperative Biopsie zur Feststellung der Art der Resektion | |
| Subzentimeter-PNs in Verbindung mit SPN sollte keine Kontraindikation für eine kurative Karzinomchirurgie darstellen, es sei denn, es liegt eine Bestätigung der Metastasierung vor. | 2C |
| SPNMM | |
| Beobachtungsstrategie nach Empfehlungen der Fleischner-Gesellschaft (Abb. 1) | 2C |
| Niedrigdosierte, kontrastfreie CT-Überwachung | 1C |
| Subsolid SPNs | |
| Intervention nach Empfehlungen der Fleischner-Gesellschaft (Tabelle 2) | 1B bis 2C |
| Niedrigdosierte, kontrastfreie CT-Überwachung | 1C |
FB: Fibroskopie; PN: Lungenknoten; SPN: solitärer Lungenknoten; PET: Positronen-Emissions-Tomographie; PM: Wahrscheinlichkeit von Malignität; CT: Computertomographie.
Empfehlungsgrad nach Stärke (stark 1 oder schwach 2) und Qualität der wissenschaftlichen Evidenz als hoch (A), mäßig (B), niedrig (C) oder sehr niedrig (D), je nach Notensystem.
Einleitung: Konzept und Ätiologie
SPN ist definiert als eine einzelne, sphärische, ausgeprägte radiologische Opazität mit einer langen Achse von ≤30 mm, die hauptsächlich von einer belüfteten Lunge umgeben ist und keine damit verbundene Atelektase, Hilusvergrößerung oder Pleuraerguss aufweist.1-3 SPNs können auf Röntgenaufnahmen des Brustkorbs oder der Computertomographie des Brustkorbs (CT) beobachtet werden, die zur Untersuchung anderer Krankheiten oder zum diagnostischen Screening auf Lungenkrebs (LC) durchgeführt werden.3,6,7 Millimeterknoten (≤8 mm Durchmesser)1,2,6 und subsolide Knötchen (SSNs)2,5 (Abb. 4), die ein anderes Management erfordern, können 5-7 im CT nachgewiesen werden (Abb. 1). SSNs umfassen sowohl gemahlene Glasknoten als auch teilweise feste Knoten, die eine gemahlene Glaskomponente mit einer festen Komponente kombinieren.2,5–7
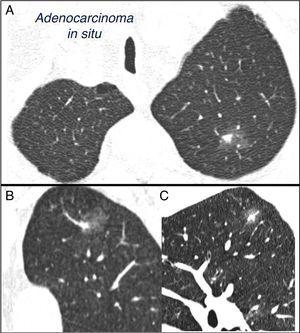
Gemischter subsolider solitärer Lungenknoten im linken Oberlappen. Thorax-Computertomographie mit 2mm Dünnschnitten bei einem Patienten mit einem solitären Lungenknoten im linken Oberlappen. Axialschnitt (A) im Oberlappen und koronale (B) und sagittale (C) Rekonstruktionen im linken Oberlappen. Ein 18-mm-Schliffglas-Solitär-Lungenknoten wird beobachtet, mit einer 7-mm-Feststoffkomponente im Inneren. Die Resektion durch videoassistierte Thorakoskopie ergab ein Adenokarzinom.
Es wird geschätzt, dass Knötchen mit einer Rate von 1 oder 2 pro 1000 Röntgenstrahlen auftreten.1,3,8 Die Prävalenz von Knötchen bei CTs, die bei erwachsenen Rauchern für das LC-Screening durchgeführt wurden, ist sehr hoch, zwischen 20% und 50% und im Allgemeinen kleiner als 10 mm; Die Inzidenz bei aufeinanderfolgenden jährlichen CTs beträgt 10%.1,3,6,7
Bei der Auswertung von SPNs mit CT werden häufig andere kleine Knötchen gefunden. Wenn sie wenige sind oder einer eindeutig dominant ist, sollten sie als unabhängige SPNs betrachtet werden, da begleitende Subzentimeterknoten, selbst wenn die Situation schwierig ist, häufig gutartig sind.1,2,6,7 Darüber hinaus ist der maligne Knoten in bis zu 20% der Fälle nicht der größte.7
SPN ist die radiologische Manifestation vieler Krankheiten3 (Online-Anhang-Tabelle 1S). Die meisten Knötchen werden jedoch durch pulmonale Malignome, Granulome und Hamartome verursacht.1 Die Prävalenz der Malignität variiert zwischen den Serien8,9: zwischen 5% und 70%, je nachdem, ob die Zahlen aus Gesundheitschecks oder Studien zu diagnostischen Techniken stammen, und in geringerem Maße bei SPNs, die in LC-Screening-Programmen nachgewiesen wurden Die Prävalenz beträgt 1% -10%, abhängig von der Knötchengröße.3,7 Bei Patienten mit vorangegangener Tumorerkrankung nimmt die PM des SPNs deutlich zu.3,10
Die meisten malignen ZNS sind LC, am häufigsten Adenokarzinome und großzellige Karzinome.2,3 Bei malignen SSN liegen die häufigsten Stämme im Adenokarzinomspektrum,5,11,12 zwischen atypischer adenomatöser Hyperplasie in den kleinsten Knötchen, Adenokarzinom in situ, minimalinvasivem Adenokarzinom und invasiven Adenokarzinomen, wenn eine feste Komponente vorhanden ist, insbesondere in muzinösen Knötchen und solchen mit lepidischem Wachstum.5,11,12
Diagnostische Techniken bei der Untersuchung des solitären Lungenknotensbrust-Computertomographie
Diese Technik ist der Standard-Röntgenaufnahme bei der Beurteilung des SPNs weit überlegen.2,3 Es kann andere Knötchen und mediastinale Lymphadenopathien erkennen, Pseudonodule (extraparenchymale Läsionen) diagnostizieren und bei der Planung einer Knötchenbiopsie oder Aspiration helfen. In einigen Fällen kann eine spezifische Diagnose gestellt werden, z. B. arteriovenöse Missbildungen, Mycetome, abgerundete Atelektasen oder Hamartome. Dementsprechend ist die CT als Indexuntersuchung für die Untersuchung des SPNs unerlässlich.2
Knötchenverstärkung oder Kontrastmittelaufnahme zeigten eine Sensitivität von 98% für Malignität mit einem Cutoff von > 15 Hounsfield-Einheiten (HU) und einer Spezifität von 58%.13 Dieses ist auf kugelförmigen, homogenen SPNs>8mm, ohne Fett, Kalziumhohlraumbildung oder Nekrose anwendbar. Dies kann in Zentren mit Fachwissen in dieser Technik wertvoll sein, aber aufgrund der Einführung von PET ist seine Verwendung nicht weit verbreitet.3
Positronen-Emissions-Tomographie
Eine der Hauptindikationen für die PET-CT mit 18F-Desoxy-d-Glucose ist die Untersuchung von SPNs. Die mittlere Empfindlichkeit für feste SPNs > 10-15 mm beträgt 0.93 (Konfidenzintervall 0,90-0,95) und die mittlere Spezifität beträgt 0,8 (KI 0,74–0,85).2,14,15 Falsch-negative Ergebnisse auf PET-CT sind mit defekter Technik, Tumordurchmesser7 mm, Karzinoidtumoren, subsoliden Knötchen und einigen Adenokarzinomen assoziiert, insbesondere in situ, minimal invasiv, lepidisches Wachstum oder muzinöses Adenokarzinom.2,3 Fehlalarme sind häufiger und umfassen entzündliche und infektiöse Läsionen wie Granulome, Tuberkulose, Mykosen oder Pneumonien.2,16
PET-CT ist am nützlichsten bei SPNs > 8mm mit intermediärer PM: Eine negative Studie reduziert PM stark.3 In einem positiven PET-CT deutet ein größerer standardisierter Aufnahmewert (SUV) auf eine größere Tumoraggressivität und eine schlechtere Prognose für den Patienten hin, obwohl seine verringerte Spezifität und damit die Wahrscheinlichkeit eines falsch positiven Ergebnisses berücksichtigt werden muss.17,18 Es kann auch helfen, die effizienteste und zugänglichste Stelle für die Biopsie auszuwählen und gegebenenfalls bei der Planung der Strahlentherapie zu helfen.19 PET-CT trägt zur Krebsstadienbildung bei2,3 durch Bewertung der mediastinalen und systemischen Metastasierung und wird in vielen LC-Managementrichtlinien empfohlen.17,18,20 In diesen Empfehlungen wird PET-CT auf zwei Arten verwendet: als Werkzeug zur Charakterisierung des SPN und als Staging-Technik in SPNs mit hoher PM.
Zytohistologische Probenahme von solitären Lungenknotencomputertomographie, Radioskopie oder ultraschallgeführte transthorakale Feinnadelaspiration
Eine Analyse der Literatur zu 48 Studien zeigt eine gute Sensitivität, 86% (CI 84% -88%), für die Diagnose von Malignität und eine sehr gute Spezifität, 99% (CI 98% -99%).21 In SPNs kleiner als 15mm, empfindlichkeit ist niedriger, bei 70%-82%.2,22 Bei gutartigen Erkrankungen ist die Spezifität ebenfalls geringer.21 Die mittlere Pneumothoraxrate betrug 15%, von denen 7% entwässert werden mussten.2,21,23 Die transthorakale Aspiration ist kontraindiziert bei schlechter Patientenzusammenarbeit, sehr eingeschränkter Atemfunktion oder einzelner Lunge oder hämorrhagischer Diathese sowie bei Emphysem oder ausgedehnten Blasen im Bereich des Knotens. Zwischen 4% und 50% der Ergebnisse liefern keine Diagnose und bis zu 20% sind falsch negativ.2 Wenn PM hoch ist, ist die Rate der wahren Negative dieselbe wie die der falschen Negative.2
Faseroptische Bronchoskopie und zugehörige Techniken
In LC liegt die diagnostische Ausbeute der CT-gesteuerten transbronchialen Aspiration (TBA) zum Anvisieren des Knotens gemäß der Serie zwischen 20% und 80% und ist bei SPNs kleiner als 20 mm niedriger, wobei die mittlere Ausbeute 30% beträgt.2 In gutartigen SPNs beträgt die Ausbeute 10%. Diese Technik ist bei größeren zentralen Knötchen (> 20 mm) unter Verwendung eines Luftbronchogramms wirksamer.2,24 Es besteht ein geringes Risiko für TBA: Pneumothorax, 2%,2 und seltener Hämoptysen oder Hämatome. Obwohl die diagnostische Ausbeute für SPNs geringer ist als bei der transthorakalen Feinnadelaspirationsbiopsie (FNAB), kann vor der Planung einer LC-Operation eine endobronchiale Untersuchung durchgeführt werden.25 Ultrafeine Bronchoskopien für einen besseren Zugang zu Läsionen, Führungshüllen zur Positionierung der Zange, radiale Sondenultraschallendobronchoskopie, elektromagnetische Navigationsbronchoskopie und Navigationsbronchoskopie werden alle bewertet, wobei es sich um Techniken handelt, mit denen die Zange in Richtung des Knotens geführt werden kann, wodurch die Ausbeute verbessert wird.2,26 Diese Techniken wurden in einer Meta-Analyse26 verglichen: die kombinierte Ausbeute betrug 70%, besser als in früheren Radioskopie-geführten Serien, und die Ausbeuten der einzelnen Techniken reichten von 68,5% bis 73%, obwohl große Variabilität und Heterogenität zwischen den Studien beobachtet wurden. Die Ausbeute war in SPNs20mm niedriger, 61% gegenüber 80% in > 20mm. Kombinationstechniken können die Ausbeute etwas verbessern.2 Wie aus diesen Daten hervorgeht, übertrifft keine Technik insbesondere andere in Bezug auf den Ertrag, und es wird empfohlen, dass jedes Zentrum die Techniken verwendet, für die sowohl Ausrüstung als auch Fachwissen verfügbar sind.
Videoassistierte Thorakoskopie und Thorakotomie
Mit diesen Techniken können SPNs reseziert werden.2 Wenn die SPNs klein sind oder sich tief im Parenchym befinden, können sie zuvor mit einem Hakendraht gefärbt oder markiert werden, im Allgemeinen mit CT-gesteuerter transthorakaler Punktion. Die Risiken der videoassistierten Thorakoskopie sind gering und die Mortalität ist sehr selten (weniger als 1%), die Morbidität ist gering und die diagnostische Ausbeute ist gut, ähnlich wie bei der Thorakotomie, jedoch mit geringerer Mortalität.2 Wenn der SPN LC ist und die klinische Situation des Patienten dies zulässt, ist eine anatomische Resektion angezeigt: im Allgemeinen werden Lobektomie und mediastinale Knotendissektion empfohlen.2,20,27
Abschätzung der Malignitätswahrscheinlichkeit
Maligne SPNs unterscheiden sich von benignen SPNs in bestimmten klinischen und radiologischen Aspekten, die in der erweiterten Version dieser Leitlinien ausführlicher beschrieben sind (siehe Online-Beilage). Die Faktoren, die am engsten mit Malignität verbunden sind, sind die Größe des SPN, Randmerkmale, Dichte, Alter des Patienten, akkumulierter Tabakkonsum, Vorhandensein anderer Malignitäten und Nachweis von Wachstum.2,3,6,7,10,28-30 Die zentrale, laminare oder totale Verkalkung des SPN wird als gutes Kriterium für die Benignität angesehen,2,3 ebenso wie die radiologische Stabilität für mehr als 24 Monate, was eine Verdopplungszeit von über 730 Tagen impliziert. Dieses Kriterium gilt nicht für SSN, für die die Beobachtung auf mindestens 3 Jahre verlängert werden muss.1-3,5
Die meisten Kliniker schätzen PM intuitiv, aber es wurden mehrere SPN–Modelle und Klassifizierungsregeln vorgeschlagen7,28-32 und es gibt sogar Taschenrechner online (Online-Anhang-Tabelle 2S) oder als Smartphone-Anwendung (Medcalc Medical calculator). Tabelle 2S des Online-Anhangs enthält eine Reihe von Formeln, die aus verschiedenen logistischen Modellen erhalten wurden, und Abbildung 1S ist ein gültiges Nomogramm für SPNs im Röntgenbild des Brustkorbs.
Diese Schätzung von PM leitet den nachfolgenden Diagnoseprozess.1,2,31 Logischerweise werden bei der Vorhersage der Malignität die Ergebnisse aller Untersuchungstechniken überprüft, einschließlich der PET-CT-Ergebnisse,31,32 der Biopsie- oder Aspirationsergebnisse und der Bewertung des Wachstums, sofern geeignete Bilder verfügbar sind.
Zusammen mit PM müssen der vorhersehbare Nutzen und die Risiken der Behandlung bewertet werden. Es gibt eine Schwelle PM, die die Beobachtung anzeigt, d. H. Jede PM, für die die vernünftigste Option die prospektive Beobachtung der Stabilität oder des Wachstums des SPN ist; und eine Schwelle für die Operation, für die eine Operation eindeutig empfohlen wird, da die Wahrscheinlichkeit eines Krebses im Frühstadium hoch ist. Diese Schwellenwerte hängen vom erwarteten Nutzen ab; zum Beispiel die Heilungswahrscheinlichkeit oder das Ansprechen der Behandlung bei malignen Erkrankungen, die chirurgischen Risiken, die zwischen den Patienten und der persönlichen Einstellung und Präferenz des Patienten variieren können.1
Sequentielle Bewertung des solitären Lungenknotens
Das Ziel der Bewertung eines SPN ist die Diagnose und Behandlung von SPNs, die eine aktive Krankheit darstellen, insbesondere LC, da das 5-Jahres-Überleben im Frühstadium 70% -80% beträgt Krankheit.20 Ein weiteres Ziel ist es, zu vermeiden, dass Patienten mit Granulomen, Hamartomen und anderen gutartigen Läsionen kostspieligen und riskanten Behandlungen unterzogen werden. Es gibt kein einzeln akzeptiertes Verfahren. Die Schlüsselelemente für die Bewertung sind die Schätzung der Wahrscheinlichkeit einer Malignität, die Zugänglichkeit zu verschiedenen diagnostischen Tests und das Fachwissen der Kliniker in diesen Techniken sowie die Präferenzen des Patienten.1,2
Abb. 1-3 zeigen die vorgeschlagene sequentielle Auswertung von SPN: Fig. 1 beschreibt die anfängliche Klassifizierung nach SPN-Größe, Dichte und Solidität oder Subsolidität, wobei Patienten, die ein individuelles Management benötigen, von Patienten getrennt werden, die von Anfang an diagnostiziert werden können. Abb. 2 und 3 beschreiben die vorgeschlagene Strategie für unbestimmte feste SPNs > 8 mm, je nachdem, ob der Zugang zur PET-CT einfach ist (Abb. 2) oder schwieriger (Abb. 3).
Klinische und radiologische Erstuntersuchung (1)
Die Erstuntersuchung umfasst die Anamnese, die Untersuchung und die Bewertung der radiologischen Merkmale sowie den Vergleich mit allen verfügbaren früheren Röntgenbilden2,31: Empfehlungsgrad, 1C.
Wenn keine Hinweise auf Stabilität für > 2 Jahre oder gutartige Verkalkung vorliegen, wird eine CT mit Dünnschnitten durch den interessierenden Knoten angezeigt2: Empfehlungsgrad, 1B.
Einige Knoten können in dieser Phase als gutartig eingestuft werden, wenn sie länger als 2 Jahre stabil sind oder aufgrund ihrer Merkmale auf CT2,31: Empfehlungsgrad, 2C.
Bei unbestimmtem SPNs wird die Überwachung in Abhängigkeit von den Patientenmerkmalen und den radiologischen Merkmalen des Knotens fortgesetzt.
Patienten in besonderen Situationen (2)
Die Situation eines Patienten kann aufgrund einer Änderung der ätiologischen Häufigkeit oder der PM des SPN als besonders angesehen werden oder weil das Verfahren aufgrund chirurgischer Risiken auf nicht-invasive Techniken beschränkt ist.
Patienten mit vorangegangener oder begleitender maligner Erkrankung. Die Anzahl der einzelnen oder multiplen Lungenknoten nimmt bei diesen Patienten stark zu,3,10, auch wenn sie klein sind.6 Die Möglichkeit einer Metastasierung ist noch größer, wenn die SPNs zuvor nicht vorhanden waren. Daher muss die Diagnose mit Biopsie, Aspiration oder videounterstützter Thorakoskopie bestätigt werden, bevor potenziell kurative Behandlungen abgelehnt werden: Empfehlungsgrad, 2C.2,10 SPNs bei immungeschwächten Patienten erfordert eine individuelle Beurteilung, und Biopsie oder Aspiration wird bevorzugt.33
Bei inoperablen Patienten ist die Beurteilung der SPN begrenzt. Biopsie oder Aspiration ist in Fällen mit hoher PM oder positiven Ergebnissen bei PET angezeigt, zur Führung einer Chemotherapie oder Strahlentherapie, wenn eine Behandlung von LC erforderlich ist: Empfehlungsgrad, 2C.
Solitärer Lungenknoten> 8 mm (3) (Abb. 2 und 3)
Der erste Schritt besteht darin, den Patienten nach der geschätzten PM zu klassifizieren: niedrig (??5%), mittel oder hoch (>65%)1,2,29,31: empfehlungsgrad, 1C.
Geringe Malignitätswahrscheinlichkeit (3, 1)
Niedrige PM wird auf weniger als 5% geschätzt.2,31 Dazu gehören auch SPNs, die noch klein sind (
mm), mit deutlichen Rändern, jüngere Patienten (2,28–32,34 In diesen Fällen wird eine radiologische Beobachtung empfohlen2,31: Grad der Empfehlung, 2C.
Ebenfalls enthalten sind SPNs mit intermediärem PM und negativem PET-CT oder solche, die mit FNAB bewertet wurden, die keine Malignität zeigen2: Grad der Empfehlung, 2C.
Mittlere Wahrscheinlichkeit einer Malignität (3, 2)
Ein PM von zwischen 5% und 65% gilt als Zwischenprodukt.2,28–32,34 In diesen Fällen wird die PET-CT empfohlen, die nicht invasiv, risikoarm und mit hoher Diskriminierungsleistung ist (Abb. 2): Grad der Empfehlung, 1B. Ein negatives Ergebnis reduziert die PM erheblich, und Beobachtung kann empfohlen werden; ein positives Ergebnis erhöht PM und klassifiziert es als hoch.2,31
Abhängig von der Zugänglichkeit und den Wartezeiten für die Durchführung der PET-CT ist ein alternatives Verfahren CT-gesteuerte FNAB oder faseroptische Bronchoskopie (FB)-TBA geführt durch Radioskopie, Ultraschallendoskopie oder elektromagnetische oder virtuelle Navigation (Abb. 3): grad der Empfehlung, 2C. Die Biopsieoption ist besonders ratsam, wenn die klinische PM und die Befunde bei bildgebenden Tests nicht übereinstimmen, wenn Ätiologien, die eine spezifische medizinische Behandlung erfordern (z. B. Tuberkulose), vermutet werden oder wenn der Patient eine Operation ablehnt.2: Empfehlungsgrad, 2C.
Die Wiederholung von Biopsie- oder Aspirationstechniken bei anfänglicher Negativität wird nur empfohlen, wenn die PM des SPN hoch ist und eine Diagnose vor der Operation als notwendig erachtet wird oder wenn eine Operation kontraindiziert ist.
Wenn das Ergebnis negativ ist, wird eine PET-CT empfohlen (Abb. 3): Empfehlungsgrad, 1B. Wenn kein PET-CT verfügbar ist, wäre die Alternative eine Überwachung mit CT, insbesondere wenn der FNAB negativ war, oder eine Operation.
Hohe Wahrscheinlichkeit einer Malignität (3, 3)
PM ist bei Patienten über 50 Jahren mit einer Vorgeschichte von Rauchen oder radiologischen Malignitätsmerkmalen hoch: SPN > 15 mm, spekulierte Ränder oder heterogene Dichte. SPNs, die auf PET-CT hypermetabolisch sind, solche, die an Größe zugenommen oder ihre Form verändert haben, und solche mit einer Zytologie oder Lungenbiopsie, die auf Malignität hindeuten, sind ebenfalls von hoher PM.2,28-32,34
In diesen Fällen empfehlen einige Autoren eine direkte diagnostisch-therapeutische Operation und andere bevorzugen Biopsietechniken.2,31 In der durch diesen Algorithmus ausgewählten Population sind die meisten SPNs Lungenkrebs, wenn Patienten mit anderen Krebsarten ausgeschlossen wurden. Daher wird empfohlen, sie als solche zu verwalten,2 wobei PET-CT als Methode zur Inszenierung empfohlen wird17,18: Empfehlungsgrad, 2C.
Die histologische Diagnose vor der Operation kann mit FB-TBA, einer Technik, die auch eine Beurteilung des Bronchialbaums vor der Operation ermöglicht, oder mit FNAB bestimmt werden. Ein negatives Ergebnis reduziert die PM nicht ausreichend, um eine Resektion des SPN auszuschließen. Die Wirksamkeit der präoperativen Diagnose von SPN mit hohem PM im klinischen Stadium I oder II mit CT und PET-CT, sofern der Patient operierbar ist, wurde nicht untersucht. Aus diesem Grund wird dies als Option im Algorithmus angeboten (Abb. 2), obwohl die präoperative Bewertung mit FB eine Standardpraxis ist: empfehlungsgrad, 2C.
Wenn die PET-CT mediastinale oder extrathorakale Aufnahmen zeigt, die auf eine Metastasierung hindeuten, sollten diese vor der Resektionsoperation ausgewertet werden.17,18 Wenn der SPN mit hohem PM bei PET-CT negativ ist, ist der PM nicht ausreichend reduziert, um eine Beobachtung zu empfehlen2 und eine Resektion mittels videoassistierter Thorakoskopie wird empfohlen: Empfehlungsgrad, 2C. Eine geringere Aufnahme deutet jedoch auf eine bessere Prognose und eine geringere Verbreitungswahrscheinlichkeit hin, was berücksichtigt werden kann, wenn der Patient starke Einwände gegen eine Operation hat.3,31
In der vorgeschlagenen Strategie sollte die Bewertung eines SPN mit hohem PM mit einer spezifischen Diagnose oder diagnostisch-therapeutischen Resektion abschließen (Abb. 2 und 3).
Solitärer Lungenknoten mm (4)
Die Prävalenz dieser SPNs ist in CT-Studien sehr hoch und PM ist niedrig, es sei denn, es liegt eine Vorgeschichte eines früheren oder gleichzeitigen metastasierenden Tumors vor.2,6 Sie sind für Biopsien schwer zugänglich, und PET-CT und dynamische CT weisen eine sehr geringe Empfindlichkeit auf.2,6 Eine Beobachtungsstrategie nach den Empfehlungen der Fleischner-Gesellschaft6 (Abb. 1) wird unter Berücksichtigung asymptomatischer Patienten ohne begleitende maligne Erkrankung vorgeschlagen: Empfehlungsgrad, 2C.
Die Nachsorge erfolgt mit niedrig dosiertem, kontrastfreiem CT6: Empfehlungsgrad, 1C. Auch hier muss der Patient informiert und seine Präferenzen berücksichtigt werden.2
Subsolider Lungenknoten (5)
Dies sind Mahlglasknoten, rein oder mit einer festen Komponente5 (Abb. 4). Die Bestimmung eines subsoliden Knotens erfordert dünne Schnitte, vorzugsweise von 1 mm, da kleine feste SPNs in 5-mm-CT-Scheiben als gemahlenes Glas erscheinen können.2,5
SSNs sind für Biopsien oder Aspirationen schwer zugänglich und die Empfindlichkeit der PET-CT ist gering.5,35 Andererseits ist ihre PM relativ hoch, 15% oder mehr im Fall von SPN aus geschliffenem Glas und über 50% für einen gemischten Knoten.5 Es ist auch schwieriger, Veränderungen der Größe oder des Volumens dieser Läsionen während der Überwachung festzustellen, und Malignome, die in dieser Form auftreten, können über einen längeren Zeitraum indolent sein, weshalb die Beobachtungsdauer länger sein muss,5 d. H. Mindestens 3 Jahre.
Da viele gutartige Ätiologien akute oder subakute Prozesse sind, wird eine anfängliche Beobachtungsstrategie mit CT nach 3 Monaten vorgeschlagen, da einige SPNs verschwinden können. Wenn sie bestehen bleiben, wird die Strategie durch die Größe des SPN bestimmt, ob sie eine feste Komponente haben und ob sie einfach oder mehrfach sind (Abb. 1). In Tabelle 2 sind die Empfehlungen der Fleischner-Gesellschaft im Einzelnen aufgeführt.5
Management von subsoliden Knötchen.
| Grad der Empfehlunga | ||||
| Boden-Glas SPN | ||||
| ≤ 5mm | Kein Follow-up | 1C | ||
| > 5mm | CT nach 3 Monaten | Persistent | Jährliches CTFollow-up >3 Jahre | 1B |
| Teilfest SPN (Vollteil) | ||||
| mm | CT nach 3 Monaten | Persistent | Jährliches CTFollow-up >3 Jahre | 2C |
| ≥ 5mm | CT nach 3 Monaten | Persistent | Biopsie, Resektion, PET-CT bei festem Teil >10mm | 1B |
| Mehrfach geschliffen-Glas PN | ||||
| ≤ 5mm | Betrachten Sie nicht bösartige Ursachen | CT nach 2 und 4 Jahren | 1C | |
| > 5mm | CT nach 3 Monaten | Persistent | Jährliches CTFollow-up >3 Jahre | 1B |
| Multiple PN mit fester Komponente | CT 3 Monate | Persistent | Biopsie, Resektion, insbesondere wenn fester Teil >5mm | 1C |
PN: Lungenknoten; SPN: solitärer Lungenknoten; PET: Positronen-Emissions-Tomographie; CT: Computertomographie. Die Note der Empfehlung ist die von der Fleischner-Gesellschaft vorgeschlagene,5 basierend auf dem Notensystem. Die Empfehlungen des American College of Chest Physicians2 reduzieren die Stärke der Empfehlung um eine Note. Die CT für die Bewertung muss eine Feinschnitt- und Follow-up-CT mit niedriger Dosis sein.
Empfehlungsgrad nach Stärke (stark 1 oder schwach 2) und Qualität der wissenschaftlichen Evidenz als hoch (A), mäßig (B), niedrig (C) oder sehr niedrig (D), je nach Notensystem.
Endgültige Möglichkeiten nach Auswertung
- A.
Diagnose der Benignität: Patienten mit einer spezifischen CT-Diagnose wie Hamartome, arteriovenöse Fehlbildungen, zystische Läsionen, abgerundete Atelektasen, Mycetome, Pseudonodule oder verkalkte Knötchen oder Kriterien für eine Benignität, z. B. dokumentierte Stabilität für mindestens 2 Jahre bei festen Knötchen oder mindestens 3 Jahre bei subsoliden Knötchen2,3: Empfehlungsgrad, 2C.
- B.
Radiologische Beobachtung: Angezeigt bei SPNs mit niedriger PM oder mit mittlerer PM, wenn PET-CT negativ ist, Empfehlungsgrad, 2C. Dies kann auch bei nicht diagnostiziertem SPN angezeigt sein, wenn das Operationsrisiko sehr hoch ist oder wenn der Patient die Operation ablehnt: Empfehlungsgrad, 2C.
Für SPN> 8 mm mit niedriger PM wird eine CT-Überwachung nach 3-6 Monaten, erneut nach 9-12 Monaten und erneut nach 24 Monaten empfohlen.2 Gibt es spezifische Strategien für SPN≤8mm und SSN2,5,6 (Abb. 1 und Tabelle 2): Empfehlungsgrad, 2C. Überwachung CTs muss mit niedriger Dosis und ohne Kontrast durchgeführt werden: Empfehlungsgrad, 1C.
- C.
Diagnostisch-therapeutische Chirurgie: Operierbaren Patienten mit nicht diagnostiziertem SPN und PM größer als niedrig sollte eine Resektion angeboten werden: Empfehlungsgrad, 2C. Obwohl die videoassistierte Thorakoskopie die Methode der Wahl ist (Empfehlungsgrad, 1C), entscheidet jedes Operationsteam über den besten Ansatz. Eine intraoperative Biopsie wird empfohlen, um eine geeignete Resektion bei LC abzuschließen: Empfehlungsgrad, 1C.
- D.
Spezifische Diagnose: Dies ist die ätiologische Diagnose von SPN. Wenn LC diagnostiziert wird, werden spezifische lokale Staging- und Behandlungsprotokolle angewendet.20
Der Algorithmus kann nicht vervollständigt werden, ohne erneut zu betonen, dass die optimale Entscheidung die Meinung und die Präferenzen des angemessen informierten Patienten enthalten muss2: Empfehlungsgrad, 1C.
Interessenkonflikt
Die Autoren geben an, dass sie keinen Interessenkonflikt haben.