Obiettivi
Lo scopo di queste linee guida è quello di facilitare il processo decisionale nel trattamento dei pazienti con nodulo polmonare solitario (SPN).1-3 Queste linee guida non sono destinate ad essere rigide, poiché il trattamento di SPN è un esempio di come la stima della probabilità di malignità (PM), l’accesso alle varie tecniche diagnostiche e terapeutiche e le preferenze del paziente lavorano insieme per modellare la decisione ottimale. Questo processo dovrebbe essere individualizzato nell’ambito clinico e per ogni situazione particolare. Poiché l’accessibilità ad alcune tecniche diagnostiche può variare, a seconda dell’impostazione, viene proposto un algoritmo strategico generale (Fig. 1) con due alternative, a seconda del grado di accessibilità alla tomografia ad emissione di positroni (PET) (Fig. 2 e 3). Le raccomandazioni sono state classificate in base alla forza (forte 1, debole 2) in base alla relazione tra i benefici prevedibili e i rischi per il paziente; e la qualità delle prove scientifiche, come alto (A), moderato (B), basso (C) o molto basso (D), secondo il sistema di grado.4 Una sintesi di queste raccomandazioni2,4,6 è riportata nella Tabella 1. La versione estesa di queste raccomandazioni è disponibile come supplemento online, insieme a tabelle e cifre aggiuntive (Appendice 1).
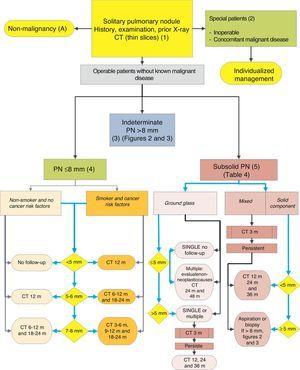
Algoritmo per la gestione del PN: classificazione iniziale e osservazione di SPN≤8mm e SPN subsolidi. m: mesi, PN: nodulo polmonare; SPN: nodulo polmonare solitario; CT: tomografia computerizzata, comprese sezioni sottili. Follow-up con TC a bassa radiazione, a condizione che non venga rilevata alcuna crescita. I numeri e le lettere tra parentesi si riferiscono alle sezioni del testo in cui vengono discussi.
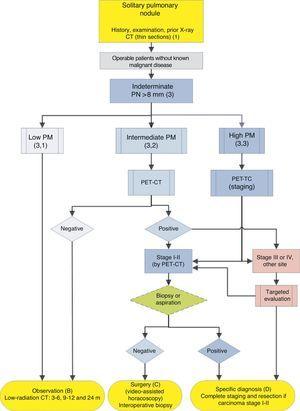
Algoritmo per la gestione di PN >8mm: impostazione clinica con facile accesso a PET-CT. m: mesi, PN: nodulo polmonare; SPN: nodulo polmonare solitario; PET-CT: tomografia ad emissione di positroni con tomografia computerizzata; PM: probabilità di malignità; CT: tomografia computerizzata del torace, comprese le sezioni sottili. Follow-up con TC a bassa radiazione, a condizione che non venga rilevata alcuna crescita. I numeri e le lettere tra parentesi si riferiscono alle sezioni del testo in cui vengono discussi.
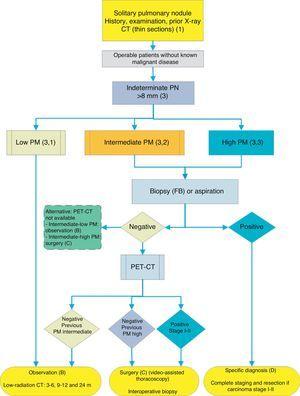
Algoritmo per la gestione di PN >8mm: impostazione clinica con difficile accesso a PET-CT o preferenza per lo studio citostologico di SPN. FB: broncoscopia fiberottica e biopsia guidata; m: mesi; SPN: nodulo polmonare solitario; PET-CT: tomografia ad emissione di positroni con tomografia computerizzata; PM: probabilità di malignità; CT: tomografia computerizzata del torace, comprese le sezioni sottili. Follow-up con TC a bassa radiazione, a condizione che non venga rilevata alcuna crescita. I numeri e le lettere tra parentesi si riferiscono alle sezioni del testo in cui vengono discussi.
Raccomandazioni per la gestione del nodulo polmonare solitario.
| Raccomandazione | Gradea |
| SPN valutazione iniziale | |
| Tutte le decisioni sulla gestione di un SPN deve includere il parere e le preferenze del opportunamente informato del paziente | 1C |
| Valutare la stabilità o crescita in precedenti esami radiologici, se disponibili | 1C |
| Stabilità per più di 2 anni in massello di SPN e benigno calcificazione indicare benignancy e non richiedono un’ulteriore valutazione | 2C |
| CT, con sezioni sottili attraverso la lesione di interesse, è essenziale per la valutazione iniziale di un indeterminato SPN | 1B |
| SPN in pazienti con precedente o concomitante malignità richieda di gestione e di valutazione | 1C |
| Spn inutilizzabile pazienti richiedono individualizzato di gestione | 1C |
| Spn sarà classificato come solido noduli>8 mm, tinta noduli≤8 mm e subsolid noduli | 1B |
| > Solido noduli>8mm | |
| Dovrebbe essere classificate secondo il PM: basso ( (>65%) | 2C |
| SPN con basso PM: radiologiche osservazione | 2C |
| Radiologici osservazione: a bassa emissione di TC senza mezzo di contrasto al 3-6, 9-12 e 24 mesi | 2C |
| SPN intermedie PM: PET-CT | 1B |
| Negativo PET-CT: radiologiche osservazione | 2C |
| Spn con intermedio PM: biopsia di aspirazione è un’alternativa accettabile | 2C |
| Nessuna diagnosi istologica: PET-CT | 1B |
| la Biopsia o l’aspirazione è consigliabile in caso di discordanza tra clinica PM e test di imaging | 2C |
| Sospetta eziologia che richiedono trattamento medico (ad esempio la tubercolosi) | |
| i Pazienti di rifiutare o di opporsi ad intervento chirurgico di diagnostica | |
| SPN con alta PM: di gestione secondo la presunta diagnosi di stadio precoce del carcinoma | 2C |
| SPN con alta PM: FB bronchiale esame e biopsia transbronchiale | 2D |
| Non diagnosticati SPN con PM maggiore di bassa nei pazienti operabili: SPN resezione | 2C |
| tecnica Consigliata: toracoscopia video-assistita | 1C |
| Biopsia interoperatoria per stabilire il tipo di resezione | |
| Il sottocentimetro PNs associato a SPN non deve essere una controindicazione per la chirurgia curativa del carcinoma a meno che non vi sia conferma di metastasi. | 2C |
| SPNmm | |
| Strategia di osservazione seguendo le raccomandazioni della Fleischner Society (Fig. 1) | 2C |
| Low-dose, TC senza mezzo di contrasto di sorveglianza | 1C |
| Subsolid Spn | |
| Intervento in base alle raccomandazioni dell’Fleischner Società (Tabella 2) | 1B 2C |
| Low-dose, TC senza mezzo di contrasto di sorveglianza | 1C |
FB: fibroscopia; PN: nodulo polmonare; SPN: nodulo polmonare solitario; PET: tomografia ad emissione di positroni; PM: probabilità di malignità; TC: tomografia computerizzata.
Grado di raccomandazione per forza (forte 1 o debole 2) e qualità delle prove scientifiche come alta (A), moderata (B), bassa (C) o molto bassa (D), secondo il sistema di GRADO.
Introduzione: Concetto ed eziologia
SPN è definito come una singola, sferica, distinta, opacità radiologica con un asse lungo di ≤30mm, principalmente circondato da polmone aerato e senza atelettasia associata, allargamento ilare o versamento pleurico.1-3 SPNs possono essere osservati su radiografia del torace o tomografia computerizzata del torace (CT) eseguita per studiare altre malattie o per lo screening diagnostico per il cancro del polmone (LC).3,6,7 Noduli millimetrici (≤8mm di diametro) 1,2,6 e noduli subsolidi (SSNs)2,5 (Fig. 4), che richiedono una gestione diversa, 5-7 può essere rilevato su CT (Fig. 1). Gli SSN includono sia noduli di vetro smerigliato che noduli parzialmente solidi che combinano un componente di vetro smerigliato con un componente solido.2,5–7
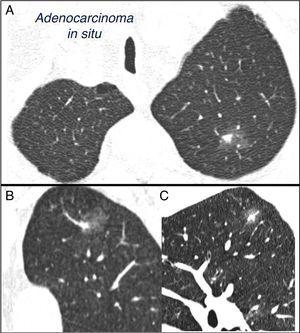
Nodulo polmonare solitario subsolido misto nel lobo superiore sinistro. Tomografia computerizzata del torace con sezioni sottili di 2 mm in un paziente con un nodulo polmonare solitario nel lobo superiore sinistro. Sezione assiale (A) nei lobi superiori e ricostruzioni coronali (B) e sagittali (C) nel lobo superiore sinistro. Si osserva un nodulo polmonare solitario in vetro smerigliato di 18 mm, con una componente solida di 7 mm all’interno. La resezione mediante toracoscopia video-assistita ha rivelato l’adenocarcinoma.
Si stima che i noduli si verifichino ad una velocità di 1 o 2 per 1000 raggi X.1,3,8 La prevalenza di noduli su CTS eseguiti in fumatori adulti per lo screening LC è molto alta, tra il 20% e il 50%, e sono generalmente di dimensioni inferiori a 10 mm; l’incidenza in CTS annuali successivi è del 10%.1,3,6,7
Quando si valutano SPNs con CT, si trovano spesso altri piccoli noduli. Quando sono pochi o uno è chiaramente dominante, dovrebbero essere considerati come SPN indipendenti, poiché, anche se la situazione è LC, i noduli sottocentimetri di accompagnamento sono comunemente benigni.1,2,6,7 Inoltre, fino al 20% dei casi, il nodulo maligno non è il più grande.7
SPN è la manifestazione radiologica di molte malattie3 (Appendice online–Tabella 1S). Tuttavia, la maggior parte dei noduli sono causati da neoplasie polmonari, granulomi e amartomi.1 La prevalenza di malignità varia tra le serie8, 9: tra il 5% e il 70%, a seconda che le cifre siano recuperate da controlli sanitari o studi di tecniche diagnostiche, e in misura minore nelle SPN rilevate nei programmi di screening LC, dove la prevalenza è dell ‘ 1% -10%, a seconda delle dimensioni del nodulo.3,7 Il PM di SPNs aumenta in particolare nei pazienti con precedente malattia tumorale.3,10
La maggior parte delle SPN maligne sono LC, più frequentemente adenocarcinomi e carcinomi a grandi cellule.2,3 Nel SSN maligno, i ceppi più comuni sono nello spettro dell’adenocarcinoma,5,11, 12 che vanno tra iperplasia adenomatosa atipica nei noduli più piccoli, adenocarcinoma in situ, adenocarcinoma minimamente invasivo e adenocarcinoma invasivo, se è presente una componente solida, in particolare nei noduli mucinosi e in quelli a crescita lepidica.5,11,12
Tecniche diagnostiche nello studio del nodulo polmonare solitariocest Tomografia computerizzata
Questa tecnica è di gran lunga superiore ai raggi X standard nella valutazione delle SPNs.2,3 Può rilevare altri noduli e linfoadenopatie mediastiniche, diagnosticare pseudonoduli (lesioni extraparenchimali) e aiutare nella pianificazione della biopsia del nodulo o dell’aspirazione. In alcuni casi, può fornire una diagnosi specifica, come malformazioni artero-venose, micetomi, atelettasia arrotondata o amartomi. Di conseguenza, CT è essenziale come l’esame indice per lo studio di SPNs.2
L’aumento del nodulo o l’assorbimento del materiale di contrasto hanno mostrato una sensibilità del 98% per la malignità con un cutoff di > 15 unità di Hounsfield (HU) e una specificità del 58%.13 Questo è applicabile a SPNs sferici e omogenei > 8mm, senza grasso, cavitazione del calcio o necrosi. Questo può essere prezioso nei centri con esperienza in questa tecnica, ma a causa dell’introduzione del PET il suo uso non è diventato diffuso.3
Tomografia ad emissione di positroni
Una delle principali indicazioni per PET-CT con 18F-deossi-d-glucosio è lo studio di SPNs. La sensibilità media per SPNS solidi> 10 – 15mm è 0.93 (intervallo di confidenza 0,90-0,95) e la specificità media è 0,8 (CI 0,74–0,85).2,14,15 Falsi negativi su PET-CT sono associati a tecnica difettosa, diametro tumorale 7mm, tumori carcinoidi, noduli sottosolidi e alcuni adenocarcinomi, in particolare in situ, minimamente invasivi, crescita lepidica o adenocarcinomi mucinosi.2,3 I falsi positivi sono più comuni e comprendono lesioni infiammatorie e infettive, come granulomi, tubercolosi, micosi o polmoniti.2,16
PET-CT è di maggior utilizzo in SPNs > 8mm con PM intermedio: uno studio negativo riduce notevolmente PM.3 In una PET-CT positiva, un maggiore valore di assorbimento standardizzato (SUV) indica una maggiore aggressività tumorale e una prognosi peggiore per il paziente, sebbene la sua ridotta specificità, e quindi la possibilità di un falso positivo, debba essere presa in considerazione.17,18 Può anche aiutare a selezionare il sito più efficiente e accessibile per la biopsia e aiutare, se necessario, nella pianificazione della radioterapia.19 PET-CT contribuisce allo stadio del cancero2, 3 valutando le metastasi mediastiniche e sistemiche ed è raccomandato in molte linee guida di gestione di LC.17,18,20 In queste raccomandazioni, PET-CT viene utilizzato in due modi: come strumento per caratterizzare lo SPN e come tecnica di staging in SPN con alto PM.
Campionamento citostologico di nodulo polmonare solitariotografia computerizzata, radioscopia o Aspirazione transtoracica con ago sottile a guida ecografica
Un’analisi della letteratura su 48 studi mostra una buona sensibilità, 86% (CI 84% -88%), per la diagnosi di malignità e specificità molto buona, 99% (CI 98% -99%).21 In SPNS più piccolo di 15mm, la sensibilità è più bassa, a 70% -82%.2,22 Nella malattia benigna, anche la specificità è inferiore.21 Il tasso medio di pneumotorace era del 15%, di cui il 7% richiedeva il drenaggio.2,21,23 L’aspirazione transtoracica è controindicata nei casi di scarsa collaborazione del paziente, funzionalità respiratoria molto compromessa o diatesi polmonare singola o emorragica, e in presenza di enfisema o bolle estese nella regione del nodulo. Tra il 4% e il 50% dei risultati non forniscono una diagnosi e fino al 20% sono falsi negativi.2 Se il PM è alto, il tasso di negativi veri è lo stesso di quello dei falsi negativi, quindi non è utile per escludere la malignità.2
Broncoscopia fiberottica e tecniche associate
In LC, la resa diagnostica dell’aspirazione transbronchiale guidata da CT (TBA) per indirizzare il nodulo varia, secondo la serie, dal 20% all ‘ 80%, ed è inferiore in SPNS inferiori a 20 mm, dove la resa media è del 30%.2 In SPN benigni, la resa è del 10%. Questa tecnica è più efficace nei noduli centrali più grandi (>20 mm) utilizzando un broncogramma ad aria.2,24 C’è poco rischio di TBA: pneumotorace, 2%, 2 e più raramente, emottisi o ematomi. Sebbene il rendimento diagnostico per SPNs sia inferiore a quello ottenuto con l’aspirazione-biopsia transtoracica con ago sottile (FNAB), è possibile eseguire un esame endobronchiale prima di pianificare l’intervento chirurgico LC.25 Broncoscopie ultra-sottili per un migliore accesso alle lesioni, guaine guida per il posizionamento della pinza, endobronchoscopia a ultrasuoni con sonda radiale, broncoscopia di navigazione elettromagnetica e broncoscopia di navigazione sono tutte in fase di valutazione, essendo tecniche che consentono di guidare la pinza verso il nodulo, migliorando così la resa.2,26 Queste tecniche sono state confrontate in una meta-analisi26: la resa combinata era del 70%, migliore rispetto alle precedenti serie guidate dalla radioscopia, e le rese delle singole tecniche variavano dal 68,5% al 73%, sebbene tra gli studi fossero state osservate un’ampia variabilità ed eterogeneità. La resa era inferiore in SPNs20mm, 61% contro 80% in >20mm. La combinazione di tecniche può migliorare la resa un po’.2 Come si può vedere da questi dati, nessuna tecnica in particolare supera le altre in termini di rendimento, e la raccomandazione è che ogni centro dovrebbe utilizzare le tecniche per le quali sono disponibili sia le attrezzature che le competenze.
La toracoscopia video-assistita e la toracotomia
Le SPN possono essere resecate utilizzando queste tecniche.2 Se gli SPN sono piccoli o situati in profondità nel parenchima, possono essere precedentemente tinti o contrassegnati con un hookwire, generalmente con puntura transtoracica guidata da CT. I rischi di toracoscopia video-assistita sono bassi e la mortalità è molto rara (meno dell ‘ 1%), la morbilità è bassa e la resa diagnostica è buona, simile alla toracotomia ma con mortalità inferiore.2 Quando l’SPN è LC, se la situazione clinica del paziente lo consente, è indicata la resezione anatomica: in generale, si raccomanda la lobectomia e la dissezione del nodo mediastinico.2,20,27
Stima della probabilità di malignità
Le SPN maligne differiscono dalle SPN benigne in alcuni aspetti clinici e radiologici, descritti più dettagliatamente nella versione estesa di queste linee guida (vedi supplemento online). I fattori più strettamente associati alla malignità sono la dimensione del SPN, le caratteristiche del margine, la densità, l’età del paziente, il consumo di tabacco accumulato, l’esistenza di altre malignità e il rilevamento della crescita.2,3,6,7,10,28-30 La calcificazione centrale, laminare o totale dell’SPN è considerata un buon criterio per la benignità,2,3 così come la stabilità radiologica per più di 24 mesi, il che implica un tempo di raddoppio di oltre 730 giorni. Questo criterio non è valido per il SSN, per il quale l’osservazione deve essere estesa ad almeno 3 anni.1-3, 5
La maggior parte dei medici stima il PM in modo intuitivo, ma sono stati proposti diversi modelli SPN e regole di classificazione7,28-32 e ci sono anche calcolatrici disponibili online (appendice online–Tabella 2S) o come applicazione per smartphone (calcolatrice medica Medcalc). La Tabella 2S dell’appendice online fornisce un insieme di formule ottenute da diversi modelli logistici e la Figura 1S è un nomogramma valido per SPNs nella radiografia del torace.
Questa stima del PM guida il successivo processo diagnostico.1,2,31 Logicamente, quando si prevede la malignità, vengono rivisti i risultati di tutte le tecniche di esame,compresi i risultati della PET-TC,31, 32 i risultati della biopsia o dell’aspirazione e la valutazione della crescita, se sono disponibili immagini adeguate.
Insieme al PM, devono essere valutati i benefici e i rischi prevedibili del trattamento. C’è una soglia PM che indica l’osservazione, cioè qualsiasi PM per il quale l’opzione più ragionevole è l’osservazione prospettica della stabilità o della crescita del SPN; e una soglia per la chirurgia, per la quale la chirurgia è chiaramente raccomandata poiché la probabilità di cancro allo stadio iniziale è alta. Queste soglie dipendono dai benefici attesi; ad esempio, la probabilità di guarigione o la risposta al trattamento nei casi di malattia maligna, i rischi chirurgici, che possono variare tra i pazienti e l’atteggiamento personale e le preferenze del paziente.1
Valutazione sequenziale del nodulo polmonare solitario
Lo scopo della valutazione di un SPN è quello di diagnosticare e trattare le SPN che rappresentano una malattia attiva, in particolare la LC, poiché la sopravvivenza a 5 anni è del 70% -80% nella malattia in fase iniziale.20 Un altro obiettivo è evitare di sottoporre i pazienti con granulomi, amartomi e altre lesioni benigne a trattamenti costosi e rischiosi. Non esiste una procedura singolarmente accettata. Gli elementi chiave per la valutazione sono la stima della probabilità di malignità, l’accessibilità a diversi test diagnostici e l’esperienza dei medici in queste tecniche e le preferenze del paziente.1,2
Fichi. 1-3 mostrare la valutazione sequenziale proposta di SPN: Fig. 1 descrive la classificazione iniziale per dimensione SPN, densità e solidità o subsolidità, separando i pazienti che richiedono una gestione individualizzata e quelli che possono essere diagnosticati fin dall’inizio. Fico. 2 e 3 descrivono la strategia proposta per SPN solidi indeterminati> 8mm, a seconda che l’accesso a PET-CT sia facile (Fig. 2) o più difficile (Fig. 3).
Clinica Iniziale e la Valutazione Radiologica (1)
Il primo esame comprende la storia, l’esame e la valutazione delle caratteristiche radiologiche, insieme con il confronto con i precedenti X-rays2,31: grado di raccomandazione 1C.
Se non vi è alcuna prova di stabilità per >2 anni o benigna calcificazione, CT con sezioni sottili attraverso il nodulo di interesse è indicated2: grado di raccomandazione, 1B.
Alcuni noduli possono essere classificati in questa fase come benigni se sono considerati stabili per più di 2 anni o dalle loro caratteristiche su CT2,31: grado di raccomandazione, 2C.
In SPNs indeterminati, la sorveglianza continuerà, a seconda delle caratteristiche del paziente e delle caratteristiche radiologiche del nodulo.
Pazienti in situazioni speciali (2)
La situazione di un paziente può essere considerata speciale a causa di un cambiamento nella frequenza eziologica o del PM del SPN, o perché la procedura è limitata a tecniche non invasive a causa di rischi chirurgici.
Pazienti con malattia maligna precedente o concomitante. Il PM dei noduli polmonari, singoli o multipli, aumenta notevolmente in questi pazienti,3, 10 anche se sono piccoli.6 La possibilità di metastasi è ancora maggiore se gli SPN non erano precedentemente presenti. Tuttavia, quando le SPN sono subcentimetriche, fino a un terzo sono benigne, quindi la diagnosi deve essere confermata con biopsia, aspirazione o toracoscopia video-assistita prima di negare trattamenti potenzialmente curativi: grado di raccomandazione, 2C.2,10 SPNs in pazienti immunocompromessi richiederanno la valutazione individualizzata e la biopsia o l’aspirazione è preferita.33
Nei pazienti inoperabili, la valutazione di SPN è limitata. La biopsia o l’aspirazione è indicata nei casi con PM elevato o risultati positivi su PET, per guidare la chemioterapia o la radioterapia se è richiesto il trattamento di LC: grado di raccomandazione,2C.
Nodulo polmonare solitario> 8mm (3) (Fig. 2 e 3)
Il primo passo è classificare il paziente in base al PM stimato: basso (??5%), intermedio o alto (>65%)1,2,29,31: grado di raccomandazione, 1C.
Bassa probabilità di malignità(3, 1)
Basso PM è quello stimato a meno del 5%.2,31 Questo include Spn che sono ancora piccoli (
mm), con distinti margini, i pazienti più giovani (2,28–32,34 In questi casi, radiologici osservazione è recommended2,31: grado di raccomandazione 2C.
sono inclusi Anche Spn con intermedio PM e negativi PET-CT o a quelli valutati con FNAB mostrando non malignancy2: grado di raccomandazione 2C.
Intermedia Probabilità di Malignità (3, 2)
UN PM tra il 5% e il 65% è considerato intermedio.2,28-32,34 In questi casi si raccomanda la PET-CT, non invasiva, a basso rischio e ad alto potere discriminatorio (Fig. 2): grado di raccomandazione, 1B. Un risultato negativo riduce considerevolmente il PM e l’osservazione può essere raccomandata; un risultato positivo aumenta il PM e lo classifica come alto.2,31
A seconda dell’accessibilità e dei tempi di attesa per l’esecuzione della PET-CT, una procedura alternativa è la FNAB guidata da CT o la broncoscopia fiberottica (FB)-TBA guidata da radioscopia, endoscopia a ultrasuoni o navigazione elettromagnetica o virtuale (Fig. 3): grado di raccomandazione, 2C. La biopsia opzione è particolarmente consigliabile quando il clinico PM e risultati sul test di imaging sono discordanti, quando eziologie che necessitano di specifiche cure mediche (ad esempio, la tubercolosi) sono indagati o se il paziente è negativo per surgery2: grado di raccomandazione 2C.
Ripetere la biopsia o tecniche di aspirazione in caso di negatività iniziale è raccomandato solo quando il PM di SPN è alta e la diagnosi prima dell’intervento è ritenuto necessario, o quando l’intervento chirurgico è controindicato.
Se il risultato è negativo, si consiglia PET-CT (Fig. 3): grado di raccomandazione, 1B. Se non è disponibile PET-CT, l’alternativa sarebbe il monitoraggio con TC, in particolare se l’FNAB era negativo, o un intervento chirurgico.
Alta probabilità di malignità(3, 3)
PM è alta nei pazienti di età superiore ai 50 anni, con una storia di fumo o caratteristiche radiologiche di malignità: SPN > 15mm, margini speculati o densità eterogenea. SPN che sono ipermetabolici su PET-CT, quelli che sono aumentati di dimensioni o forma modificata e quelli con una citologia o biopsia polmonare suggestiva di malignità sono anche di alta PM.2,28-32,34
In questi casi, alcuni autori raccomandano la chirurgia diagnostico-terapeutica diretta e altri preferiscono le tecniche di biopsia.2,31 Nella popolazione selezionata da questo algoritmo, quando i pazienti con altri tumori sono stati esclusi, la maggior parte delle SPN sono tumori polmonari. Pertanto, la raccomandazione è che siano gestiti come tali, 2 con la PET-CT raccomandata come metodo per lo staging17,18: grado di raccomandazione, 2C.
La diagnosi istologica pre-chirurgica può essere determinata utilizzando FB-TBA, una tecnica che consente anche una valutazione dell’albero bronchiale prima di intraprendere l’intervento chirurgico, o tramite FNAB. Un risultato negativo non riduce sufficientemente il PM da impedire la resezione dell’SPN. L’efficacia del tentativo di diagnosi pre-chirurgica di SPN con PM elevato, allo stadio clinico I o II con TC e PET-CT, a condizione che il paziente sia operabile, non è stata studiata. Per questo motivo, questo è offerto come opzione nell’algoritmo (Fig. 2), sebbene la valutazione pre-chirurgica con FB sia una pratica standard: grado di raccomandazione, 2C.
Se la PET-TC rivela uptakes mediastinici o extratoracici suggestivi di metastasi, questi devono essere valutati prima dell’intervento chirurgico di resezione.17,18 Se SPN alta PM è negativo su PET-CT, il PM non è sufficientemente ridotta per raccomandare l’osservazione,la 2 e la resezione mediante video-assistita la toracoscopia è raccomandato: grado di raccomandazione 2C. Consumo inferiore, tuttavia, suggerisce una prognosi migliore e meno probabilità di diffusione, qualcosa che può essere preso in considerazione se il paziente ha una forte opposizione a un intervento chirurgico.3,31
Nella strategia proposta, la valutazione di un SPN con PM elevato dovrebbe concludersi con una diagnosi specifica o resezione diagnostico-terapeutica (Fig. 2 e 3).
Nodulo polmonare solitario mm (4)
La prevalenza di questi SPNs è molto alta negli studi CT e PM è bassa, a meno che non vi sia una storia di tumore metastatico precedente o concomitante.2,6 Sono di difficile accesso per ottenere biopsie e PET-CT e TC dinamica hanno sensibilità molto bassa.2,6 Una strategia di osservazione che segue le raccomandazioni della Società Fleischner6 (Fig. 1) viene proposto, prendendo in considerazione i pazienti asintomatici senza malattia maligna concomitante: grado di raccomandazione, 2C.
Il follow-up viene eseguito con CT6 a basse dosi, non a contrasto: grado di raccomandazione, 1C. Anche in questo caso, il paziente deve essere informato e le sue preferenze devono essere prese in considerazione.2
Nodulo polmonare subsolido (5)
Questi sono noduli di vetro smerigliato, puri o con una componente solida5 (Fig. 4). La determinazione di un nodulo subsolido richiede sezioni sottili, preferibilmente di 1 mm, poiché piccoli SPN solidi in fette CT da 5 mm possono apparire come vetro smerigliato.2,5
Gli SSN sono di difficile accesso per biopsia o aspirazione e la sensibilità della PET-CT è bassa.5,35 D’altra parte, il loro PM è relativamente alto, 15% o più nel caso di SPN di vetro smerigliato e oltre 50% per un nodulo misto.5 È anche più difficile stabilire cambiamenti nella dimensione o nel volume di queste lesioni durante la sorveglianza, e le neoplasie che appaiono in questa forma possono essere indolenti per un periodo prolungato, per cui il periodo di osservazione deve essere più lungo,5 cioè almeno 3 anni.
Poiché molte eziologie benigne sono processi acuti o subacuti, viene proposta una strategia di osservazione iniziale con TC a 3 mesi, poiché alcuni SPNs possono scomparire. Se persistono, la strategia sarà determinata dalla dimensione dello SPN, se hanno un componente solido e se sono singoli o multipli (Fig. 1). La tabella 2 elenca in dettaglio le raccomandazioni proposte dalla Società Fleischner.5
Gestione dei noduli subsolidi.
| Grado di Recommendationa | ||||
| base di vetro SPN | ||||
| ≤5mm | No follow-up | 1C | ||
| >5mm | TC a 3 mesi | Persistente | Annuale CTFollow-up >3 anni | 1B |
| Parzialmente solido SPN (parte solida) | ||||
| mm | TC a 3 mesi | Persistente | Annuale CTFollow-up >3 anni | 2C |
| ≥5mm | TC a 3 mesi | Persistente | Biopsia, resezione, PET-CT, se parte solida >10mm | 1B |
| Più terra-vetro PN | ||||
| ≤5mm | Considerare non maligne cause | CT a 2 e 4 anni | 1C | |
| >5mm | TC a 3 mesi | Persistente | Annuale CTFollow-up >3 anni | 1B |
| Più PN con componente solida | TC 3 mesi | Persistente | Biopsia, resezione, soprattutto se parte solida >5mm | 1C |
PN: nodulo polmonare; SPN: nodulo polmonare solitario; ANIMALE domestico: tomografia ad emissione di positroni; TC: tomografia computerizzata. Il grado di raccomandazione è quello proposto dalla Fleischner Society, 5 basato sul sistema di valutazione. Le raccomandazioni dell’American College of Chest Physicians2 riducono la forza della raccomandazione di un grado. La TC per la valutazione deve essere fine slice e follow-up a basse dosi CT.
Grado di raccomandazione per forza (forte 1 o debole 2) e qualità delle prove scientifiche come alta (A), moderata (B), bassa (C) o molto bassa (D), secondo il sistema di GRADO.
Possibilità finali dopo la valutazione
- A.
Diagnosi di benignità: I pazienti con una diagnosi specifica sul CT, come amartomi, malformazioni artero-venose, lesioni cistiche, arrotondato atelettasia, mycetomas, pseudonodules o calcificato noduli, o che hanno criteri per benignancy, ad esempio, documentati stabilità per almeno 2 anni, nel caso di noduli solidi, o almeno di 3 anni per subsolid nodules2,3: grado di raccomandazione 2C.
- B.
Radiologici osservazione: Indicato in Spn con basso PM, o con intermedio PM quando PET-CT è negativo, grado di raccomandazione 2C. Questo può anche essere indicato in SPNs non diagnosticati se il rischio di intervento chirurgico è molto alto o se il paziente rifiuta l’intervento chirurgico: grado di raccomandazione, 2C.
Per SPN> 8mm con PM basso, il monitoraggio CT è raccomandato a 3-6 mesi, di nuovo a 9-12 mesi e di nuovo a 24 mesi.2 Esistono strategie specifiche per SPN≤8mm e SSN2,5, 6 (Fig. 1 e Tabella 2): grado di raccomandazione, 2C. La sorveglianza CTs deve essere eseguita con basse dosi e senza contrasto: grado di raccomandazione, 1C.
- C.
Chirurgia diagnostico-terapeutica: Ai pazienti operabili con SPN e PM non diagnosticati superiori a quelli bassi dovrebbe essere offerta la resezione: grado di raccomandazione, 2C. Sebbene la toracoscopia video-assistita sia il metodo di scelta (grado di raccomandazione, 1C), ogni team chirurgico deciderà l’approccio migliore. La biopsia intraoperatoria è raccomandata per completare la resezione appropriata nel caso di LC: grado di raccomandazione, 1C.
- D.
Diagnosi specifica: Questa è la diagnosi eziologica di SPN. Se viene diagnosticata la LC, verranno applicati specifici protocolli di stadiazione e trattamento locali.20
L’algoritmo non può essere completato senza ribadire che la decisione ottimale deve includere l’opinione e le preferenze del paziente adeguatamente informato2: grado di raccomandazione, 1C.
Conflitto di interessi
Gli autori affermano di non avere alcun conflitto di interessi.