mål
syftet med dessa riktlinjer är att underlätta beslutsfattande vid behandling av patienter med en ensam lungknut (SPN).1-3 dessa riktlinjer är inte avsedda att vara styva, eftersom behandlingen av SPN är ett exempel på hur uppskattning av sannolikheten för malignitet (PM), Tillgång till olika diagnostiska och terapeutiska tekniker och patientpreferenser arbetar tillsammans för att forma det optimala beslutet. Denna process bör individualiseras i klinisk miljö och för varje enskild situation. Eftersom tillgängligheten till vissa diagnostiska tekniker kan variera, beroende på inställningen, föreslås en allmän strategisk algoritm (Fig. 1) med två alternativ, beroende på graden av tillgänglighet till positronemissionstomografi (PET) (Fig. 2 och 3). Rekommendationerna har graderats enligt styrka (stark 1, svag 2) baserat på förhållandet mellan de förutsebara fördelarna och riskerna för patienten; och kvaliteten på de vetenskapliga bevisen, så hög (a), måttlig (B), låg (C) eller mycket låg (D), enligt betygssystemet.4 en sammanfattning av dessa rekommendationer2, 4, 6 ges i Tabell 1. Den utökade versionen av dessa rekommendationer är tillgänglig som ett online-tillägg, tillsammans med ytterligare tabeller och siffror (s) (bilaga 1).
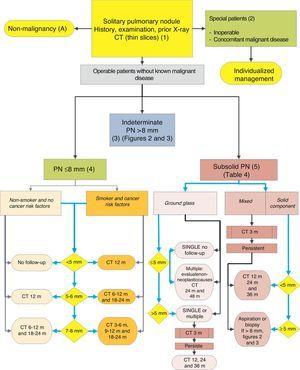
algoritm för hantering av PN: initial klassificering och observation av SPN 8 mm och subsolid SPN. m: månader, PN: lungknut; SPN: ensam lungknut; CT: datortomografi, inklusive tunna sektioner. Uppföljning med CT med låg strålning, förutsatt att ingen tillväxt detekteras. Siffror och bokstäver inom parentes hänvisar till avsnitten i texten där de diskuteras.
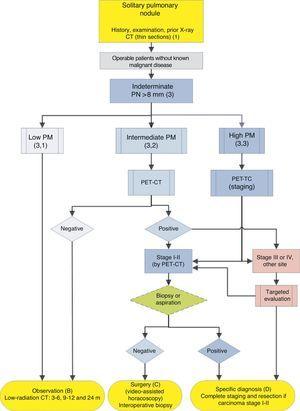
algoritm för hantering av PN>8mm: klinisk inställning med enkel åtkomst till PET-CT. m: månader, PN: lungknut; SPN: ensam lungknut; PET-CT: positronemissionstomografi med datortomografi; PM: Sannolikhet för malignitet; CT: bröstberäknad tomografi, inklusive tunna sektioner. Uppföljning med CT med låg strålning, förutsatt att ingen tillväxt detekteras. Siffror och bokstäver inom parentes hänvisar till avsnitten i texten där de diskuteras.
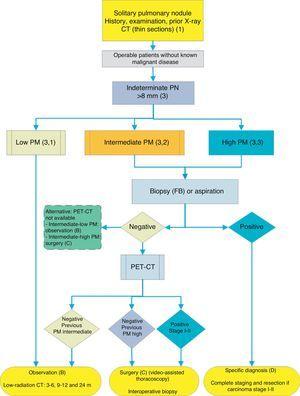
algoritm för hantering av PN>8mm: klinisk miljö med svår tillgång till PET-CT eller preferens för cytohistologisk studie av SPN. FB: fiberoptisk bronkoskopi och guidad biopsi; m: månader; SPN: ensam lungknutpunkt; PET-CT: positronemissionstomografi med datortomografi; PM: Sannolikhet för malignitet; CT: bröstberäknad tomografi, inklusive tunna sektioner. Uppföljning med CT med låg strålning, förutsatt att ingen tillväxt detekteras. Siffror och bokstäver inom parentes hänvisar till avsnitten i texten där de diskuteras.
rekommendationer för hantering av ensam Lungknut.
| rekommendation | Gradea |
| SPN inledande utvärdering | |
| alla beslut om hantering av ett SPN måste innehålla yttrandet och preferensen hos den lämpligt informerade patienten | 1C |
| utvärdera stabilitet eller tillväxt i tidigare radiologiska studier om tillgängliga | 1C |
| stabilitet i mer än 2 år i fast SPN och godartad förkalkning indikerar benignancy och kräver ingen ytterligare utvärdering | 2C |
| CT, med tunna sektioner genom intresseskador, är avgörande för den initiala utvärderingen av obestämd SPN | 1B |
| SPN hos patienter med tidigare eller samtidig malignitet kräver individualiserad hantering och utvärdering | 1C |
| SPNs hos inoperabla patienter kräver individualiserad hantering | 1C |
| SPNs kommer att klassificeras som fasta noduler>8 mm, fasta noduler 6 mm och subsolida noduler | 1B |
| fasta knutor> 8 mm | |
| bör klassificeras enligt PM: låg ( (>65%) | 2C |
| SPN med låg PM: radiologisk observation | 2C |
| radiologisk observation: CT med låg strålning utan kontrast vid 3-6, 9-12 och 24 månader | 2C |
| SPN med mellanliggande PM: PET-CT | 1B |
| negativ PET-CT: radiologisk observation | 2C |
| SPN med mellanliggande PM: biopsi-aspiration är ett acceptabelt alternativ | 2C |
| ingen histologisk diagnos: PET-CT | 1B |
| biopsi eller aspiration rekommenderas vid diskordance mellan kliniska PM och avbildningstester | 2C |
| misstänkt etiologi som kräver medicinsk behandling (t. ex. tuberkulos) | |
| patienter som vägrar eller invänder mot diagnostisk kirurgi | |
| SPN med hög PM: hantering enligt antagen diagnos av tidigt stadium karcinom | 2C |
| SPN med hög PM: FB med bronkialundersökning och transbronchial biopsi | 2D |
| icke-diagnostiserad SPN med PM större än låg hos opererbara patienter: SPN-resektion | 2C |
| rekommenderad teknik: videoassisterad thorakoskopi | 1C |
| Interoperativ biopsi för att fastställa typ av resektion | |
| Subcentimeter PNs associerad med SPN bör inte vara kontraindikation för botande karcinomoperation såvida det inte finns bekräftelse på metastasering. | 2C |
| SPNmm | |
| Observationsstrategi efter rekommendationer från Fleischner Society (Fig. 1) | 2C |
| lågdos, icke-kontrast CT-övervakning | 1C |
| Subsolid SPNs | |
| Intervention enligt rekommendationer från Fleischner Society (Tabell 2) | 1B till 2C |
| lågdos, icke-kontrast CT-övervakning | 1C |
FB: fibroskopi; PN: lungknut; SPN: ensam lungknut; PET: positronemissionstomografi; PM: Sannolikhet för malignitet; CT: datortomografi.
rekommendationsgrad efter styrka (stark 1 eller svag 2) och kvaliteten på vetenskapliga bevis som hög (a), måttlig (B), låg (C) eller mycket låg (D), enligt betygssystemet.
Inledning: koncept och etiologi
SPN definieras som en enda, sfärisk, distinkt, radiologisk opacitet med en lång axel på 30 mm, främst omgiven av luftad lunga och utan tillhörande atelektas, hilarförstoring eller pleural effusion.1-3 SPNs kan observeras på bröströntgen eller bröst datortomografi (CT) utförs för att studera andra sjukdomar eller för diagnostisk screening för lungcancer (LC).3,6,7 Millimetriska noduler (8 mm i diameter) 1,2,6 och subsolida noduler (SSNs)2,5 (Fig. 4), som kräver olika hantering, kan 5-7 detekteras på CT (Fig. 1). SSN inkluderar både slipade glasknutor och delvis fasta knölar som kombinerar en slipad glaskomponent med en fast komponent.2,5–7
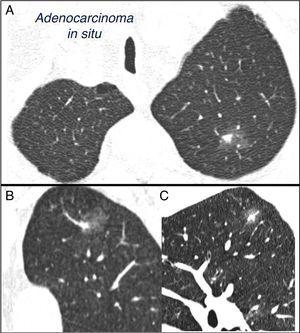
blandad subsolid ensam lungknut i vänster övre lob. Bröstberäknad tomografi med 2 mm tunna sektioner i en patient med en ensam lungknut i vänster övre lob. Axiell skiva (A) i övre lober och koronala (B) och sagittala (C) rekonstruktioner i vänster övre lob. En 18 mm markglas ensam pulmonell nodule observeras, med en 7 mm fast komponent i inredningen. Resektion genom videoassisterad thorakoskopi avslöjade adenokarcinom.
noduler beräknas inträffa med en hastighet av 1 eller 2 per 1000 röntgenstrålar.1,3,8 förekomsten av knölar på CTs utförda hos vuxna rökare för LC-screening är mycket hög, mellan 20% och 50% och är i allmänhet mindre än 10 mm i storlek; förekomsten i successiva årliga CTs är 10%.1,3,6,7
vid utvärdering av SPNs med CT finns ofta andra små knölar. När de är få eller en är tydligt dominerande, bör de betraktas som oberoende SPN, eftersom även om situationen är LC är medföljande subcentimeterknutor vanligtvis godartade.1,2,6,7 dessutom är den maligna nodulen i upp till 20% av fallen inte den största.7
SPN är den radiologiska manifestationen av många sjukdomar3 (Online Appendix-tabell 1s). De flesta knölar orsakas emellertid av lungmaligniteter, granulom och hamartom.1 förekomsten av malignitet varierar mellan serier8, 9: Från mellan 5% och 70%, beroende på om siffrorna hämtas från hälsokontroller eller studier av diagnostiska tekniker, och i mindre utsträckning i SPN som upptäckts i LC-screeningprogram, där prevalensen är 1% -10%, beroende på nodulstorlek.3,7 PM av SPNs ökar särskilt hos patienter med tidigare tumörsjukdom.3,10
de flesta maligna SPN är LC, oftast adenokarcinom och stora cellkarcinom.2,3 i malign SSN är de vanligaste stammarna i adenokarcinomspektret,5,11, 12 som sträcker sig mellan atypisk adenomatös hyperplasi i de minsta nodulerna, adenokarcinom in situ, minimalt invasivt adenokarcinom och invasiva adenokarcinom, om en fast komponent är närvarande, särskilt i mucinösa knölar och de med lepidisk tillväxt.5,11,12
diagnostiska tekniker i studien av ensam pulmonell NoduleChest datortomografi
denna teknik är vida överlägsen standard röntgen i utvärderingen av SPNs.2,3 det kan upptäcka andra knölar och mediastinala lymfadenopatier, diagnostisera pseudonoduler (extraparenkymala lesioner) och hjälpa till att planera nodulbiopsi eller aspiration. I vissa fall kan det ge en specifik diagnos, såsom arteriovenösa missbildningar, mycetom, rundad atelektas eller hamartom. Följaktligen är CT viktigt som indexundersökningen för studier av SPNs.2
Nodulförbättring eller upptag av kontrastmaterial visade en känslighet på 98% för malignitet med en cutoff på >15 Hounsfield-enheter (HU) och en specificitet på 58%.13 Detta gäller sfäriska, homogena SPNs>8 mm, utan fett, kalciumkavitation eller nekros. Detta kan vara värdefullt i centra med expertis inom denna teknik, men på grund av införandet av PET har användningen inte blivit utbredd.3
positronemissionstomografi
en av de viktigaste indikationerna för PET-CT med 18F-deoxi-D-glukos är studien av SPNs. Medelkänslighet för fasta SPN>10 – 15mm är 0.93 (konfidensintervall 0,90-0,95) och medelspecificitet är 0,8 (CI 0,74–0,85).2,14,15 falska negativ på PET-CT är associerade med defekt teknik, tumördiameter7mm, karcinoidtumörer, subsolida knölar och vissa adenokarcinom, särskilt in situ, minimalt invasiv, lepidisk tillväxt eller mucinös adenokarcinom.2,3 falska positiva är vanligare och inkluderar inflammatoriska och infektiösa skador, såsom granulom, tuberkulos, mykos eller pneumonier.2,16
PET-CT är mest användbar i SPNs>8mm med mellanliggande PM: en negativ studie minskar kraftigt PM.3 i en positiv PET-CT indikerar ett större standardiserat upptagningsvärde (SUV) större tumöraggressivitet och en sämre prognos för patienten, även om dess reducerade specificitet, och därmed risken för falskt positivt, måste beaktas.17,18 det kan också hjälpa till att välja den mest effektiva och tillgängliga platsen för biopsi och vid behov hjälpa till med planering av strålterapi.19 PET-CT bidrar till cancer staging2, 3 genom att utvärdera mediastinal och systemisk metastas, och rekommenderas i många LC-hanteringsriktlinjer.17,18,20 i dessa rekommendationer används PET-CT på två sätt: som ett verktyg för att karakterisera SPN och som en iscensättningsteknik i SPN med hög PM.
Cytohistologisk provtagning av ensam pulmonell Nodulberäknad tomografi, Radioskopi eller Ultraljudsstyrd fin nål Transthoracic Aspiration
en analys av litteraturen om 48 studier visar god känslighet, 86% (CI 84% -88%), för diagnos av malignitet och mycket god specificitet, 99% (CI 98% -99%).21 i SPN mindre än 15 mm är känsligheten lägre, vid 70% -82%.2,22 vid godartad sjukdom är specificiteten också lägre.21 medelhastigheten för pneumotorax var 15%, varav 7% krävde dränering.2,21,23 Transthoracic aspiration är kontraindicerad i fall av dåligt patientsamarbete, mycket komprometterad andningsfunktion eller enkel lunga eller hemorragisk diatese och i närvaro av emfysem eller omfattande bullae i nodulområdet. Mellan 4% och 50% av resultaten ger ingen diagnos och upp till 20% är falska negativa.2 om PM är hög är frekvensen av sanna negativa samma som för falska negativa, så det är inte användbart för att utesluta malignitet.2
fiberoptisk bronkoskopi och tillhörande tekniker
i LC, det diagnostiska utbytet av CT-styrd transbronchial aspiration (TBA) för att rikta nodulområdena, enligt serien, från 20% till 80%, och är lägre i SPN mindre än 20 mm, där medelutbytet är 30%.2 i godartade SPNs är utbytet 10%. Denna teknik är mer effektiv i större centrala knölar (>20 mm) med hjälp av ett luftbronkogram.2,24 det finns liten risk för TBA: pneumothorax,2%, 2 och mer sällan, hemoptys eller hematom. Även om det diagnostiska utbytet för SPNs är mindre än det som erhållits med transthoracic fine needle aspiration-biopsi (FNAB), kan en endobronchial undersökning utföras före planering av LC-operation.25 ultrafina bronkoskopier för bättre tillgång till lesioner, styrmantlar för placering av tången, radiell sond ultraljud endobronkoskopi, elektromagnetisk navigationsbronkoskopi och navigationsbronkoskopi är alla under utvärdering, eftersom de är tekniker som gör att tången kan styras mot nodulen, vilket förbättrar utbytet.2,26 dessa tekniker har jämförts i en metaanalys26: det kombinerade utbytet var 70%, bättre än i tidigare radioskopistyrda serier, och utbytet av de enskilda teknikerna varierade från 68,5% till 73%, även om stor variation och heterogenitet observerades bland studierna. Utbytet var lägre i SPNs20mm, 61% mot 80% i >20mm.kombinera tekniker kan förbättra utbytet något.2 som framgår av dessa data överträffar ingen teknik särskilt andra när det gäller avkastning, och rekommendationen är att varje centrum ska använda de tekniker för vilka både utrustning och expertis finns tillgängliga.
videoassisterad Thoracoscopy och Thoracotomy
SPNs kan resekteras med hjälp av dessa tekniker.2 Om SPN: erna är små eller ligger djupt i parenkymen, kan de tidigare färgas eller markeras med en haktråd, vanligtvis med CT-styrd transthoracic punktering. Riskerna med videoassisterad thorakoskopi är låga och dödligheten är mycket sällsynt (mindre än 1%), sjukligheten är låg och diagnosutbytet är bra, liknar thorakotomi men med lägre dödlighet.2 när SPN är LC, om patientens kliniska situation tillåter, indikeras anatomisk resektion: i allmänhet rekommenderas lobektomi och mediastinal noddissektion.2,20,27
uppskattning av sannolikheten för malignitet
maligna SPN skiljer sig från godartade SPN i vissa kliniska och radiologiska aspekter, som beskrivs mer detaljerat i den utökade versionen av dessa riktlinjer (se online-tillägg). De faktorer som är närmast förknippade med malignitet är storleken på SPN, marginalfunktioner, densitet, patientålder, ackumulerad tobakskonsumtion, förekomst av annan malignitet och upptäckt av tillväxt.2,3,6,7,10,28-30 Central, laminär eller total förkalkning av SPN anses vara ett bra kriterium för benignancy,2,3 liksom radiologisk stabilitet i mer än 24 månader, vilket innebär en fördubblingstid på över 730 dagar. Detta kriterium gäller inte för SSN, för vilket observationen måste förlängas till minst 3 år.1-3, 5
de flesta kliniker uppskattar PM intuitivt,men flera SPN–modeller och klassificeringsregler har föreslagits 7, 28-32 och det finns till och med räknare tillgängliga online (online Appendix-tabell 2S) eller som en smartphone-applikation (MedCalc medical calculator). Tabell 2s i online-bilagan ger en uppsättning formler erhållna från olika logistiska modeller och figur 1s är ett giltigt nomogram för SPN i röntgen i bröstet.
denna uppskattning av PM styr den efterföljande diagnostiska processen.1,2,31 logiskt sett, när man förutsäger malignitet, granskas resultaten av alla undersökningstekniker,inklusive PET-CT-resultaten,31, 32 biopsi eller aspirationsresultat och utvärdering av tillväxt, om lämpliga bilder finns tillgängliga.
tillsammans med PM måste de förutsebara fördelarna och riskerna med behandlingen bedömas. Det finns en tröskel PM som indikerar observation, dvs någon PM för vilken det mest rimliga alternativet är prospektiv observation av SPN: s stabilitet eller tillväxt; och en tröskel för operation, för vilken kirurgi tydligt rekommenderas eftersom sannolikheten för cancer i tidigt stadium är hög. Dessa tröskelvärden beror på de förväntade fördelarna; till exempel Sannolikhet för botemedel eller behandlingssvar i fall av malign sjukdom, de kirurgiska riskerna, som kan variera mellan patienter och patientens personliga attityd och preferens.1
Sekventiell utvärdering av den ensamma Lungknuten
syftet med att utvärdera en SPN är att diagnostisera och behandla SPN som representerar aktiv sjukdom, särskilt LC, eftersom 5-års överlevnad är 70% -80% i tidigt stadium sjukdom.20 Ett annat mål är att undvika att skicka patienter med granulom, hamartom och andra godartade lesioner till kostsamma och riskabla behandlingar. Det finns inget enskilt accepterat förfarande. Nyckelelementen för utvärdering är uppskattning av sannolikheten för malignitet, tillgänglighet till olika diagnostiska tester och klinikens expertis inom dessa tekniker och patientens preferenser.1,2
fikon. 1-3 visa den föreslagna sekventiella utvärderingen av SPN: Fig. 1 beskriver den initiala klassificeringen efter SPN-storlek, densitet och soliditet eller subsoliditet, separera patienter som behöver individualiserad hantering och de som kan diagnostiseras från början. Fig. 2 och 3 beskriver den föreslagna strategin för obestämda fasta SPN>8 mm, beroende på om tillgången till PET-CT är lätt (Fig. 2) eller svårare (Fig. 3).
klinisk och Initial radiologisk utvärdering (1)
den inledande undersökningen omfattar historia, undersökning och utvärdering av de radiologiska egenskaperna, tillsammans med jämförelse med alla tillgängliga tidigare Röntgenstrålar2,31: rekommendationsgrad, 1C.
om det inte finns några tecken på stabilitet för >2 år eller godartad förkalkning, anges CT med tunna sektioner genom nodulen av intresse2: rekommendationsgrad, 1b.
vissa noduler kan klassificeras i denna fas som godartade om de ses vara stabila i mer än 2 år eller från deras egenskaper på CT2,31: rekommendationsgrad, 2C.
i obestämda SPN fortsätter övervakningen, beroende på patientens egenskaper och nodulens radiologiska egenskaper.
patienter i speciella situationer (2)
en patients situation kan betraktas som speciell på grund av en förändring i den etiologiska frekvensen eller PM i SPN, eller eftersom proceduren är begränsad till icke-invasiva tekniker på grund av kirurgiska risker.
patienter med tidigare eller samtidig malign sjukdom. PM av lungknutor, oavsett om de är enkla eller flera,ökar kraftigt hos dessa patienter,3, 10 även om de är små.6 möjligheten till metastaser är ännu större om SPNs inte tidigare var närvarande. Ändå, när SPNs är subcentimetriska, är upp till en tredjedel godartade, så diagnosen måste bekräftas med biopsi, aspiration eller videoassisterad thorakoskopi innan man förnekar potentiellt botande behandlingar: rekommendationsgrad, 2C.2,10 SPN hos immunkompromitterade patienter kommer att kräva individualiserad utvärdering, och biopsi eller aspiration föredras.33
hos inoperabla patienter är utvärderingen av SPN begränsad. Biopsi eller aspiration indikeras i fall med höga PM eller positiva resultat på PET, för att styra kemoterapi eller strålbehandling om behandling av LC krävs: rekommendationsgrad, 2C.
ensam Lungknut>8 mm (3) (Fig. 2 och 3)
det första steget är att klassificera patienten enligt beräknad PM: låg (??5%), medelhög eller hög (> 65%) 1,2,29,31: rekommendationsgrad, 1C.
låg sannolikhet för malignitet (3, 1)
låg PM är den som uppskattas till mindre än 5%.2,31 detta inkluderar SPN som fortfarande är små (
mm), med distinkta marginaler, yngre patienter (2,28–32,34 i dessa fall rekommenderas radiologisk observation2, 31: rekommendationsgrad,2C.
ingår också SPN med mellanliggande PM och negativ PET-CT eller de som utvärderas med FNAB som visar icke-malignitet2: rekommendationsgrad, 2C.
mellanliggande Sannolikhet för malignitet (3, 2)
en PM mellan 5% och 65% anses vara mellanliggande.2,28-32,34 i dessa fall rekommenderas PET-CT, som är icke-invasiv, låg risk och med hög diskriminerande effekt (Fig. 2): rekommendationsgrad, 1B. ett negativt resultat minskar PM avsevärt, och observation kan rekommenderas; ett positivt resultat ökar PM och klassificerar det som högt.2,31
beroende på tillgänglighet och väntetider för att utföra PET-CT är ett alternativt förfarande CT-styrd FNAB eller fiberoptisk bronkoskopi (FB)-TBA styrd av radioskopi, ultraljudsendoskopi eller elektromagnetisk eller virtuell navigering (Fig. 3): rekommendationsgrad, 2C. Biopsialternativet är särskilt tillrådligt när den kliniska PM och fynd på avbildningstester är disharmoniska, när etiologier som kräver specifik medicinsk behandling (t. ex.tuberkulos) misstänks eller om patienten är negativ mot kirurgi2: rekommendationsgrad, 2C.
upprepande biopsi eller aspirationstekniker vid initial negativitet rekommenderas endast när PM i SPN är hög och diagnos före operation anses nödvändig, eller när kirurgi är kontraindicerat.
om resultatet är negativt rekommenderas PET-CT (Fig. 3): rekommendationsgrad, 1B.om ingen PET-CT är tillgänglig, skulle alternativet vara övervakning med CT, särskilt om FNAB var negativ eller kirurgi.
hög sannolikhet för malignitet (3, 3)
PM är hög hos patienter över 50 år, med en historia av rökning eller radiologiska egenskaper hos malignitet: SPN> 15 mm, spekulerade marginaler eller heterogen densitet. SPN som är hypermetaboliska på PET-CT, de som har ökat i storlek eller ändrat form och de med cytologi eller lungbiopsi som tyder på malignitet har också hög PM.2,28-32,34
i dessa fall rekommenderar vissa författare direkt diagnostisk terapeutisk kirurgi och andra föredrar biopsitekniker.2,31 i befolkningen som valts av denna algoritm, när patienter med andra cancerformer har uteslutits, är de flesta SPN lungcancer. Rekommendationen är således att de hanteras som sådana,2 med PET-CT rekommenderas som en metod för staging17,18: rekommendationsgrad, 2C.
histologisk diagnos före kirurgi kan bestämmas med FB-TBA, en teknik som också möjliggör en utvärdering av bronkialträdet innan operationen utförs eller av FNAB. Ett negativt resultat minskar inte tillräckligt PM för att utesluta resektion av SPN. Effekten av att försöka prekirurgisk diagnos av SPN med hög PM, vid kliniskt stadium i eller II med CT och PET-CT, förutsatt att patienten är opererbar, har inte undersökts. Av denna anledning erbjuds detta som ett alternativ i algoritmen (Fig. 2), även om pre-kirurgisk utvärdering med FB är en vanlig praxis: rekommendationsgrad, 2C.
om PET-CT avslöjar mediastinala eller extratorakala upptag som tyder på metastaser, bör dessa utvärderas före resektionskirurgi.17,18 om SPN med hög PM är negativ på PET-CT, är PM inte tillräckligt reducerad för att rekommendera observation, 2 och resektion via videoassisterad thorakoskopi rekommenderas: rekommendationsgrad, 2C. lägre upptag tyder dock på en bättre prognos och mindre sannolikhet för spridning, något som kan beaktas om patienten har en stark invändning mot operation.3,31
i den föreslagna strategin bör utvärderingen av en SPN med hög PM avslutas med en specifik diagnos eller diagnostisk terapeutisk resektion (Fig. 2 och 3).
ensam Lungknut mm (4)
förekomsten av dessa SPN är mycket hög i CT-studier, och PM är låg, såvida det inte finns en historia av tidigare eller samtidig metastaserande tumör.2,6 de är svåra att komma åt för att få biopsier och PET-CT och dynamisk CT har mycket låg känslighet.2,6 en observationsstrategi som följer rekommendationerna från Fleischner Society6 (Fig. 1) föreslås, med beaktande av asymptomatiska patienter utan samtidig malign sjukdom: rekommendationsgrad, 2C.
uppföljning utförs med lågdos, icke-kontrast CT6: rekommendationsgrad, 1C. återigen måste patienten informeras och hans/hennes preferenser måste beaktas.2
Subsolid pulmonell Nodule (5)
dessa är slipade glasknutor, rena eller med en fast komponent5 (Fig. 4). Bestämning av en subsolid nodul kräver tunna sektioner, företrädesvis av 1 mm, eftersom små fasta SPN i 5 mm CT-skivor kan förekomma som slipat glas.2,5
SSN är svåra att komma åt för biopsi eller aspiration och känsligheten hos PET-CT är låg.5,35 å andra sidan är deras PM relativt hög, 15% eller mer i fallet med markglas SPN och över 50% för en blandad nodul.5 det är också svårare att fastställa förändringar i storlek eller volym av dessa lesioner under övervakning, och maligniteter som uppträder i denna form kan vara indolenta under en längre period, varför observationsperioden måste vara längre,5 dvs minst 3 år.
eftersom många godartade etiologier är akuta eller subakuta processer föreslås en initial observationsstrategi med CT vid 3 månader, eftersom vissa SPN kan försvinna. Om de kvarstår kommer strategin att bestämmas av SPN: s storlek, om de har en fast komponent och om de är singel eller flera (Fig. 1). Tabell 2 listar i detalj de rekommendationer som föreslagits av Fleischner Society.5
hantering av Subsolida knölar.
| betyg av Rekommendationa | ||||
| markglas SPN | ||||
| ≤5mm | ingen uppföljning | 1C | ||
| >5mm | CT vid 3 månader | Persistent | årlig Ctfölj upp >3 år | 1B |
| delvis fast SPN (fast del) | ||||
| mm | CT vid 3 månader | ihållande | årlig Ctföljning >3 år | 2C |
| ≥5mm | CT vid 3 månader | Persistent | biopsi, resektion, PET-CT om fast del > 10mm | 1B |
| flera markglas PN | ||||
| ≤5mm | överväga icke-maligna orsaker | CT vid 2 och 4 år | 1C | |
| >5mm | CT vid 3 månader | Persistent | årlig Ctfölj upp >3 år | 1B |
| multipel PN med fast komponent | CT 3 månader | Persistent | biopsi, resektion, speciellt om fast del >5mm | 1C |
PN: pulmonell nodul; SPN: ensam pulmonell nodul; PET: positronemissionstomografi; CT: datortomografi. Rekommendationsklassen är den som föreslagits av Fleischner Society,5 baserat på betygssystemet. Rekommendationerna från American College of Chest Physicians2 minskar styrkan i rekommendationen med en klass. CT för utvärdering måste vara fin skiva och uppföljning av lågdos CT.
rekommendationsgrad efter styrka (stark 1 eller svag 2) och kvaliteten på vetenskapliga bevis som hög (a), måttlig (B), låg (C) eller mycket låg (D), enligt betygssystemet.
slutliga möjligheter efter utvärdering
- A.
diagnos av benignancy: Patienter med en specifik diagnos på CT, såsom hamartom, arteriovenösa missbildningar, cystiska lesioner, rundad atelektas, mycetom, pseudonoduler eller förkalkade knölar, eller som har kriterier för benignancy, t. ex. dokumenterad stabilitet i minst 2 år, vid fasta knölar, eller minst 3 år för subsolida noduler2, 3: rekommendationsgrad, 2C.
- B.
radiologisk observation: anges i SPNs med låg PM, eller med mellanliggande PM när PET-CT är negativ, rekommendationsgrad, 2C. Detta kan också anges i odiagnostiserade SPNs om risken för operation är mycket hög eller om patienten vägrar operation: rekommendationsgrad, 2C.
för SPN>8 mm med låg PM rekommenderas CT-övervakning vid 3-6 månader, igen vid 9-12 månader och igen vid 24 månader.2 Det finns specifika strategier för SPN 8 mm och ssn2,5,6 (Fig. 1 och Tabell 2): rekommendationsgrad, 2C. övervakning CTs måste utföras med lågdos och icke-kontrast: rekommendationsgrad, 1C.
- C.
diagnostisk-terapeutisk kirurgi: Opererbara patienter med odiagnostiserad SPN och PM större än låg bör erbjudas resektion: rekommendationsgrad, 2C. även om videoassisterad thorakoskopi är den metod du väljer (rekommendationsgrad, 1C), kommer varje kirurgiskt team att besluta om det bästa tillvägagångssättet. Intraoperativ biopsi rekommenderas för att slutföra lämplig resektion vid LC: rekommendationsgrad, 1C.
- D.
specifik diagnos: detta är den etiologiska diagnosen SPN. Om LC diagnostiseras kommer specifika lokala staging-och behandlingsprotokoll att tillämpas.20
algoritmen kan inte slutföras utan att betona att det optimala beslutet måste innehålla yttrandet och preferensen hos den lämpligt informerade patienten2: rekommendationsgrad, 1C.
intressekonflikt
författarna uppger att de inte har någon intressekonflikt.