化学において、無等値点は滴定を行う際に使用される用語です。 それはappliesto酸基盤か中和の反作用技術的に。
定義:
化学反応の等価点は、等量の反応物が化学的に混合される点である。 <4666><6224>つまり、滴定しながら、滴定剤の添加量が分析物溶液を完全に中和するのに十分である点である。 滴定剤のモル数すなわち 標準溶液は、未知の濃度を有する溶液のモルに等しい。 それは酸のモルが溶液を中和するために必要とされる塩基のモルに等しい点であるため、化学量論的点としても知られている。 酸対塩基比は1:1である必要はないことに注意してください。 この酸-塩基比は平衡酸-塩基化学式によって説明される。 指標は、この目的のために使用することができ、例えば、メチルオレンジまたはフェノールフタレイン。

等価点は滴定の終点と同じではありません。 エンドポイントは、使用されているインジケーターの色が変化するポイントとして参照されます。 これらの色の変化は、等価点に達した後に表示されます。 Endpointを使用して等価性を判断すると、エラーが発生します。
等価点を決定する方法:
等価点を決定するための異なる方法があります。 以下のように議論されている。:
- pHインジケータ
- コンダクタンス
- 色の変化
- 降水量
- 等温熱量測定
- 温度滴定測定
- 分光学
- アンペロメトリー
- アンペロメトリー
- アンペロメトリー
- アンペロメトリー
- アンペロメトリー
- アンペロメトリー
- アンペロメトリー
- アンペロメトリー
phインジケータ:
Aphインジケータは、化学変化に反応して色を変化させる化学物質です。 酸塩基指示薬、例えば、フェノールフタレインは、そのpHに依存するその色を変化させる。 最初に、指標溶液の単一滴がティトレーション。 色の変化は、端点が達成されたことを示します。これは等価点の推定になります。
コンダクタンス:
溶液の電気伝導度はイオンの影響を受けます。 したがって、それらが互いに反応すると伝導性が変化する。 (例えば、酸塩基滴定を実行しながら、H3O+、およびOH-イオンが反応し、neutral水、H20溶液を形成する)。 コンダクタンスは、特に溶液中に存在するイオンが導電性に寄与する場合には、比較的困難な方法である。 コンダクタンスは、いくつかの酸塩基のために使用することができます反応。
色の変化:
等価点では、溶液はいくつかの反応で指標を追加することなく自然に色を変化させます。 これは、酸化状態が異なる色からなる遷移金属で観察され得る。
沈殿:
滴定中に、反応が固体を形成する場合、沈殿が形成される。 沈殿の良い例は反応である銀、Ag+、および塩素、Cl-の間に、その結果、非溶解性塩、塩化銀、AgClが形成される。 意外なことに、これは粒子サイズ、速度のofsedimentationおよび色のためにそれを非常に困難なtodetermine端点を正確に見ることを非常に困難にさせます。 これが、沈殿滴定が逆滴定として行われる理由である。
等温熱量測定:
等温滴定熱量計と呼ばれる装置を使用して、生成または吸収される熱量を計算することによって、等価点の決定が行われます。 このタイプは、通常、生化学的反応、すなわち酵素結合としての滴定に使用される。
温度測定滴定:
熱測定は非常に多面的な技術です。 ここで、等価点は、化学反応によって生成される温度変化の速度を測定することによって決定される。 この特性は、熱量測定と区別されます。 温度測定滴定は相対的な技術であるため、等温条件下で滴定を行う必要はありません。 このタイプのtitrationはプラスチックでまた更にガラス容器で行なうことができる。 Preventstrayの草案には、これらの容器は通常騒音のthatdisturbsの終点を引き起こすことによって囲まれています。 包囲された条件の下でbeconductedへのこのタイプの滴定の能力のためにそれらは企業の定期的なprocessandの品質管理のために適切です。 温度は滴定プロセスの間に増加するか、または滴定とanalyte間の反作用のtakingplaceが発熱または吸熱であるかどうかによって、増加します。 すべての分析物が反応によって消費された場合、温度変化の速度、すなわち温度変化が起こる。 増加または減少は、等価を決定する温度曲線の点および変曲を観察することができる。 等価点は温度曲線の二次導関数を用いることによって正確に観察することができる。 現代automatedthermometric滴定システムで使用されるソフトウェアは敏感な温度の調査から発生する騒音が終点を記述する規則的な、均一secondderivativeピークの出現の干渉をnotcauseしないこと規則的な高度のデジタルalgorithmssoから成っている。 この技術に能力のofveryの高精度およびより少しにより0.1areusualの分散係数(CVs)があります。 最も最近の温度測定の滴定の温度の調査にthermistorthatの形態Wheatstone橋の1つの腕がある。 最もよい温度測定のtitrationsystemは10-5Kに高resolutionelectronicsにつながれたら温度を解決できる。 滴定を行っている間温度が0.001Kとしてaslittleになれば鋭い同等ポイントは得られます。 エンタルピー変化がある場合、この技術は流体中の任意の化学反応に必然的に適用することができるが、反応速度論は終点の鋭さを計算する上で重要な役割を果たす。 滴定のこの点は、酸-塩基、EDTA、酸化還元および沈殿滴定に実質的に適用されている。 沈殿滴定の重要な例は次のとおりです:
- バリウムイオンによる硫酸塩のろ過
- アンモニウム溶液中のマグネシウムによるリン酸塩のろ過
- 硝酸銀による塩化物のろ過
- ジメチルグリオキシムによるニッケルのろ過
- アルミニウムによるフッ化物のろ過(K2Naalf6として)
Asnon水様の滴定は水様の滴定として電位差滴定で要求されるので温度の調査がthesolutionに電気で接続されるように要求しないので容易に遂行することがで Arehighly濁ったか、または着色される解決はサンプルのanyfurtherの処置なしで温度測定によって容易に分析することができます。 調査は手入れ不要である。 今度は最も最近の、非常にprécised段階モーターによって運転されるburettesを使用する日thistechniqueに実験室の高い生産が必要である完全な選択をするbyusingは数分以内に
分光法:
このタイプでは、反応物、生成物または滴定剤のスペクトルが既知である場合、分光法を使用して等価点を決定します。 製品の特定の量と反応物は、等価点を見つけるために使用されます。 非常に低いレベルの遊離滴定剤の存在も決定することができる。 要するに、この方法が使用される半導体の存在を決定する。
アンペロメトリー:
アンペロメトリーは、電流の変化を測定するために使用される検出技術です。アンペロメトリーは余分な滴定がbereducedできるそれらの滴定で大抵使用されます。 この方法は沈殿物の形成が影響を受けないのでAg+とのハロゲン化物を滴定する間有用です。
等価点の例:
- 強酸と強塩基の反応:
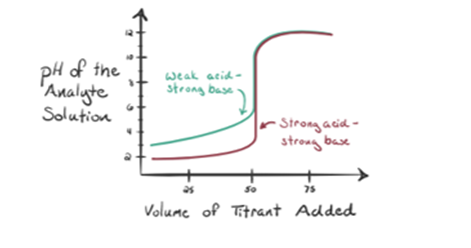
塩酸HCl(強酸)が分析物として取られ、水酸化ナトリウムNaOH(強塩基)が滴定剤として取られると仮定しましょう。 分析物pHとビュレットから添加することができる滴定NaOHとの間のグラフをプロットすると、以下のような滴定グラフが形成されます:
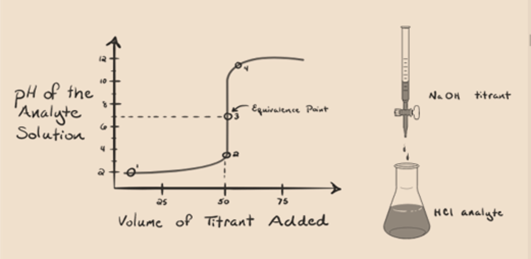
図1.1
上の図1.1は、NaOHのような塩基が添加されていない場合の点1を示しています。 分析物のpHはHClの分離からのH3O+を大抵含んでいるので低いです。

水酸化ナトリウムNaOHが滴下して添加されると、それはNAOHの解離によって生成されるOH–ゆっくりと吸収され始める。 生成された分析物は、支配的なハイドロニウムイオン、H3O+の存在のために酸性である。
図1.1の2点は、中和が完全に行われる直前にpHが記録された時点を示しています。 点3は等価点を示していますが。 ここで、添加される水酸化ナトリウムのモルは、分析物中の塩化ヒドロキシルのモルに等しい。 これは、ヒドロニウムイオン、H3O+がヒドロキシルイオン、OH–によって完全に中和される点である。 それは塩、NaClと水H2Oを持っているので、溶液のpHは中性すなわちpH=7です.
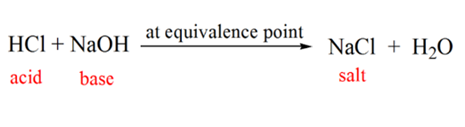
図1.1のポイント4は、NaOHの添加を続けると、HClの完全な中和のために溶液のpHが塩基性になり始めることを示しています。 現在、NaOHから解離する溶液中にはたくさんのOH–イオンが存在しています。
- 弱酸と強塩基との反応:
滴定剤として弱酸、酢酸CH3COOH、強塩基水酸化ナトリウムNaOHを考えてみましょう。 分析物のpHとNaOHの体積との間のグラフをプロットすると、以下に示すような滴定曲線が得られます。
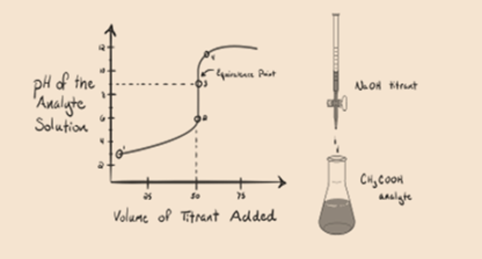
図1.2
図1.2は、ポイント1でNaOHがまだ添加されていないことを示しているため、CH3COOHが解離するとh3O+がほとんど含まれているため、分析物のpH しかし、酢酸は弱い酸であるため、最初はそのpHが高くなります。

NaOHを滴下し続けると、H3O+はOH–ゆっくりと得られ始めます。 これはnaohの解離によって生成される。 しかし、ここでは、分析物は、主にH3O+イオンの存在のために依然として酸性である。
図1.2ポイント2は、無中和が完全に起こる直前の時点で記録されたpHを示しています。
ポイント3は等価点を表します。 これは、NaOHのモルが分析物中のCH3COOHのモルに等しい点である。 ハイドロニウムイオンはヒドロキシルイオンによって完全に中和される。 解決はそれからCh3Coonaの塩およびH2Oを含んでいます.

注:
強塩基に対して滴定された強酸を有するケース1と比較して、ここでの違いに気づくことができます。 この場合(弱酸および強塩基)、pHは等価点で中性ではない。 溶液は、等価点でpH-9を有する。 以下の理由を考えてみましょう。
上の式から、解は等価点にCh3Coonaを含むことが示されています。 これはナトリウムイオンと酢酸イオンに解離する。 アセテートイオンは弱酸CH3COOHの共役塩基である。 したがって、CH3COO–は比較的強い塩基である(すなわち、弱酸は強い共役塩基を有する)ので、水と反応して同等の点でpHを9に近くまで増加させる水酸化物イ
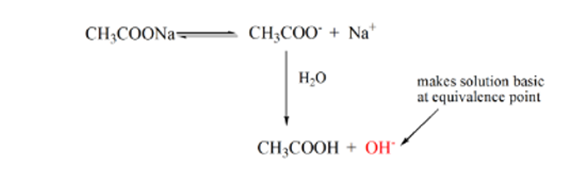
図1.2のポイント4は、水酸化ナトリウムがより多くの量である場合、得られた滴定曲線はHCl-NaOHと同一であることを示しています。
- 弱い基盤とのStrongacid:
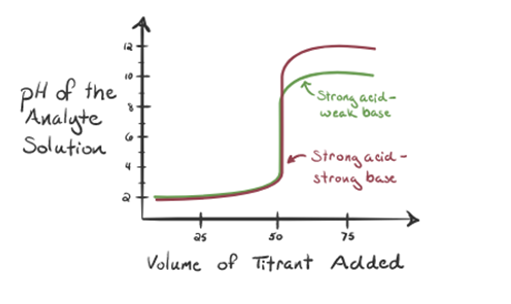
ここでは、分析物としての強酸としての塩酸、滴定剤としての弱塩基としてのアンモニアを考えてみましょう。 分析物溶液のpHと滴定剤NH3の体積との間のグラフをプロットすると、以下のような滴定曲線が得られます。:
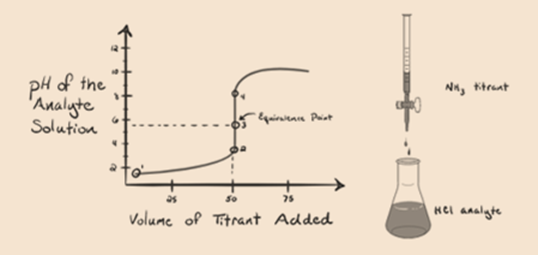
図1.3
図1.3のポイント1は、アンモニアを添加しないと、塩酸の解離からH3O+がほとんど含まれているため、分析物のpHが低くなることを示しています。
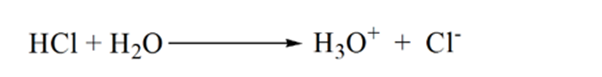
アンモニアが一滴ずつ添加されると、h3O+はアンモニアによってゆっくりと消費され始めます。 分析物は、H3O+イオンの大部分のために依然として酸性である。
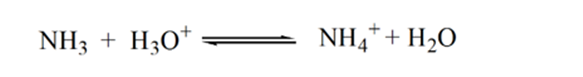
図1.3のPoint2は、phが完全に脱水素化が起こる直前の点で記録されていることを示しています。
Point3は等価点を示します。 ここで、添加されたNh3のモル数は、分析物中のHClのモル数に等しい。 ヒドロニウムイオンはNH3によって完全に中和される。
注:
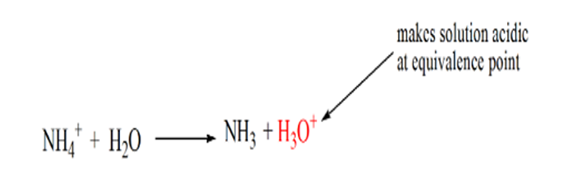
それは強酸に対する弱い塩基の場合、pHは等価点で中性ではないことに気づいた。 したがって、達成される溶液は、同等の点で約5.5のpHを有する酸性である。
この理由は、等価な点では、溶液はアンモニウムイオンNH4+と塩化物イオンCL-しか持たないからです。 アンモニウムイオンが弱い基盤すなわちNH3の共役酸であるので。 従って、NH4+は強い酸であり、解決を酸性にさせるhydroniumイオンを作り出すためにこうしてNH4+は水と反応します。
ポイント4は、等価点を達成した後、アンモニアを添加し続け、過剰になるとpHが増加し始めることを示しています。 アンモナルは弱い基盤です従ってpHは7の上にありますが、場合1に示されている強い基盤NaOHと比べてより低いです。
- 弱酸性の弱塩基:
分析物としての弱塩基であるアンモニアと滴定剤としての弱酸である酢酸を考えてみましょう。 分析物溶液のpHと滴定剤としての酢酸の体積との間のグラフをプロットすると、以下のような滴定曲線が得られます:
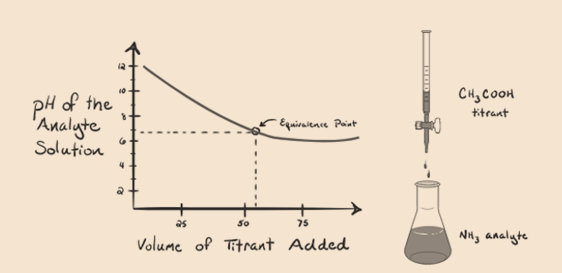
図1.4
このグラフプロットには急勾配がないことに気付きました。 これは、等価点での「変曲点」と呼ばれるものです。 PHの急な変化がないことは、そのような鋭敏さを通して私たちに多くの情報を与えません。