”To Be, or not to Be: that is the question.”Vaikka me kaikki olemme valmiita elämän ja kuoleman ratkaisuihin, tämä eksistentiaalinen kahtiajako on poikkeuksellisen jyrkkä alkion soluille. Ohjelmoitu solukuolema eli apoptoosi* on normaali osa kehitystä. Sukkulamadossa C. elegans, jossa voimme laskea solujen määrän, kuolee tasan 131 solua normaalin kehityksellisen kaavan mukaan. Kaikki tämän sukkulamadon solut ”ohjelmoidaan” kuolemaan, ellei niitä aktiivisesti kielletä käymästä apoptoosissa. Ihmisillä jopa 1011 solua kuolee jokaisessa aikuisessa joka päivä ja ne korvautuvat toisilla soluilla. (Normaalin solukuoleman vuoksi menettämämme solumassa On todellakin lähellä Koko ruumiinpainoamme!) Kohdussa teimme ja tuhosimme jatkuvasti soluja, ja synnyimme noin kolme kertaa niin paljon hermosoluja kuin lopulta saimme syntyessämme. Lewis Thomas (1992) on osuvasti todennut,
kun synnyin, enemmän minusta oli kuollut kuin selvinnyt. Ei ihme, etten muista.; tuona aikana kävin aivot toisensa jälkeen läpi yhdeksän kuukautta ja lopulta kehittelin sen ainoan mallin, joka voisi olla ihminen, joka olisi varustettu kielelle.
apoptoosi on välttämätön paitsi neuronien oikean etäisyyden ja suunnan kannalta, myös välikorvan tilan, emättimen aukon sekä sormien ja varpaiden välien tuottamiseksi Saunders and Fallon 1966roberts and Miller 1998;Rodriguez et al. 1997. Apoptoosi karsii tarpeettomat rakenteet, kontrolloi tiettyjen kudosten solujen määrää ja veistää monimutkaisia elimiä.
eri kudokset käyttävät erilaisia signaaleja apoptoosiin. Yksi selkärankaisilla usein käytetyistä signaaleista on luun morfogeneettinen proteiini 4 (BMP4). Jotkin kudokset, kuten sidekudos, reagoivat BMP4: ään erilaistumalla luustoksi. Toiset, kuten sammakko gastrula ectoderm, reagoivat bmp4: ään erilaistumalla ihoksi. Toiset, kuten hermoston harjusolut ja hampaiden primordia, reagoivat hajottamalla DNA: nsa ja kuolemalla. Esimerkiksi kehittyvässä hampaassa kiilteen solmu erittää lukuisia kasvu-ja erilaistumistekijöitä. Kun kiilasolmu on kasvanut, se syntetisoi bmp4: n ja sulkeutuu apoptoosin vaikutuksesta (katso Luku 13; Vaahtokari ym. 1996b).
muissa kudoksissa solut ”ohjelmoidaan” kuolemaan, ja ne pysyvät elossa vain, jos jokin kasvu-tai erilaistumistekijä on läsnä ”pelastamassa” niitä. Tämä tapahtuu nisäkkäiden punasolujen kehittymisen aikana. Hiiren maksan punasolujen esiasteet tarvitsevat erytropoietiinihormonia selviytyäkseen. Jos he eivät saa sitä, heille tehdään apoptoosi. Erytropoietiinireseptori toimii JAK-STAT-reitin kautta aktivoiden Stat5-transkriptiotekijän. Näin erytropoietiinin määrästä voidaan päätellä, kuinka monta punasolua verenkiertoon pääsee.
yksi apoptoosin kulkureiteistä rajattiin suurelta osin C. elegansin geneettisten tutkimusten avulla. Havaittiin, että CED-3-ja CED-4-geenien koodaamat proteiinit olivat välttämättömiä apoptoosille, mutta soluissa, jotka eivät läpikäyneet apoptoosia, nämä geenit sammutettiin CED-9-geenin tuotteella (Kuva 6.27 A; Hengartner et al. 1992). CED-4-proteiini on proteaaseja aktivoiva tekijä, joka aktivoi CED-3-proteaasin, joka käynnistää solun tuhoutumisen. CED-9-proteiinia inaktivoivat mutaatiot aiheuttavat lukuisia soluja, jotka normaalisti selviäisivät aktivoimaan CED-3-ja CED-4-geeninsä ja kuolevat. Tämä johtaa koko alkion kuolemaan. Vastaavasti CED-9: n gain-of-function-mutaatiot aiheuttavat CED-9-proteiinin muodostumisen soluissa, jotka muuten kuolisivat. CED-9-geeni vaikuttaakin olevan binäärikytkin, joka säätelee solutasolla valintaa elämän ja kuoleman välillä. On mahdollista, että sukkulamadon alkion jokainen solu on valmis kuolemaan, ja CED-9-geenin aktivointi pelastaa ne solut, jotka jäävät eloon.
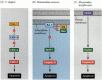
kuva 6. 27
apoptoosireitit sukkulamatoilla ja nisäkkäillä. A) C. elegansissa CED-4-proteiini on proteaaseja aktivoiva tekijä, joka voi aktivoida CED-3-proteaasin. CED-3-proteaasi käynnistää solutuhotapahtumat. CED-9 voi inhiboida CED-4: ää (ja CED-9 voi olla (lisää…)
CED-3-ja CED-4-proteiinit muodostavat kaikille tutkituille eläimille yhteisen apoptoosireitin Keskuksen. Apoptoosin laukaisija voi olla kehityskeppi, kuten tietty molekyyli (kuten bmp4 tai glukokortikoidit) tai tarttuvuuden menetys matriisiin. CED-3-tai CED-4-proteiinit voivat aktivoitua tai CED-9-molekyylit inaktivoitua. Nisäkkäillä CED-9-proteiinin homologiat kuuluvat BCL-2-geeniperheeseen. Tähän perheeseen kuuluvat BCL-2, Bcl-X ja vastaavat geenit. Toiminnalliset yhtäläisyydet ovat niin vahvoja, että jos aktiivinen ihmisen BCL-2-geeni sijoitetaan C. elegansin alkioihin, se estää normaalisti tapahtuvat solukuolemat sukkulamatojen alkioissa (Vaux et al. 1992). Selkärankaisten punasolujen kehityksessä (edellä mainittu) erytropoietiinin aktivoima Stat5-transkriptiotekijä toimii sitoutumalla Bcl-X-geenin promoottoriin, jossa se aktivoi kyseisen apoptoosiproteiinin synteesin (Socolovsky et al. 1999).
CED-4: n nisäkkäiden homologia on nimeltään Apaf-1 (apoptoottinen proteaasiaktivoiva tekijä-1), ja se osallistuu nisäkkäiden CED-3-homologien, proteaasien kaspaasi-9 ja caspase-3 sytokromi-C: stä riippuvaiseen aktivaatioon (Shaham and Horvitz 1996; Cecconi et al. 1998; Yoshida ym. 1998). Kaspaasien aktivoituminen aiheuttaa solun autodigestion. Kaspaasit ovat vahvoja proteaaseja, ja ne sulattavat solun sisältäpäin. Soluproteiinit pilkkoutuvat ja DNA pirstoutuu.†
vaikka apoptoosin puutteelliset sukkulamadot, joilla on CED-4: n puute, ovat elinkelpoisia (huolimatta siitä, että niillä on 15% enemmän soluja kuin villin tyypin matoilla), hiiret, joilla on joko kaspaasi-3: n tai kaspaasi-9: n toiminnan heikkenemistä aiheuttavia mutaatioita, kuolevat syntymän aikoihin hermoston valtavaan solujen liikakasvuun (kuva 6.28; Kuida et al. 1996, 1998; Jacobson ym. 1997). Homotsygoottina apaf-1: n kohdennettuihin poistoihin tarkoitetuilla hiirillä on vakavia kallon ja kasvojen poikkeavuuksia, aivojen liikakasvua ja varpaiden välistä räpylää.
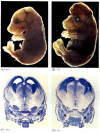
kuva 6, 28
apoptoosin estämisen aiheuttama aivojen normaalin kehityksen häiriö. Hiirillä, joissa kaspaasi-9 tai Apaf-1 on tyrmätty, normaali hermoapoptoosi jää toteutumatta. Caspase 9-puutteellisilla hiirillä aivojen hermosolujen yliproliferaatio on ilmeinen morfologisella (more…)
nisäkkäillä apoptoosiin johtaa useampi kuin yksi reitti. Esimerkiksi apaf-1: n tai kaspaasi-9: n deleetio ei vaikuta lymfosyyttien apoptoosiin, ja se toimii CD95-proteiinin aloittamaa erillistä reittiä pitkin (kuva 6.27B, C) eri kaspaasit voivat toimia eri solutyypeissä välittämään apoptoottisia signaaleja (Hakem et al. 1998; Kuida ym. 1998).
verkkosivusto
6.7 apoptoosin käyttötarkoitukset. Apoptoosia käytetään lukuisissa prosesseissa koko kehityksen ajan. Sivusto tutkii apoptoosin roolia muun muassa Drosophila-sukusolujen kehityksessä ja sokean luolakalan silmissä. http://www.devbio.com/chap06/link0607.shtml
Box
Cell-Cell Interactions and Chance in the Determination of solutyypit.
alaviitteet
*
Apoptosis (molemmat ”p”lausutaan) tulee kreikan sanasta, joka tarkoittaa puista putoavien lehtien tai kukkien terälehtien luonnollisia prosesseja. Se on aktiivinen ja voidaan evolutionaarisesti valita. Toinen solukuolema, nekroosi, on ulkoisten tekijöiden, kuten tulehduksen tai myrkkyvamman aiheuttama patologinen kuolema.
†
on joitakin todisteita (katso Barinaga 1998a, b; Saudou et al. 1998), että aikuisten neuronien apoptoosireitin aktivoituminen voi olla vastuussa Alzheimerin taudin ja aivohalvauksen patologiasta. DNA: n pirstoutuminen on yksi tärkeimmistä tavoista, joilla apoptoosi tunnistetaan, ja se näkyy aivojen alueilla, joihin nämä sairaudet vaikuttavat. Sen pirstoutuminen tietyn kokoisiksi kappaleiksi(nukleosomien suojaamina ja koossa pitäminä) voi johtua kaspaasi-3: n (Lazebnik et al. 1994). PARP tunnistaa ja korjaa DNA-katkoksia. Lisätietoja muista apoptoosiin johtavista poluista, Katso vihreä 1998.