En chimie, un point d’équivalence est un terme utilisé lors de l’exécution de la titration. Il applique techniquement toute réaction acide-base ou de neutralisation.
Définition:
Le point d’équivalence d’une réaction chimique est le point auquel des quantités égales de réactifs sont mélangées chimiquement.
En d’autres termes, lors du titrage, c’est un point où la quantité de titrant ajoutée est suffisante pour neutraliser complètement la solution d’analyte. Le nombre de moles de titrant i.e. la solution étalon est égale aux moles d’une solution ayant une concentration inconnue. Il est également connu sous le nom de point stoechiométrique car c’est un point où les moles d’acide sont égales aux moles de la base nécessaires pour neutraliser la solution. Notez que le rapport acide / base n’a pas besoin d’être de 1: 1. Ce rapport acide-base s’explique par l’équation chimique équilibrée acide-base. Des indicateurs peuvent être utilisés à cette fin, par exemple le méthyl orange ou la phénolphtaléine.

Le point d’équivalence ne peut pas être pris comme le point final d’un titrage. Le point de terminaison estse réfère au point auquel l’indicateur utilisé change de couleur. Ces changements de couleur apparaissent après avoir atteint le point d’équivalence. Si nous utilisons theendpoint pour déterminer l’équivalence, cela induira une erreur.
Méthodes de détermination du Point d’équivalence:
Il existe différentes méthodes pour la détermination du point d’équivalence. Ils sont discutés comme suit:
- Indicateur de pH
- Conductance
- Changement de couleur
- Précipitation
- Calorimétrie isotherme
- Titrimétrie thermométrique
- Spectroscopie
- Ampérométrie
Indicateur de pH:
L’indicateur apH est une substance chimique qui change de couleur en réaction à toutchangement chimique. Un indicateur acide-base, par exemple, la phénolphtaléine change sa couleur qui dépend de son pH. Des indicateurs redox peuvent également être utilisés à cet effet. Initialement, une seule goutte de solution indicatrice est ajoutée à latitration. Le changement de couleur montrera que le point final a été atteint.Ce sera une estimation du point d’équivalence.
Conductance:
La conductivité électrique d’une solution est affectée par les ions. Par conséquent, la conductivité change lorsqu’ils réagissent les uns avec les autres. (par exemple, lors d’un titrage acide-base, les ions H3O + et OH- réagissent et forment de l’eau neutre, une solution H20). La conductance est une méthode relativement difficile àpérifier, en particulier lorsque les ions présents dans la solution peuventparticiper à la conductivité. La conductance peut être utilisée pour quelques acides.actions.
Changement de couleur:
Au point d’équivalence, la solution changera de couleur naturellement sans ajout d’indicateur dans certaines réactions. Cela peut être observé en transitionles métaux où l’état d’oxydation est constitué de différentes couleurs.
Précipitation:
Pendant le titrage, le précipité se formera si la réaction forme un solide. Un bon exemple de précipitation est la réactionentre l’argent, Ag +, et le chlore, Cl- qui entraîne la formation de sel aninsoluble, Chlorure d’argent, AgCl. De façon inattendue, cela rend très difficile la détermination précise des points finaux en raison de la taille des particules, du taux de sédimentation et de la couleur, il est très difficile à voir. C’est la raison pour laquelle le titrage par précipitation est effectué sous forme de titrages en arrière.
Calorimétrie isotherme:
La détermination du point d’équivalence se fait en calculant la quantité de chaleur produite ou absorbée à l’aide d’un dispositif appelé calorimètre de titrage isotherme. Ce type est généralement utilisé dans les titrages impliquant des réactions biochimiques, c’est-à-dire comme liaison enzymatique.
Titrimétrie thermométrique:
La titrimétrie thermométrique est une technique exceptionnellement multiforme. Ici, le point d’équivalence est déterminé en mesurant la vitesse de changement de température produite par une réaction chimique. Cette propriété le différencie de la calorimétrictitrimétrie. La titrimétrie thermométrique étant une technique relative, il n’est pas nécessaire d’effectuer le titrage dans des conditions isothermes. Ce type de titration peut être effectué dans des plastiques ou même dans des récipients en verre. Pour éviter les courants d’air, ces vaisseaux sont généralement fermés en provoquant un bruit qui perturbe le point final. En raison de la capacité de ce type de titrage à être effectué dans des conditions ambiantes, ils conviennent au processus de routine et au contrôle de la qualité dans l’industrie. La température augmentera ou diminuera pendant le processus de titrage, selon que la place de réaction entre le titrant et l’analyte est exothermique ou endothermique. Ittitration lorsque tout l’analyte a été consommé par la réaction, le taux de température change, c’est-à-dire une augmentation ou une diminution détermine l’équivalencele point et l’inflexion de la courbe de température peuvent être observés. Le point d’équivalence peut être observé précisément en employant la dérivée seconde de la courbe de température. Le logiciel utilisé dans un système de titrage thermométrique automatisé moderne est constitué d’algorithmes numériques avancés réguliers, de sorte que le bruit généré par les sondes de température hautement sensibles ne provoque aucune interférence avec l’apparition d’un second pic de rotation régulier et uniforme qui décrit le point final. Cette technique a la capacité de très haute précision et le coefficient de variance (CVs) inférieur à 0,1 est habituel. Les dernières sondes de température de titrage thermométrique ont un thermistorqui forme un bras d’un pont de Wheatstone. le meilleur système de titrage thermométrique peut résoudre la température à 10-5 K s’il est couplé à une électronique à haute résolution. Si les changements de température pendant l’exécution du titrage deviennent aussi faibles que 0,001 K, un point d’équivalence net sera obtenu. Lorsqu’il y a un changement d’inthalpie, cette technique peut être appliquée nécessairement à n’importe quelle réaction chimique dans un fluide, bien que la cinétique de réaction joue un rôle important dans le calcul de la netteté du point final. Ce point de titrimétrie a été substantiellement appliqué au titrage acido-basique, EDTA, REDOX et par précipitation. Les exemples importants de titrage des précipitations comprennent:
- Sulfatétitration avec des ions baryum
- Phosphatétitration avec du Magnésium en solution d’ammonium
- Chlorhydratitration avec du nitrate d’argent
- Nickeltitration avec du Diméthylglyoxime
- Fluorure avec de l’aluminium (comme K2NaAlF6)
Les titrages Asnon aqueux peuvent facilement être effectués en titrage aqueux car la sonde de température ne nécessite pas d’être connectée électriquement à la solution comme cela est requis dans les titrages potentiométriques. Les solutions très troubles ou colorées peuvent être facilement analysées par thermométrie sans traitement supplémentaire d’un échantillon. La sonde ne nécessite aucun entretien. Maintenant, une journée en utilisant les burettes à moteur pas à pas les plus récentes et très précises, les titrages thermométriques sont terminés en quelques minutes, ce qui en fait un choix parfait là où une production élevée en laboratoire est nécessaire.
Spectroscopie:
dans ce type, la spectroscopie est utilisée pour déterminer le point d’équivalence si le spectre du réactif, du produit ou du titrant est connu. Une quantité spécifique du produitet réactif est utilisée pour trouver le point d’équivalence. Un niveau très faible de la présence du titrant libre peut également être déterminé. En bref, cette méthode est utiliséepour déterminer l’existence de semi-conducteurs.
Ampérométrie:
L’ampérométrie est une technique de détection utilisée pour mesurer la variation du courant.L’ampérométrie est principalement utilisée dans les titrages où l’excès de titrant peut être réduit. Cette méthode est utile lors du titrage d’un halogénure avec Ag + car la formation des précipités ne sera pas affectée.
Exemples de point d’équivalence:
- La réaction d’un acide fort avec une base forte:
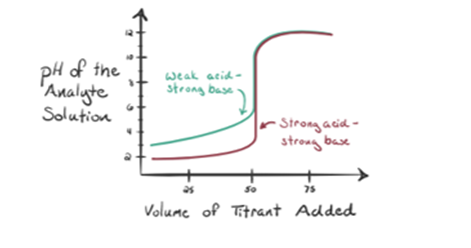
Supposons que l’acide chlorhydrique HCl (un acide fort) soit pris comme analyte et que l’hydroxyde de sodium NaOH (base forte) soit pris comme titrant. Si nous tracons un graphique entre le pH de l’analyte et un NaOH titrant qui peut être ajouté à partir de la burette, un graphique de titrage sera formé comme indiqué ci-dessous:
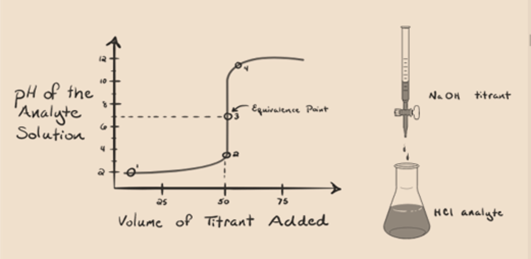
Figure 1.1
La figure 1.1 ci-dessus montre au point 1 que lorsqu’aucune base comme NaOH n’est ajoutée. Le pH de l’analyte est faible car il contient principalement du H3O+ provenant de la séparation du HCl.

Comme l’hydroxyde de sodium NaOH est ajouté goutte à goutte, il commence à être absorbé par OH–lentement qui est produit par la dissociation de NaOH. L’analyte produit sera acide en raison du dominantprésence d’ions hydronium, H3O +.
Sur la figure 1.1, le point 2 indique le moment auquel le pH est enregistré juste avant que la neutralisation ne se produise complètement. Alors que le point 3 nous montre le point d’équivalence. Ici, les moles d’hydroxyde de sodium ajoutées sont égales aux moles du chlorure d’hydroxyle dans l’analyte. C’est le point où les ions hydronium, H3O+, sont complètement neutralisés par l’ion hydroxyle, OH–. Le pH de la solution est neutre, c’est-à-dire pH = 7 car elle contient du sel, du NaCl et de l’eau H2O.
Le point 4 de la figure 1.1 montre qu’au fur et à mesure de l’ajout de NaOH, le pH de la solution commence à devenir basique à cause de la neutralisation complète de l’HCl. Maintenant, il y a beaucoup d’ions OH– présents dans la solution qui se dissocie de NaOH.
- La réaction d’un acide faible avec une base forte:
Considérons un acide faible, un acide acétique CH3COOH et un hydroxyde de sodium à base forte NaOH comme titrant. Si nous tracons un graphique entre le pH de l’analyte et le volume de NaOH, nous obtiendrons une courbe de titrage comme indiqué ci-dessous.
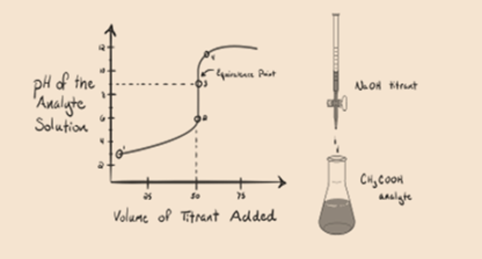
Figure 1.2
La figure 1.2 montre au point 1 que le NaOH n’est pas encore ajouté, donc à l’heure actuelle, le pH de l’analyte est faible car il contient principalement du H3O + lorsque le CH3COOH se dissocie. Mais comme l’acide acétique est un acide faible, son pH sera d’abord plus élevé.

Comme nous continuons à ajouter du NaOH goutte à goutte, H3O + commencera à être consommé par OH–lentement. Cela sera produit par la dissociation de NaOH. Mais ici, l’analyte est encore acide en raison de la présence d’ions H3O + principalement.
En figure 1.2 le point 2 indique le pH enregistré à un moment juste avant que l’aneutralisation ne se produise complètement.
Le point 3 représente le point d’équivalence. C’est le point où les moles de NaOH sont égales aux moles de CH3COOH dans un analyte. Les ions hydronium sont complètement neutralisés par les ions hydroxyle. La solution contiendra alors du sel de CH3COONa et de l’H2O.

Remarque:
Vous pouvez remarquer une différence ici par rapport à un cas 1 avec un acide fort titré contre une base forte. Dans ce cas (acide faible et base forte), le pH n’est pas neutre à un point d’équivalence. La solution a un pH ~ 9 au point d’équivalence. Voyons la raison ci-dessous.
De l’équation ci-dessus, on montre que la solution contient CH3COONa au point d’équivalence. Cela se dissocie en un ion sodium et des ions acétate. L’ion acétate est la base conjuguée de l’acide faible CH3COOH. Par conséquent, CH3COO– est relativement une base forte (c’est-à-dire que l’acide faible a une base conjuguée forte), ils réagissent donc avec l’eau pour produire des ions hydroxydes qui augmentent le pH jusqu’à près de 9 au point d’équivalence.
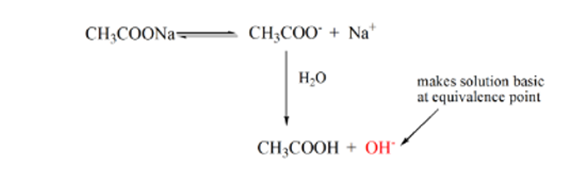
Le point 4 de la figure 1.2 montre que lorsque l’hydroxyde de sodium est en plus grande quantité, la courbe de titrage gagnée sera identique à HCl-NaOH.
- Acide fort avec une base faible:
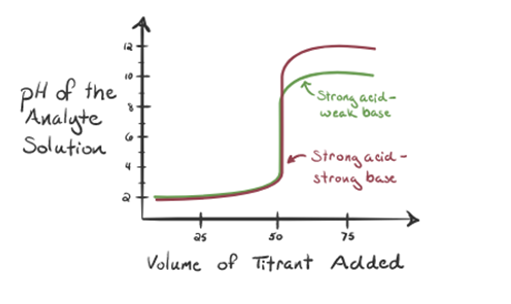
Considérons ici l’acide chlorhydrique comme un acide fort en tant qu’analyte et l’ammoniac comme une base faible en tant que titrant. Si nous tracons un graphique entre le pH de la solution d’analyte et le volume du titrant NH3, nous obtiendrons une courbe de titrage comme indiqué ci-dessous:
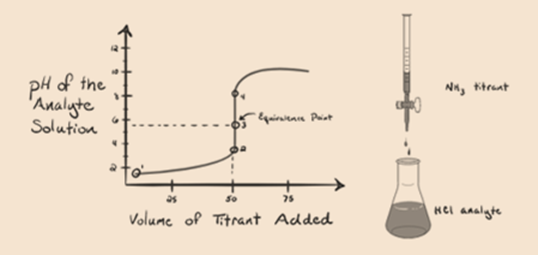
La figure 1.3
Dans la figure 1.3, le point 1 montre que lorsqu’aucun ammoniac n’est ajouté, le pH de l’analyte sera faible car il contient principalement du H3O + issu de la dissociation de l’acide chlorhydrique.
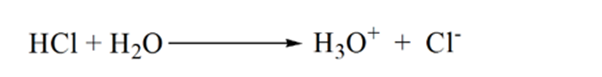
Lorsque l’ammoniac est ajouté goutte à goutte, H3O + commence à être consommé lentement par l’ammoniac. L’analyte sera encore acide en raison de la majorité des ions H3O +.
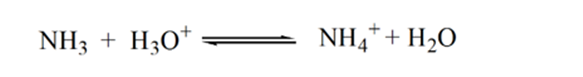
Le Point2 de la figure 1.3 indique que le pH est enregistré en un point juste avant que l’aneutralisation ne se produise complètement.
Point3 indique le point d’équivalence. Ici, le nombre de moles de NH3 ajoutéest égal aux moles de HCl dans l’analyte. Les ions hydronium sont entièrement neutralisés par NH3.
Note:
Il a remarqué que dans le cas de la base faible contre un acide fort, le pH n’est pas neutre au point d’équivalence. D’où la solution obtenue sera acide ayant un pH d’environ 5,5 au point d’équivalence.
La raison en est qu’à un point d’équivalence, la solution ne contient que des ions ammonium NH4+ et des ions chlorure, CL-. Comme les ions ammonium sont l’acide conjugué d’une base faible, c’est-à-dire NH3. Par conséquent, NH4+ est un acide fort et donc NH4+ réagira avec l’eau pour produire des ions hydronium qui rendent la solution acide.
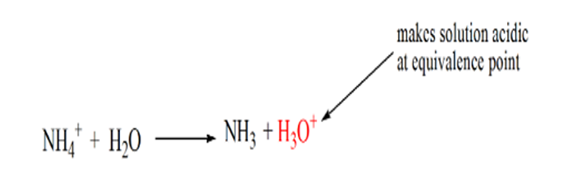
Le point 4 montre qu’après avoir atteint un point d’équivalence, nous continuerons à ajouter de l’ammoniac et lorsqu’il sera en excès, le pH commencera à augmenter. L’ammoniac est une base faible donc son pH est supérieur à 7 mais aussi inférieur à une base forte NaOH représentée dans le cas 1.
- Base faible avec un acide faible:
Considérons l’ammoniac, une base faible comme analyte et un acide acétique qui est un acide faible comme titrant. Si nous tracons un graphique entre le pH de la solution d’analyte et le volume de l’acide acétique en tant que titrant, nous obtiendrons une courbe de titrage comme ci-dessous:
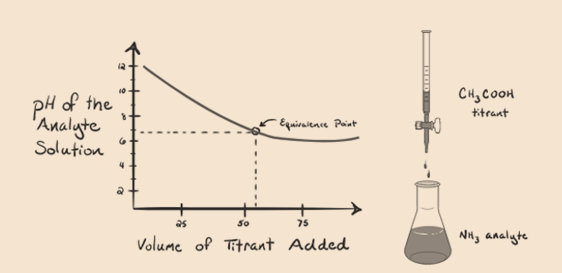
Figure 1.4
Nous avons remarqué qu’il n’y a pas de pente dans ce graphique. C’est ce que nous appelons un » point d’inflexion » au point d’équivalence. L’absence de changement abrupt du pH requis ne nous donne pas beaucoup d’informations à travers une telle courbe.