US Pharm. 2016; 41(4):HS15-HS20.
rezumat: aspergiloza invazivă (IA) este o infecție fungică rară, gravă, care afectează frecvent pacienții imunocompromiși. Incidența exactă a IA nu a fost documentată, iar ratele de incidență raportate variază foarte mult. Unii factori de risc tipici pentru IA includ transplanturile de celule stem hematopoietice, terapia cu corticosteroizi pe termen lung, malignitățile hematologice și HIV. Plămânii sunt locul cel mai frecvent al IA; în consecință, simptomele și manifestările clinice sunt de obicei pulmonare. Din cauza riscului ridicat de deces, managementul IA cu agenții corespunzători trebuie să înceapă cât mai repede posibil. Voriconazolul este terapia empirică de primă linie recomandată de liniile directoare ale societății de Boli Infecțioase din America; dacă nu există un răspuns clinic, atunci trebuie administrată terapia de salvare cu alți azoli, echinocandine sau formulări de lipide amfotericină B.
aspergiloza este o infecție fungică cauzată de Aspergillus, care cuprinde un grup mare de specii de mucegai omniprezente (spp) cel mai frecvent întâlnite în vegetația în descompunere.1 aspergiloza, care se observă cel mai frecvent la persoanele imunocompromise, este o cauză semnificativă a morbidității și mortalității la această populație, cu rate de mortalitate de până la 90%.2,3 există mai multe tipuri de infecții cu aspergiloză, inclusiv aspergiloză bronhopulmonară alergică, sinuzită alergică cu Aspergil, aspergilom, aspergiloză pulmonară cronică, aspergiloză cutanată și aspergiloză invazivă (IA). Majoritatea acestor infecții sunt cauzate de Aspergillus fumigatus, urmate de Aspergillus flavus, Aspergillus niger și Aspergillus terreus.4-6 IA, în special, este una dintre cele mai severe infecții cu aspergiloză și are o rată ridicată a mortalității.5
etiologie și Epidemiologie
factorii de risc comuni Pentru IA includ transplantul de celule stem hematopoietice (TCSH), neutropenia prelungită și severă, afecțiunile maligne hematologice, terapia cu corticosteroizi pe termen lung și HIV. Cu toate acestea, anumite populații imunocompetente ale UCI, cum ar fi pacienții cu boală pulmonară obstructivă cronică, boli hepatice severe sau boli critice care perturbă temporar sistemul imunitar, prezintă, de asemenea, un risc crescut de IA.5 incidența IA într-o UTI tipică este raportată a fi de 0,33% până la 6,9%, ceea ce este comparabil cu incidența la pacienții cu transplant de organe solide.4,5
aspergiloza nu este o infecție raportabilă în Statele Unite, deoarece este mai puțin frecventă și nu este considerată o amenințare gravă la adresa sănătății publice.6 ca urmare, incidența exactă a IA nu a fost documentată. În plus, ratele de incidență raportate pot varia substanțial, sugerând că geografia poate juca un rol.4 în rândul primitorilor de transplant, incidența IA variază, cu afecțiuni comune subiacente, inclusiv limfom și leucemie.7 la pacienții cu transplant de organe solide, incidența IA este mai mare la pacienții cu transplant pulmonar și hepatic (2,4% -6% și, respectiv, 1% -8%) decât la pacienții cu transplant renal și cardiac (0,1% -4% și, respectiv, 0,3% -6%).4 incidența IA la pacienții cu TCSH este chiar mai mare. Pacienții cu TCSH alogen au o incidență IA de 2,3% până la 11%, ceea ce reprezintă mai mult de două ori rata de incidență observată la pacienții cu TCSH autolog (0,5% -4%).4 rata globală a cazurilor de deces a fost calculată la 58%.7,8 cu toate acestea, ratele de deces ale IA variază în funcție de starea de bază. Într-o revizuire sistematică a 53 de studii din 1995 până în 1999, rata de deces a cazurilor la pacienții cu IA a fost cea mai mare la pacienții cu antecedente de transplant de măduvă osoasă (86,7%) sau HIV/SIDA (85,7%) și cea mai mică la pacienții cu leucemie sau limfom (49,3%).7
patogeneză
după inhalarea unei conidii fumigatus (spori aerieni), celulele epiteliale respiratorii și macrofagele alveolare declanșează răspunsuri imune înnăscute împotriva Aspergillus conidia inhalate. Acești agenți patogeni recunosc apoi receptorii de pe celulele gazdă, cum ar fi receptorul beta-glucan Dectin-1. Interacțiunea dintre agenții patogeni și receptori provoacă chemokine și citokine și activează și recrutează monocite și neutrofile. Neutrofilele se atașează la hifele fungice și se degranulează, ducând la uciderea fungică. Acest atac este mediat de nicotinamidă adenină dinucleotid fosfat oxidază. În cazul neutropeniei, neutrofilele nu sunt disponibile pentru uciderea hifală și controlul creșterii fungice, astfel încât hifele în creștere se pot răspândi apoi pe toată mucoasa celulelor endoteliale.8
manifestări clinice
plămânii sunt locul cel mai frecvent al IA. În consecință, simptomele IA și manifestările clinice sunt de obicei pulmonare. Într-un studiu, Lee și colegii săi au observat simptome IA la 36 de pacienți și au constatat că hemoptizia a fost cea mai frecventă manifestare clinică (72%), urmată de tuse, dificultăți de respirație și oboseală.9 anchetatorii au remarcat că simptomele IA au variat de la hemoptizie asimptomatică la masivă (uneori fatală), iar rata de debut a simptomelor a variat în funcție de sistemul imunitar al pacientului. Pacienți cu un anumit grad de imunosupresie (de exemplu., SIDA, utilizarea corticosteroizilor, diabetul zaharat, alcoolismul) pot prezenta o dezvoltare mai rapidă a simptomelor (adică săptămâni, mai degrabă decât luni).10 într-un sondaj de 6 ani realizat de Cornillet și colegii săi, febra a fost cel mai frecvent semn clinic la pacienții cu IA, prezentându-se la 85% dintre pacienți (n = 88); durerea toracică a fost, de asemenea, frecventă.11 simptome suplimentare includ pierderea în greutate, transpirații și anorexie.10
diagnostic
cultivarea țesuturilor este în prezent standardul de aur pentru diagnosticul IA.11 această metodă nu numai că produce Aspergillus spp, dar definește în continuare opțiunile terapeutice prin testarea susceptibilității. Cu toate acestea, invazivitatea obținerii țesutului face ca cultura să fie mai puțin de dorit. În absența probelor de țesut, lichidul de lavaj bronhoalveolar (BAL) obținut din tractul respirator superior și inferior poate servi la stabilirea diagnosticului de IA.12 deși BAL este o procedură sigură, sensibilitatea generală a culturii folosind specimene BAL este relativ scăzută (estimată la 50%).13 prelevarea de probe de sânge este abordarea optimă de diagnostic neinvaziv pentru IA.12 Cu toate acestea, în ciuda acestei neinvazivități, Aspergillus spp sunt rareori izolate din sânge prin tehnici de cultură convenționale—de aici dependența de specimene de țesut pentru a asigura un diagnostic definitiv al IA.12 deoarece rezultatele din culturi sunt relativ lente pentru a obține în general, IA este bine stabilită în momentul în care cultura este pozitivă. Aceste provocări au dus la dezvoltarea unor metode de diagnostic mai puțin invazive și mai rapide.
testul galactomannan seric este un test rapid care este aprobat pentru a diagnostica cazurile suspecte de IA la pacienții cu afecțiuni maligne hematologice sau HSCT.13 Galactomananul, o polizaharidă eliberată în fluidele corporale în timpul creșterii Aspergillus, poate fi detectată în probele serice și BAL cu câteva zile înainte de apariția semnelor și simptomelor clinice.13 detectarea serului poate facilita stabilirea unui diagnostic specific, în timp ce lichidul BAL pare să aibă o sensibilitate mai mare, dar este adesea mai greu de obținut.12,13 Meersseman și colegii săi au raportat că sensibilitatea detectării galactomannanului este de 88% pentru BAL față de 42% pentru ser, iar specificitatea galactomannanului atât pentru BAL, cât și pentru ser a fost de 86%.14 un rezultat seric pozitiv poate permite inițierea agenților antifungici, în timp ce un rezultat negativ poate împiedica utilizarea medicamentelor antifungice scumpe și toxice.12 măsurarea (1,3)-beta-D-glucanului în sânge poate fi, de asemenea, utilă ca instrument de screening pentru IA. Deși testul galactomannan este specific pentru IA, testul (1,3)-beta-D-glucan poate detecta și alte boli fungice invazive, inclusiv candidoza, alți agenți patogeni ai mucegaiului și Pneumocystis jiroveci.15
Management
tratamentul antifungic rămâne pilonul principal al tratamentului IA.2 pentru a preveni complicațiile și rezultatele slabe, tratamentul antifungic trebuie inițiat imediat la pacienții cu risc crescut de IA.2 Societatea de Boli Infecțioase din America (IDSA) recomandă utilizarea voriconazolului pentru tratamentul primar al aspergilozei pulmonare invazive, precum și pentru alte manifestări, cum ar fi infecțiile cu aspergiloză ale sinusurilor, aspergiloza sistemului nervos central și aspergiloza pulmonară necrotizantă cronică.2 dacă tratamentul primar eșuează, formulările lipidice ale amfotericinei B (AMB), caspofunginei și itraconazolului pot fi utilizate ca terapie de salvare.2 ghidurile IDSA recomandă, de asemenea, utilizarea posaconazolului pentru profilaxie la pacienții neutropenici cu mielodisplazie și leucemie, precum și la pacienții cu HSCT alogen cu boală grefă-contra-gazdă (GvHD).2
tratament empiric
voriconazol: un studiu randomizat, non-orb, care a comparat voriconazolul cu AMB, a constatat că 52, 8% dintre pacienții cu voriconazol au prezentat rezultate reușite (rezoluția completă sau parțială a leziunilor la radiologie).16 grupul cu voriconazol a avut, de asemenea, o rată de supraviețuire mai mare decât pacienții cu AMB (70, 8% față de 57.9%) și mai puține evenimente adverse (343 evenimente vs .421 evenimente; P=.02), determinând anchetatorii să concluzioneze că voriconazolul este superior AMB.16 doza de voriconazol recomandată de ghidurile IDSA (tabelul 1) a fost susținută în acest studiu.2 voriconazolul are un profil de efecte adverse care include sensibilitatea pielii cu expunere la lumina directă a soarelui, tulburări vizuale și hepatotoxicitate caracterizată printr-o creștere a bilirubinei serice și a enzimelor hepatice.2
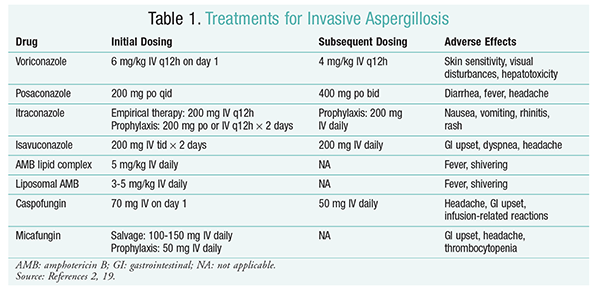
AMB: anterior, AMB deoxicolatul a fost standardul de îngrijire pentru aspergiloză. Cu toate acestea, reacțiile legate de perfuzie (inclusiv febră, rigori, artralgii, vărsături și bronhospasme) și nefrotoxicitatea care duce la insuficiență renală potențială au determinat scăderea AMB din favoare.2 În plus, azotemia poate apărea atunci când AMB deoxicolatul este administrat concomitent cu agenți nefrotoxici (de exemplu ciclosporină sau tacrolimus).2 ca urmare, IDSA recomandă formulări complexe lipidice ca alternativă, deoarece incidența efectelor adverse este mai mică decât cea pentru formularea deoxicolată. Mai mult, într-un studiu efectuat de Walsh și colegii săi care au comparat complexul lipidic AMB cu caspofungina, ratele de succes au fost similare (33,7% pentru AMB, 33,9% pentru caspofungină); prin urmare, ghidurile de tratament enumeră atât complexul lipidic AMB, cât și caspofungina ca alternative la voriconazol.17
Echinocandinele (caspofungină, Micafungină, Anidulafungină): deși caspofungina a fost aprobată pentru tratamentul IA, micafungina și anidulafungina nu s-au dovedit eficace în tratamentul primar al IA și, prin urmare, nu sunt recomandate de IDSA.18 caspofungina poate provoca cefalee, tulburări gastro-intestinale și posibile reacții legate de perfuzie datorită eliberării histaminei.2
Isavuconazol: în martie 2015, FDA a aprobat un nou triazol de a doua generație pentru IA. Comercializat sub denumirea comercială Cresemba, isavuconazolul este disponibil atât în soluții orale, cât și IV și este indicat pentru tratamentul IA și mucormicozei.19 într-o comparație între isavuconazol și voriconazol, studiul SECURE a stabilit că noul medicament a avut rezultate similare în ceea ce privește mortalitatea de orice cauză și răspunsul global la sfârșitul tratamentului. Obiectivul final principal al mortalității de orice cauză până în ziua 42 a fost de 19% pentru isavuconazol și 20% pentru voriconazol.20 cu toate acestea, isavuconazolul a fost considerat neinferior, deoarece anchetatorii au utilizat o marjă de neinferioritate de 10% (IÎ -7,8-5,7). Isavuconazolul a prezentat mai puține evenimente adverse decât voriconazolul, în special evenimente care au implicat ochii, pielea și sistemul hepatobiliar.19 în cele din urmă, isavuconazolul are o biodisponibilitate orală ridicată, rezultând un raport 1:1 într-o conversie între formulările IV și cele orale.
terapia de salvare
ghidurile IDSA nu recomandă terapia asociată pentru tratamentul inițial al IA. În schimb, terapia de salvare este recomandată numai dacă nu există un răspuns clinic la terapia inițială. În consecință, aceasta poate implica adăugarea unui al doilea agent sau trecerea la un alt medicament. Posaconazolul, itraconazolul, AMB și caspofungina au fost studiate pentru a fi utilizate ca terapie de salvare și sunt recomandate de ghidurile IDSA. Walsh și colegii săi au investigat eficacitatea și siguranța posaconazole 800 mg suspensie pe zi la pacienții care au avut intoleranță sau nu au răspuns la agentul antifungic inițial.21 rata globală de succes a fost de 42% pentru grupul cu posaconazol și de 26% pentru grupul de control (P = .006).21 un studiu realizat de Ng și Denning a demonstrat o rată de răspuns de 40% atunci când o formulare pe bază de lipide a AMB a fost utilizată ca terapie de salvare la pacienții cu IA care erau refractari sau intoleranți la terapia existentă.22 caspofungina a fost, de asemenea, examinată ca terapie de salvare într-un studiu multicentric necomparativ la pacienți refractari la terapia convențională; un răspuns favorabil a apărut la 44,6% dintre pacienți.23
profilaxie
posaconazol: ghidurile IDSA recomandă utilizarea posaconazolului pentru profilaxia IA. Această recomandare se bazează pe două studii randomizate, controlate, multicentrice, care au evaluat utilizarea profilactică a posaconazolului la pacienții cu neutropenie și GvHD.24,25 primul studiu a comparat posaconazolul (3 200 mg/zi) cu fluconazolul (1 400 mg / zi) sau itraconazolul (2 200 mg / zi). IA a fost raportată la 1% dintre pacienții din grupul cu posaconazol față de 7% dintre pacienții din grupurile cu fluconazol și itraconazol (P <.001).26 al doilea studiu a comparat posaconazolul cu fluconazolul pentru profilaxie la pacienții cu GvHD. IA a fost mai puțin frecventă în grupul cu posaconazol decât în grupul cu fluconazol (1,0% față de 5,9%; P = .001).25
Micafungin: Deși nu este aprobat pentru profilaxia de primă linie a IA, ghidurile IDSA recomandă micafungin ca alternativă la posaconazol. Această recomandare se bazează pe un studiu randomizat, dublu-orb, de fază III, la 882 de pacienți cărora li s-a administrat micafungin 50 mg IV (1 mg/kg la pacienți <50 kg) comparativ cu fluconazol 400 mg (8 mg/kg la pacienți <50 kg). Eficacitatea a fost definită ca absența unei infecții fungice sistemice dovedite, probabile sau suspectate. În timpul fazei neutropenice, eficacitatea globală a micafungin a fost superioară celei a fluconazolului (80% pentru grupul micafungin vs.73.5% pentru grupul cu fluconazol; IÎ 95%, 0,9% -12%; P = .03).27
concluzie
IA este o infecție fungică severă care apare cel mai frecvent la pacienții imunocompromiși. Mai multe întrebări trebuie abordate în diagnosticul, tratamentul și prevenirea aspergilozei. Criteriile de Diagnostic sunt slab definite, ceea ce face dificilă diagnosticarea IA. Datorită riscului crescut de deces, terapia antifungică trebuie inițiată rapid și corect pentru a fi eficientă. Există lacune critice în ceea ce privește utilizarea terapiei combinate, instrumente pentru depistarea precoce și populațiile de pacienți la care profilaxia ar fi cea mai benefică.2 prin urmare, este important ca farmaciștii să fie informați cu privire la caracteristicile fiecărui agent antifungic pentru a fi cel mai bine echipați pentru a lua decizii terapeutice solide în tratamentul IA. Într—adevăr, având în vedere riscul crescut de rezistență antifungică, farmaciștii pot juca un rol important în gestionarea IA, ajutând la minimizarea și gestionarea efectelor adverse, făcând recomandări adecvate de dozare și monitorizând selecția agenților antifungici adecvați-toate acestea fiind esențiale pentru optimizarea terapiei pentru IA.
1. Denning DW. Aspergiloză invazivă. Clin Infectează Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW și colab. Tratamentul aspergilozei: ghiduri de practică clinică ale societății de Boli Infecțioase din America. Clin Infectează Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Aspergiloza pulmonară: o revizuire clinică. EUR Respir Rev. 2011; 20: 156-174.
4. Poliția Barnes, Marr KA. Aspergiloza: spectru de boală, diagnostic și tratament. Infectează Dis Clin North Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. aspergiloză invazivă în unitatea de terapie intensivă. Ann NY Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B și colab. O abordare statistică în conectomul creierului uman al bolii Parkinson la persoanele în vârstă care utilizează statistici bazate pe rețea. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Cazul aspergilozei-rata mortalității: revizuirea sistematică a literaturii. Clin Infectează Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogeneza Aspergillus fumigatus în aspergiloza invazivă. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY și colab. Manifestări clinice și rezultatele tratamentului aspergilomului pulmonar. Coreeană J Intern Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Spectrul clinic al aspergilozei pulmonare. Torace. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S și colab. Compararea caracteristicilor epidemiologice, clinice și biologice ale aspergilozei invazive la pacienții neutropenici și nonneutropenici: un studiu de 6 ani. Clin Infectează Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, și colab. Testul imunologic enzimatic Aspergillus galactomannan și PCR cantitativ pentru diagnosticul aspergilozei invazive cu lichid de lavaj bronhoalveolar. J Clin Microbiol. 2004;42:5517-5522.
13. Grâu LJ, Walsh TJ. Diagnosticul aspergilozei invazive prin detectarea antigenemiei galactomannane utilizând un test imunologic enzimatic. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer a, și colab. Aspergiloza invazivă la pacienții cu afecțiuni critice fără malignitate. Am J Respir Crit Care Med. 2004;170:621-625.
15. Șerif R, Segal BH. Aspergiloza pulmonară: prezentare clinică, teste de diagnostic, management și complicații. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF și colab. Voriconazol versus amfotericină B pentru terapia primară a aspergilozei invazive. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR și colab. Caspofungină versus amfotericină B lipozomală pentru terapia antifungică empirică la pacienții cu febră persistentă și neutropenie. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM și colab. Micafungin (FK463), singur sau în asociere cu alți agenți antifungici sistemici, pentru tratamentul aspergilozei invazive acute. J Infecta. 2006;53:337-349.
19. Pettit NN, Carver PL. Izavuconazol: o nouă opțiune pentru gestionarea infecțiilor fungice invazive. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA și colab. Isavuconazol versus voriconazol pentru tratamentul primar al mucegaiului invaziv cauzat de Aspergillus și alte ciuperci filamentoase (SECURE): un studiu de fază 3, randomizat, controlat, de non-inferioritate. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF și colab. Tratamentul aspergilozei invazive cu posaconazol la pacienții refractari sau intoleranți la terapia convențională: un studiu controlat extern. Clin Infectează Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Terapia lipozomală cu amfotericină B (Ambisomă) în infecțiile fungice invazive. Evaluarea datelor privind utilizarea compasiunii din Regatul Unit. Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, și colab. Eficacitatea și siguranța caspofunginei pentru tratamentul aspergilozei invazive la pacienții refractari sau intoleranți la terapia antifungică convențională. Clin Infectează Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ și colab. Profilaxia cu posaconazol vs. fluconazol sau itraconazol la pacienții cu neutropenie. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.