US Pharm. 2016; 41 (4): HS15-HS20.
ABSTRAKT: Invazivní aspergilóza (IA) je vzácné, závažné plísňové infekce obvykle postihuje imunokompromitovaných pacientů. Přesná incidence IA nebyla zdokumentována a hlášená incidence se velmi liší. Mezi typické rizikové faktory IA patří transplantace hematopoetických kmenových buněk, dlouhodobá terapie kortikosteroidy,hematologické malignity a HIV. Plíce jsou nejčastějším místem IA; v důsledku toho jsou příznaky a klinické projevy obvykle plicní. Vzhledem k vysokému riziku úmrtí musí být řízení IA s příslušnými agenty zahájeno co nejrychleji. Vorikonazol je první linie empirické terapie doporučuje Infekčních Chorob Society of America pokyny; pokud tam je žádné klinické odpovědi, pak salvage terapie s jinými azoly, echinokandiny nebo amfotericin B lipidový přípravky by měly být podávány.
Aspergilóza je plísňová infekce způsobené Aspergillus, který zahrnuje velkou skupinu všudypřítomné plísně druhů (spp) nejvíce často nalezené v rozkládající se vegetaci.1 Aspergilóza, která je nejčastěji pozorován u imunokompromitovaných osob, je významnou příčinou morbidity a mortality v této populaci, s úmrtnosti jak vysoce jak 90%.2,3 existuje několik typů infekcí aspergilózy, včetně alergické bronchopulmonální aspergilózy, alergické sinusitidy Aspergillus, aspergilomu, chronické plicní aspergilózy, kožní aspergilózy a invazivní aspergilózy (IA). Většina z těchto infekcí je způsobena Aspergillus fumigatus, následovaný Aspergillus flavus, Aspergillus niger a Aspergillus terreus.Zejména 4-6 IA je jednou z nejzávažnějších infekcí aspergilózy a má vysokou úmrtnost.5
Etiologie a Epidemiologie
Společné rizikové faktory pro IA patří hematopoetických kmenových buněk transplantace (HSCT), dlouhodobé a těžké neutropenie, hematologické malignity, dlouhodobá léčba kortikosteroidy, HIV. U některých imunokompetentních populací na JIP, jako jsou pacienti s chronickou obstrukční plicní chorobou, závažným onemocněním jater nebo kritickými onemocněními, která dočasně narušují imunitní systém, je však také zvýšené riziko IA.5 incidence IA v typické JIP je údajně 0.33% na 6,9%, což je srovnatelné s incidencí v pevné pacientů po transplantaci orgánů.4,5
aspergilóza není hlášená infekce ve Spojených státech, protože je neobvyklá a není považována za vážnou hrozbu pro veřejné zdraví.6 v důsledku toho nebyl přesný výskyt IA zdokumentován. Navíc hlášená míra výskytu se může podstatně lišit, což naznačuje, že geografie může hrát roli.4 u příjemců transplantátu se incidence IA liší, přičemž běžné základní stavy zahrnují lymfom a leukémii.7 Mezi solid-příjemců transplantovaných orgánů, výskyt IA je vyšší v plicní a jaterní transplantaci (2.4%-6% a 1%-8%, příslušně), než v ledvinách – a srdce po transplantaci (0.1%-4% a 0,3%-6%, respektive).4 incidence IA u příjemců HSCT je ještě vyšší. Alogenní příjemci HSCT mají incidenci IA 2,3% až 11%, což je více než dvojnásobek pozorované incidence u autologních příjemců HSCT (0,5%-4%).4 celková úmrtnost byla vypočtena na 58%.7,8 míra úmrtnosti případů IA se však liší v závislosti na základním stavu. V systematickém přehledu studií 53 od roku 1995 až do roku 1999, case-fatality rate v IA pacientů, byla nejvyšší u pacientů s anamnézou transplantace kostní dřeně (86.7%) nebo HIV/AIDS (85.7%) a nejnižší u pacientů s leukémií nebo lymfomem (49.3%).7
Patogenezi
Po vdechnutí fumigatus konidie (spór), respirační epitelové buňky a alveolární makrofágy vyvolat vrozené imunitní odpovědi proti vdechnutí Aspergillus konidie. Tyto patogeny pak rozpoznávají receptory na hostitelských buňkách, jako je beta-glukanový receptor Dectin-1. Interakce mezi patogeny a receptory vyvolává chemokiny a cytokiny a aktivuje a rekrutuje monocyty a neutrofily. Neutrofily se připojují k houbovým hyfám a degranulátům, což vede k hubení hub. Tento útok je zprostředkován nikotinamidadenindinukleotid fosfát oxidáza. V případě neutropenie nejsou neutrofily k dispozici pro hyfální zabíjení a kontrolu růstu hub, takže rostoucí hyfy se pak mohou šířit po celé výstelce endotelových buněk.8
klinické projevy
plíce jsou nejčastějším místem IA. V důsledku toho jsou příznaky IA a klinické projevy obvykle plicní. V jedné studii Lee a jeho kolegové pozorovali příznaky IA u 36 pacientů a zjistili, že hemoptýza byla nejčastějším klinickým projevem (72%), následovaným kašlem, dušností a únavou.9 vyšetřovatelé poznamenali, že příznaky IA se pohybovaly od asymptomatické po masivní hemoptýzu (někdy fatální) a rychlost nástupu symptomů se lišila na základě imunitního systému pacienta. Pacienti s určitým stupněm imunosuprese (např., AIDS, užívání kortikosteroidů, diabetes mellitus, alkoholismus) se může projevit rychlejším vývojem symptomů (tj.10 V 6-rok průzkumu, který provedla Cornilleta a kolegové, horečka byla nejčastější klinické příznaky v IA pacientů, předkládá v 85% pacientů (n = 88); bolest na hrudi, bylo časté stejně.11 Mezi další příznaky patří ztráta hmotnosti, pocení a anorexie.10
diagnóza
kultivace tkáně je v současné době zlatým standardem pro diagnostiku IA.11 tato metoda poskytuje nejen Aspergillus spp, ale dále definuje terapeutické možnosti prostřednictvím testování citlivosti. Invazivita získávání tkáně však činí kultivaci méně žádoucí. Při absenci vzorků tkáně může bronchoalveolární výplachová (BAL) tekutina získaná z horních a dolních cest dýchacích sloužit ke stanovení diagnózy IA.12 i když je BAL bezpečný postup, celková citlivost kultury pomocí vzorků BAL je relativně nízká (odhaduje se na 50%).13 odběr krve je optimální neinvazivní diagnostický přístup pro IA.12 navzdory této neinvazivitě jsou však Aspergillus spp zřídka izolovány z krve pomocí konvenčních kultivačních technik-tedy spoléhání se na vzorky tkáně k zajištění definitivní diagnózy IA.12 vzhledem k tomu, že výsledky z kultur jsou celkově relativně pomalé, IA je dobře zavedeno v době, kdy je kultura pozitivní. Tyto výzvy vedly k vývoji diagnostických metod, které jsou méně invazivní a rychlejší.
galaktomannanu v séru test je rychlý test, který je schválen diagnostikovat případy podezření na IA u pacientů s hematologických malignit nebo HSCTs.13 Galaktomannan, polysacharid uvolňovaný v tělních tekutinách během růstu Aspergillus, může být detekován ve vzorcích séra a BAL několik dní předtím, než se objeví klinické příznaky a příznaky.13 detekce séra může usnadnit stanovení specifické diagnózy, zatímco Bal tekutina se zdá mít vyšší citlivost, ale je často těžší získat.12,13 Meersseman a kolegové uvádí citlivost detekce galaktomannanu být 88% BAL versus 42% pro sérum a specifičnost galaktomannanu pro obě BAL a sérum bylo 86%.14 pozitivní výsledek v séru může umožnit zahájení antimykotik, zatímco negativní výsledek může potenciálně zabránit použití drahých a toxických antimykotik.12 měření (1,3)-beta-D-glukanu v krvi může být také užitečné jako screeningový nástroj pro IA. Ačkoli je galaktomannanový test specifický pro IA, test (1,3)-beta-D-glukanu může také detekovat další invazivní plísňová onemocnění, včetně kandidózy, jiných patogenů plísní a Pneumocystis jiroveci.15
léčba
antifungální léčba zůstává základem léčby IA.2 aby se předešlo komplikacím a špatným výsledkům, měla by být okamžitě zahájena antimykotická léčba u pacientů s vysokým rizikem IA.2 Infekčních Chorob Society of America (IDSA) doporučuje použití vorikonazolu pro primární léčba invazivní plicní aspergilózy, stejně jako u jiných projevů, jako je aspergilóza infekce dutiny, centrální nervový systém aspergilózy, a chronickou nekrotizující plicní aspergilózou.2 pokud primární léčba selže, lze jako záchrannou terapii použít lipidové formulace amfotericinu B (AMB), kaspofunginu a itrakonazolu.2 IDSA pokyny také doporučujeme použít pro profylaxi posakonazolem u pacientů s neutropenií myelodysplazie a leukémií, stejně jako u alogenních HSCT příjemců s graft-versus-host disease (GvHD).2
Empirická Léčba
Vorikonazolu: randomizované, nonblinded studii porovnávající vorikonazol s AMB zjistil, že 52.8% vorikonazolu u pacientů došlo úspěšné výsledky (úplné nebo částečné vymizení lézí na radiologii).16 skupina s vorikonazolem měla také vyšší míru přežití než pacienti s AMB (70,8% vs. 57.9%) a méně nežádoucích příhod (343 příhod oproti 421 příhodám; P = .02), vedoucí vyšetřovatelé k závěru, že vorikonazol je lepší než AMB.16 v této studii bylo podporováno dávkování vorikonazolu doporučené pokyny IDSA (tabulka 1).2 vorikonazol má profil nepříznivých účinků, který zahrnuje citlivost kůže při vystavení přímému slunečnímu záření, poruchám zraku a hepatotoxicitě charakterizované zvýšením sérového bilirubinu a jaterních enzymů.2
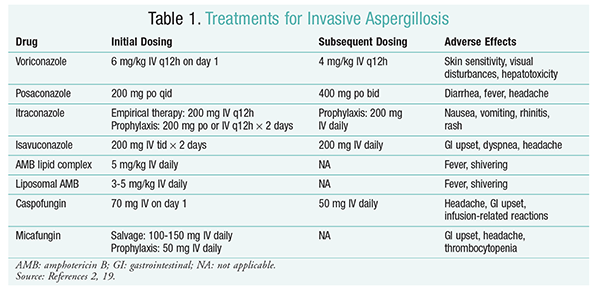
AMB: dříve byl amb deoxycholát standardem péče o aspergilózu. Nicméně, reakce související s infuzí (horečka, ztuhlost, artralgie, zvracení, bronchospasmus) a nefrotoxicita což vede k potenciální selhání ledvin způsobil AMB, aby vypadnout z laskavosti.2 Kromě toho může dojít k azotémii, pokud je amb deoxycholát podáván současně s nefrotoxickými látkami (např. cyklosporinem nebo takrolimem).2 v důsledku toho IDSA doporučuje jako alternativu lipidové komplexní formulace, protože výskyt nežádoucích účinků je nižší než u formulace deoxycholátu. Navíc, ve studii podle Walsh a kolegy, že ve srovnání AMB lipidový komplex s kaspofungin, úspěšnosti byly podobné (33.7% pro AMB, 33,9% kaspofungin), a proto pokyny pro léčbu seznam AMB lipidový komplex a kaspofungin jako alternativy k vorikonazolu.17
Echinokandiny (Kaspofungin, Mikafungin, Anidulafungin): i když kaspofungin byl schválen pro IA terapie, mikafungin a anidulafungin není prokázáno, účinný v primární léčbě IA a proto se nedoporučuje IDSA.18 kaspofungin může v důsledku uvolňování histaminu způsobit bolest hlavy, gastrointestinální potíže a možné reakce související s infuzí.2
Isavukonazol: v březnu 2015 FDA schválila novou triazol druhé generace pro IA. Na trh pod obchodním názvem Cresemba je isavukonazol dostupný v perorálních I IV roztocích a je indikován k léčbě IA a mukormykózy.19 V porovnání isavuconazole a vorikonazol, BEZPEČNÉ studii zjištěno, že román agent provádí obdobně s ohledem na mortalitu ze všech příčin a celkové odpovědi na konci léčby. Primární cílový parametr mortality ze všech příčin do 42. dne byl 19% pro isavukonazol a 20% pro vorikonazol.20 isavukonazol byl však považován za neinferiorní, protože vyšetřovatelé použili 10% rozpětí noninferiority (CI -7, 8 až 5, 7). Isavukonazol měl méně nežádoucích účinků než vorikonazol, zejména příhody týkající se očí, kůže a hepatobiliárního systému.19 konečně, isavukonazol má vysokou perorální biologickou dostupnost, čímž se získá poměr 1:1 v přepočtu mezi IV a perorálními formulacemi.
záchranná terapie
pokyny IDSA nedoporučují kombinovanou terapii pro počáteční léčbu IA. Místo toho se doporučuje záchranná terapie, pouze pokud neexistuje klinická odpověď na počáteční terapii. V důsledku toho to může zahrnovat přidání druhého činidla nebo přechod na jiný lék. Posakonazol, itrakonazol, AMB a kaspofungin byly studovány pro použití jako záchranná terapie a jsou doporučovány pokyny IDSA. Walsh a jeho kolegové zkoumali účinnost a bezpečnost posakonazolu v dávce 800 mg suspenze denně u pacientů, kteří netolerují nebo nereagují na počáteční antimykotikum.21 Celková úspěšnost byla 42% u posakonazolové skupiny a 26% u kontrolní skupiny (P = .006).21 studie Ng a Denning prokázala 40% odpovědí, kdy lipidů, založené formulace AMB byla použita jako záchranná terapie v IA pacientů, kteří byli refrakterní na léčbu nebo s intolerancí na stávající terapii.22 Kaspofunginu byla zkoumána také jako záchranná terapie v noncomparative multicentrická studie pacientů, kteří byli refrakterní na konvenční léčbu; příznivé reakci došlo u 44,6% pacientů.23
profylaxe
posakonazol: pokyny IDSA doporučují použití posakonazolu k profylaxi IA. Toto doporučení je založeno na dvou randomizovaných, kontrolovaných, multicentrických studiích, které hodnotily profylaktické použití posakonazolu u pacientů s neutropenií a GvHD.24,25 první studie srovnávala posakonazol (3 × 200 mg / den) s flukonazolem (1 × 400 mg) nebo itrakonazolem (2 × 200 mg). IA byla hlášena u 1% pacientů ve skupině s posakonazolem oproti 7% pacientů ve skupině s flukonazolem a itrakonazolem (P <.001).26 druhá studie srovnávala posakonazol s flukonazolem pro profylaxi u pacientů s GvHD. IA byla méně častá ve skupině s posakonazolem než ve skupině s flukonazolem (1, 0% vs. 5, 9%; P = .001).25
Mikafungin: Ačkoli nejsou schváleny pro profylaxi IA v první linii, pokyny IDSA doporučují mikafungin jako alternativu k posakonazolu. Toto doporučení je založeno na randomizované, dvojitě zaslepené, klinické studii fáze III, o 882 pacientů, kteří dostávali 50 mg mikafunginu IV (1 mg/kg u pacientů <50 kg) versus flukonazolu 400 mg (8 mg/kg u pacientů <50 kg). Účinnost byla definována jako absence prokázané, pravděpodobné nebo podezřelé systémové plísňové infekce. Během neutropenické fáze byla celková účinnost mikafunginu lepší než účinnost flukonazolu (80% ve skupině s mikafunginem oproti 73.5% pro flukonazolovou skupinu; 95% CI, 0, 9% -12%; P = .03).27
závěr
IA je závažná plísňová infekce, která se vyskytuje nejčastěji u imunokompromitovaných pacientů. Při diagnostice, léčbě a prevenci aspergilózy je třeba řešit několik otázek. Diagnostická kritéria jsou špatně definována, což činí diagnózu IA náročnou. Vzhledem k vysokému riziku úmrtí musí být antimykotická léčba zahájena rychle a správně, aby byla účinná. Kritické mezery existují, pokud jde o použití kombinované terapie, nástroje pro včasnou detekci a populace pacientů, u nichž by profylaxe byla nejvýhodnější.2 Proto je důležité pro lékárníky, aby se dobře informovaný o každém antifungální vlastnosti, aby byl nejlépe vybaven, aby se zvuk terapeutických rozhodnutí v léčbě IA. Vskutku, s ohledem na zvýšené riziko antimykotické rezistence, lékárníci mohou hrát důležitou roli v řízení IA tím, že pomáhá v minimalizaci a řízení nežádoucích účinků, vhodné dávkování, a sledování, výběr vhodného antimykotika—z nichž všechny jsou důležité pro optimalizaci terapie pro IA.
1. Denningu DW. Invazivní aspergilóza. Klinická Infekce Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Léčba aspergilózy: pokyny klinické praxe americké společnosti pro infekční nemoci. Klinická Infekce Dis. 2008;46:327-360.
3. Kouša M, Tadi R, Soubani AO. Plicní aspergilóza: klinický přehled. Eur Respir Rev. 2011; 20: 156-174.
4. Barnes PD, Marr KA. Aspergilóza: spektrum onemocnění, diagnostika a léčba. Infikovat Dis Clin North Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis a. invazivní aspergilóza na jednotce intenzivní péče. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. Statistický přístup v lidském mozku connectome Parkinsonovy choroby u starších lidí pomocí statistiky založené na síti. Conf proc IEEE eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Případ aspergilózy – úmrtnost: systematický přehled literatury. Klinická Infekce Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogeneze Aspergillus fumigatus u invazivní aspergilózy. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Klinické projevy a výsledky léčby plicního aspergilomu. Korean J Stážista Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Klinické spektrum plicní aspergilózy. Hrudník. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Srovnání epidemiologických, klinických a biologických rysů invazivní aspergilózy u neutropenických a nonneutropenických pacientů: 6letý průzkum. Klinická Infekce Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Aspergillus galaktomannan enzymatický imunotest a kvantitativní PCR pro diagnostiku invazivní aspergilózy bronchoalveolární výplachovou tekutinou. J. 2004;42:5517-5522.
13. Pšenice LJ, Walsh TJ. Diagnostika invazivní aspergilózy detekcí galaktomannanové antigenémie pomocí enzymové imunoanalýzy. Eur J Clin Mikrobiol Infikovat Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Invazivní aspergilóza u kriticky nemocných pacientů bez malignity. Am J Respir Crit Péče Med. 2004;170:621-625.
15. Šerif R, Segal BH. Plicní aspergilóza: klinický projev, diagnostické testy, léčba a komplikace. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Vorikonazol versus amfotericin B pro primární terapii invazivní aspergilózy. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, DONOWITZ GR, et al. Kaspofungin versus lipozomální amfotericin B pro empirickou antimykotickou léčbu u pacientů s přetrvávající horečkou a neutropenií. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungin (FK463), samotný nebo v kombinaci s jinými systémovými antimykotiky, pro léčbu akutní invazivní aspergilózy. J. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavukonazol: nová možnost léčby invazivních plísňových infekcí. Annina. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazole versus vorikonazolu pro primární léčba invazivní formy nemoci způsobené Aspergillus a jiné vláknité houby (SECURE): fáze 3, randomizované, kontrolované, non-inferiority trial. Lanceta. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et al. Léčba invazivní aspergilózy posakonazolem u pacientů, kteří jsou refrakterní nebo netolerují konvenční terapii: externě kontrolovaná studie. Klinická Infekce Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Lipozomální amfotericin B (AmBisome) terapie u invazivních plísňových infekcí. Hodnocení údajů o použití ze soucitu ve Spojeném království. Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Účinnost a bezpečnost kaspofunginu při léčbě invazivní aspergilózy u pacientů refrakterních nebo netolerujících konvenční antimykotickou léčbu. Klinická Infekce Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Profylaxe posakonazolem vs. flukonazolem nebo itrakonazolem u pacientů s neutropenií. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.