us Pharm. 2016; 41 (4): HS15-HS20.ABSTRACT: invasieve aspergillose (IA) is een zeldzame, ernstige schimmelinfectie die vaak immunogecompromitteerde patiënten treft. De precieze incidentie van IA is niet gedocumenteerd en de gerapporteerde incidentie varieert sterk. Enkele typische risicofactoren voor IA zijn hematopoëtische stamceltransplantaties, langdurige corticosteroïdentherapie, hematologische maligniteiten en HIV. De longen zijn de meest voorkomende plaats van IA; bijgevolg zijn de symptomen en klinische manifestaties typisch pulmonaal. Vanwege het hoge risico op overlijden moet de EB-behandeling met de juiste agenten zo snel mogelijk beginnen. Voriconazol is de eerstelijns empirische therapie die wordt aanbevolen door de richtlijnen van de Infectious Diseases Society of America; als er geen klinische respons is, dient salvagetherapie met andere azolen, echinocandinen of lipideformuleringen van amfotericine B te worden toegediend.
aspergillose is een schimmelinfectie veroorzaakt door Aspergillus, die een grote groep alomtegenwoordige schimmelsoorten (spp) omvat die het vaakst voorkomen in ontbindende vegetatie.1 Aspergillosis, die het meest meestal in immunocompromised personen wordt waargenomen, is een significante oorzaak van morbiditeit en mortaliteit in deze bevolking, met sterftecijfers zo hoog als 90%.2,3 verscheidene types van aspergillosebesmettingen bestaan, met inbegrip van allergische bronchopulmonaire aspergillosis, allergische Aspergillus sinusitis, aspergilloma, chronische pulmonale aspergillosis, cutane aspergillosis, en invasieve aspergillosis (IA). De meeste van deze besmettingen worden veroorzaakt door Aspergillus fumigatus, gevolgd door Aspergillus flavus, Aspergillus niger, en Aspergillus terreus.4-6 IA, in het bijzonder, is een van de ernstigste aspergilloseinfecties, en het heeft een hoog sterftecijfer.
etiologie en Epidemiologie
vaak voorkomende risicofactoren voor IA zijn hematopoëtische stamceltransplantatie (HSCT), langdurige en ernstige neutropenie, hematologische maligniteiten, langdurige corticosteroïdtherapie en HIV. Echter, bepaalde ICU-immunocompetente populaties, zoals patiënten met chronische obstructieve longziekte, ernstige leverziekte, of kritieke ziekten die het immuunsysteem tijdelijk verstoren, hebben ook een verhoogd risico op IA.De incidentie van IA op een typische intensive care bedraagt 0,33% tot 6,9%, wat vergelijkbaar is met de incidentie bij patiënten met een vaste orgaantransplantatie.4,5
aspergillose is geen meldbare infectie in de Verenigde Staten omdat het zelden voorkomt en niet wordt beschouwd als een ernstige bedreiging voor de volksgezondheid.6 als gevolg hiervan is de exacte incidentie van IA niet gedocumenteerd. Bovendien kunnen de gerapporteerde incidentiepercentages aanzienlijk variëren, wat erop wijst dat geografie een rol kan spelen.4 onder transplantaatontvangers varieert de incidentie van IA, met gemeenschappelijke onderliggende aandoeningen waaronder lymfoom en leukemie.Bij ontvangers van een vast orgaantransplantatie is de incidentie van IA hoger bij Long-en levertransplantatiepatiënten (respectievelijk 2,4% -6% en 1% -8%) dan bij nier – en harttransplantatiepatiënten (respectievelijk 0,1% -4% en 0,3% -6%).4 de incidentie van IA bij HSCT-ontvangers is nog hoger. Allogene HSCT-ontvangers hebben een IA-incidentie van 2,3% tot 11%, wat meer dan tweemaal het waargenomen incidentiepercentage is bij autologe HSCT-ontvangers (0,5% -4%).4 het totale aantal gevallen van overlijden is berekend op 58%.7,8 echter, gevallen-sterftecijfers van IA variëren afhankelijk van de onderliggende aandoening. In een systematische beoordeling van 53 studies van 1995 tot 1999 was het aantal gevallen van overlijden bij IA-patiënten het hoogst bij patiënten met een voorgeschiedenis van beenmergtransplantaties (86,7%) of HIV/AIDS (85,7%) en het laagst bij patiënten met leukemie of lymfoom (49,3%).7
pathogenese
na inhalatie van een fumigatus conidia (sporen in de lucht), respiratoire epitheliale cellen en alveolaire macrofagen veroorzaken aangeboren immuunresponsen tegen geïnhaleerde Aspergillus conidia. Deze ziekteverwekkers herkennen dan receptoren op gastheercellen, zoals de bèta-glucaanreceptor Dectin-1. De interactie tussen ziekteverwekkers en receptoren veroorzaakt chemokines en cytokines en activeert en rekruteert monocyten en neutrofielen. Neutrofielen hechten aan schimmel Hyphen en degranulate, resulterend in schimmel doden. Deze aanval wordt gemedieerd door nicotinamide adenine dinucleotide fosfaatoxidase. In het geval van neutropenie zijn neutrofielen niet beschikbaar voor het doden van de schimmel en de controle van de schimmelgroei, zodat groeiende schimmels zich vervolgens kunnen verspreiden over de endotheliale celwand.8
klinische manifestaties
de longen zijn de meest voorkomende plaats van IA. Dientengevolge zijn IA-symptomen en klinische manifestaties typisch pulmonaal. In één studie merkten Lee en collega ‘ s IA-symptomen op bij 36 patiënten en vonden dat hemoptysis de meest voorkomende klinische manifestatie was (72%), gevolgd door hoesten, kortademigheid en vermoeidheid.De onderzoekers merkten op dat IA-symptomen varieerden van asymptomatische tot massale hemoptoë (soms fataal), en de snelheid waarmee symptomen optreden varieerde op basis van het immuunsysteem van de patiënt. Patiënten met een zekere mate van immunosuppressie (bijv., AIDS, gebruik van corticosteroïden, diabetes mellitus, alcoholisme) kan presenteren met een snellere ontwikkeling van symptomen (d.w.z., weken in plaats van maanden).In een 6 jaar durend onderzoek, uitgevoerd door Cornillet en collega ‘ s, was koorts het meest voorkomende klinische teken bij IA-patiënten, dat zich voordeed bij 85% van de patiënten (n = 88); pijn op de borst kwam ook vaak voor.11 extra symptomen zijn gewichtsverlies, zweten, en anorexia.10
diagnose
het kweken van weefsel is momenteel de gouden standaard voor de diagnose van IA.Deze methode levert niet alleen Aspergillus spp op, maar definieert ook de therapeutische opties via gevoeligheidstesten. Nochtans, maakt de invasiviteit van het verkrijgen van weefsel het kweken minder wenselijk. Bij afwezigheid van weefselmonsters kan bronchoalveolaire lavage (BAL) vloeistof verkregen uit de bovenste en onderste luchtwegen dienen om de diagnose van IA vast te stellen.12 hoewel BAL een veilige procedure is, is de algehele gevoeligheid van cultuur met behulp van bal specimens relatief laag (geschat op 50%).Bloedbemonstering is de optimale niet-invasieve diagnostische benadering voor IA.Ondanks deze niet—invasiviteit worden Aspergillus spp echter zelden geïsoleerd uit bloed door middel van conventionele kweektechnieken-vandaar de afhankelijkheid van weefselmonsters om een definitieve diagnose van IA te verkrijgen.12 aangezien de resultaten van culturen over het geheel genomen relatief traag worden verkregen, is IA al goed ingeburgerd tegen de tijd dat de cultuur positief is. Deze uitdagingen hebben geresulteerd in de ontwikkeling van diagnostische methoden die minder invasief en sneller zijn.
de serum galactomannan-test is een snelle test die is goedgekeurd voor de diagnose van vermoedelijke gevallen van IA bij patiënten met hematologische maligniteiten of HSCT ‘ s.13 Galactomannan, een polysaccharide die in lichamelijke vloeistoffen tijdens Aspergillus de groei wordt vrijgegeven, kan in serum en bal specimens verscheidene dagen worden ontdekt alvorens klinische tekens en symptomen verschijnen.13 Serumdetectie kan de vaststelling van een specifieke diagnose vergemakkelijken, terwijl balvloeistof een hogere gevoeligheid lijkt te hebben, maar vaak moeilijker te verkrijgen is.12,13 Meersseman en collega ‘ s meldden de gevoeligheid van galactomannan detectie 88% voor BAL versus 42% voor serum, en de specificiteit van galactomannan voor zowel BAL als serum was 86%.14 een positief serumresultaat kan het initiëren van antischimmelmiddelen mogelijk maken, terwijl een negatief resultaat het gebruik van dure en toxische antischimmelmiddelen mogelijk kan voorkomen.12 meting van (1,3)-bèta-D-glucaan in het bloed kan ook nuttig zijn als screeningsinstrument voor IA. Hoewel de galactomannan-analyse specifiek is voor IA, kan de (1,3)-bèta-D-glucan-analyse ook andere invasieve schimmelziekten, met inbegrip van candidiasis, andere schimmelpathogenen, en Pneumocystis jiroveci detecteren.15
behandeling
antischimmelbehandeling blijft de steunpilaar van de behandeling van IA.Om complicaties en slechte resultaten te voorkomen, dient een antischimmelbehandeling onmiddellijk te worden gestart bij patiënten met een hoog risico op IA.2 de Besmettelijke Ziekten Maatschappij van Amerika (IDSA) adviseert het gebruik van voriconazol voor de primaire behandeling van invasieve pulmonale aspergillose, evenals voor andere manifestaties, zoals aspergillosebesmettingen van de sinussen, centrale zenuwstelsel aspergillosis, en chronische necrotiserende pulmonale aspergillosis.2 als primaire behandeling faalt, kunnen lipideformuleringen van amfotericine B (AMB), caspofungine en itraconazol worden gebruikt als salvagetherapie.2 de IDSA-richtlijnen bevelen ook het gebruik van posaconazol aan als profylaxe bij neutropene patiënten met myelodysplasie en leukemie, evenals bij allogene HSCT-ontvangers met graft-versus-host ziekte (GVHD).Voriconazol: een gerandomiseerde, niet-blinde studie waarin voriconazol met AMB werd vergeleken, toonde aan dat 52,8% van de voriconazolpatiënten succesvolle resultaten hadden (volledige of gedeeltelijke verdwijning van laesies op radiologie).De voriconazolgroep had ook een hoger overlevingspercentage dan AMB-patiënten (70,8% vs. 57.9%) en minder bijwerkingen (343 voorvallen vs. 421 voorvallen; P=.02), waardoor onderzoekers concludeerden dat voriconazol superieur is aan AMB.De voriconazoldosering, aanbevolen door de IDSA richtlijnen (tabel 1), werd in dit onderzoek ondersteund.Voriconazol heeft een bijwerkingenprofiel dat huidgevoeligheid met blootstelling aan direct zonlicht, visusstoornissen en hepatotoxiciteit omvat die gekenmerkt worden door een toename in serumbilirubine en leverenzymen.2
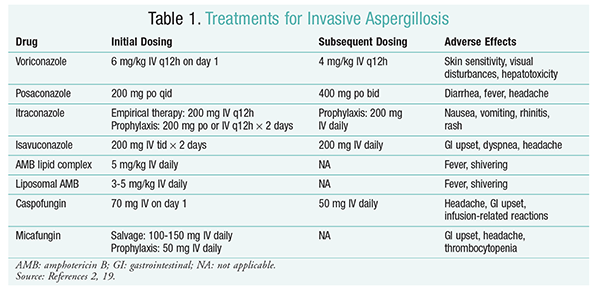
AMB: voorheen was AMB deoxycholaat de standaard van zorg voor aspergillose. Infusiegerelateerde reacties (waaronder koorts, Rigor, artralgia ‘ s, braken en bronchospasmen) en nefrotoxiciteit, resulterend in potentieel nierfalen, hebben er echter voor gezorgd dat AMB uit de gratie viel.2 bovendien kan azotemie optreden wanneer AMB deoxycholaat gelijktijdig wordt toegediend met nefrotoxische middelen (bijv. ciclosporine of tacrolimus).2 als gevolg hiervan adviseert de IDSA lipidencomplex formuleringen als alternatief, aangezien de incidentie van bijwerkingen lager is dan die voor de deoxycholaat formulering. Bovendien waren in een onderzoek van Walsh en collega ‘ s waarin AMB-lipidencomplex werd vergeleken met caspofungine de succespercentages vergelijkbaar (33,7% voor AMB, 33,9% voor caspofungine); daarom worden in de behandelingsrichtlijnen zowel AMB-lipidencomplex als caspofungine als alternatieven voor voriconazol vermeld.17
Echinocandinen (caspofungine, micafungine, anidulafungine): hoewel caspofungine is goedgekeurd voor IA-therapie, zijn micafungine en anidulafungine niet werkzaam gebleken bij de primaire behandeling van IA en worden daarom niet aanbevolen door de IDSA.Caspofungine kan hoofdpijn, gastro-intestinale klachten en mogelijke infusiegerelateerde reacties veroorzaken als gevolg van de afgifte van histamine.2
Isavuconazool: in maart 2015 keurde de FDA een nieuwe triazool van de tweede generatie voor IA goed. Op de markt gebracht onder de handelsnaam Cresemba, isavuconazole is beschikbaar in zowel mondelinge als IV oplossingen en is geïndiceerd voor de behandeling van IA en mucormycose.In een vergelijking van isavuconazol en voriconazol werd in het SECURE-onderzoek vastgesteld dat het nieuwe middel op dezelfde wijze presteerde met betrekking tot mortaliteit ongeacht de oorzaak en de totale respons aan het einde van de behandeling. Het primaire eindpunt van mortaliteit door alle oorzaken op dag 42 was 19% voor isavuconazol en 20% voor voriconazol.Isavuconazol werd echter niet inferior geacht omdat de onderzoekers een non-inferioriteitsmarge van 10% gebruikten (CI-7,8 tot 5,7). Isavuconazol had minder bijwerkingen dan voriconazol, met name bijwerkingen in de ogen, de huid en het hepatobiliaire systeem.Tot slot heeft isavuconazol een hoge orale biologische beschikbaarheid, wat resulteert in een 1: 1 verhouding in een conversie tussen IV en orale formuleringen.
Salvagetherapie
de IDSA-richtlijnen bevelen geen combinatietherapie aan voor de initiële behandeling van IA. In plaats daarvan wordt salvagetherapie alleen aanbevolen als er geen klinische respons op de initiële therapie is. Daarom kan dit inhouden dat een tweede middel wordt toegevoegd of dat wordt overgeschakeld op een ander medicijn. Posaconazol, itraconazol, AMB en caspofungine zijn onderzocht voor gebruik als salvagetherapie en worden aanbevolen volgens de IDSA-richtlijnen. Walsh en collega ‘ s onderzochten de werkzaamheid en veiligheid van posaconazol 800 mg suspensie per dag bij patiënten die intolerant waren of niet reageerden op het oorspronkelijke antischimmelmiddel.Het totale succespercentage was 42% voor de posaconazolgroep en 26% voor de controlegroep (P = .006).Een studie met Ng en Denning toonde een responspercentage van 40% aan wanneer een op lipiden gebaseerde formulering van AMB werd gebruikt als salvagetherapie bij IA-patiënten die refractair of intolerant waren voor bestaande therapie.Caspofungine werd ook onderzocht als salvagetherapie in een niet-comparatieve multicenterstudie bij patiënten die refractair waren voor conventionele therapie; een gunstige respons trad op bij 44,6% van de patiënten.23
profylaxe
posaconazol: de IDSA-richtlijnen bevelen het gebruik van posaconazol aan voor de profylaxe van IA. Deze aanbeveling is gebaseerd op twee gerandomiseerde, gecontroleerde, multicenter studies waarin het profylactisch gebruik van posaconazol werd geëvalueerd bij patiënten met neutropenie en GvHD.In het eerste onderzoek werd posaconazol (3 × 200 mg/dag) vergeleken met fluconazol (1 × 400 mg) of itraconazol (2 × 200 mg). IA werd gemeld bij 1% van de patiënten in de posaconazolgroep versus 7% van de patiënten in de fluconazol-en itraconazolgroepen (p <.001).In het tweede onderzoek werd posaconazol vergeleken met fluconazol voor profylaxe bij patiënten met GvHD. IA kwam minder vaak voor in de posaconazolgroep dan in de fluconazolgroep (1,0% VS. 5,9%; P=.001).25
micafungine: Hoewel niet goedgekeurd voor eerstelijns profylaxe van IA, bevelen de IDSA-richtlijnen micafungine aan als alternatief voor posaconazol. Deze aanbeveling is gebaseerd op een gerandomiseerd, dubbelblind fase III-onderzoek met 882 patiënten die micafungine 50 mg IV (1 mg/kg bij patiënten <50 kg) kregen versus fluconazol 400 mg (8 mg/kg bij patiënten <50 kg). Werkzaamheid werd gedefinieerd als de afwezigheid van bewezen, waarschijnlijke of vermoede systemische schimmelinfectie. Tijdens de neutropenische fase was de totale werkzaamheid van micafungine superieur aan die van fluconazol (80% voor de micafungin-Groep vs.73.5% voor de fluconazolgroep; 95% BI, 0,9% -12%; P = .03).
conclusie
IA is een ernstige schimmelinfectie die het vaakst voorkomt bij immuungecompromitteerde patiënten. Verscheidene vragen moeten in de diagnose, de behandeling, en de preventie van aspergillosis worden aangepakt. Diagnostische criteria zijn slecht gedefinieerd, waardoor de diagnose van IA uitdagend is. Vanwege het hoge risico op overlijden moet antifungale therapie snel en correct worden gestart om effectief te zijn. Er bestaan kritieke hiaten met betrekking tot het gebruik van combinatietherapie, hulpmiddelen voor vroege opsporing en de patiëntenpopulaties bij wie profylaxe het meest voordelig zou zijn.2 daarom is het belangrijk dat apothekers op de hoogte zijn van de kenmerken van elk antischimmelmiddel, zodat zij het best toegerust zijn om goede therapeutische beslissingen te nemen bij de behandeling van IA. Gezien het verhoogde risico op antischimmelresistentie kunnen apothekers inderdaad een belangrijke rol spelen bij het beheer van IA door te helpen bij het minimaliseren en beheren van bijwerkingen, het doen van geschikte doseringsaanbevelingen en het monitoren van de selectie van geschikte antischimmelmiddelen—die allemaal cruciaal zijn voor het optimaliseren van de therapie voor IA.
1. Denning DW. Invasieve aspergillose. Clin Infecteert Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Infecteert Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani EA. Pulmonale aspergillose: een klinisch overzicht. EUR Respir Rev. 2011; 20: 156-174.
4. Barnes PD, Marr KA. Aspergillosis: spectrum van ziekte, diagnose, en behandeling. Infecteer Dis Clin North Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. Invasive aspergillose in the intensive care unit. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. Een statistische benadering in menselijk brein connectoom van de ziekte van Parkinson bij ouderen met behulp van netwerk gebaseerde statistieken. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergillose case-fatality rate: systematic review of the literature. Clin Infecteert Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Pathogenese van Aspergillus fumigatus in invasieve aspergillose. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Klinische manifestaties en behandelingsresultaten van pulmonair aspergilloma. Korean J Intern Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Het klinische spectrum van pulmonale aspergillose. Thorax. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Vergelijking van epidemiologische, klinische en biologische kenmerken van invasieve aspergillose bij neutropene en nonneutropene patiënten: een 6-jarige enquête. Clin Infecteert Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Aspergillus galactomannan enzym immunoassay en kwantitatieve PCR voor diagnose van invasieve aspergillose met bronchoalveolaire lavage vloeistof. J Clin Microbiol. 2004;42:5517-5522.
13. Tarwe LJ, Walsh TJ. Diagnose van invasieve aspergillose door galactomannan-antigenemiaopsporing die een enzymimmunoassay gebruiken. Eur J Clin Microbiol Infected Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Invasieve aspergillose bij ernstig zieke patiënten zonder maligniteit. Am J Respir Crit Care Med. 2004;170:621-625.
15. Sherif R, Segal BH. Pulmonale aspergillose: klinische presentatie, diagnostische tests, beheer en complicaties. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazol versus amfotericine B voor primaire behandeling van invasieve aspergillose. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungine versus liposomaal amfotericine B voor empirische antischimmeltherapie bij patiënten met aanhoudende koorts en neutropenie. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungine (FK463), alleen of in combinatie met andere systemische antischimmelmiddelen, voor de behandeling van acute invasieve aspergillose. J Infecteren. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavuconazool: een nieuwe optie voor het beheer van invasieve schimmelinfecties. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazol versus voriconazol voor primaire behandeling van invasieve schimmelziekte veroorzaakt door Aspergillus en andere filamenteuze schimmels (SECURE): een fase 3, gerandomiseerd-gecontroleerd, non-inferioriteitsonderzoek. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et al. Behandeling van invasieve aspergillose met posaconazol bij patiënten die ongevoelig zijn voor of intolerant zijn voor conventionele therapie: een extern gecontroleerde studie. Clin Infecteert Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Liposomale amfotericine B (Ambisoom) therapie bij invasieve schimmelinfecties. Evaluatie van gegevens over compassionate use in het Verenigd Koninkrijk. Arch Stagiair Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Werkzaamheid en veiligheid van caspofungine voor de behandeling van invasieve aspergillose bij patiënten die refractair zijn voor of intolerant zijn voor conventionele antischimmeltherapie. Clin Infecteert Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Posaconazol vs. fluconazol of itraconazol profylaxe bij patiënten met neutropenie. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.