US Pharm. 2016; 41(4):HS15-HS20.
Abstrakti: invasiivinen aspergilloosi (IA) on harvinainen, vakava sieni-infektio, jolla on yleinen vaikutus immuunivajauspotilaisiin. IA: n tarkkaa esiintyvyyttä ei ole dokumentoitu, ja raportoidut esiintymistiheydet vaihtelevat suuresti. Joitakin tyypillisiä riskitekijöitä IA ovat hematopoieettiset kantasolusiirrot, pitkäaikainen kortikosteroidihoito, hematologiset maligniteetit, ja HIV. Keuhkot ovat yleisin paikka IA; siksi, oireet ja kliiniset oireet ovat tyypillisesti keuhkojen. Koska kuolonuhrien riski on suuri, vaikutustenarvioinnin hallinta asianmukaisten tekijöiden kanssa on aloitettava mahdollisimman nopeasti. Vorikonatsoli on Infectious Diseases Society of America guidelinesin suosittelema ensilinjan empiirinen hoito; jos kliinistä vastetta ei ole, on annettava pelastushoitoa muilla atsoleilla, ekinokandiineilla tai amfoterisiini B-lipidiformulaatioilla.
aspergilloosi on aspergilluksen aiheuttama sieni-infektio, joka käsittää suuren ryhmän kaikkialla esiintyviä homelajeja (spp), joita esiintyy useimmin hajoavassa kasvillisuudessa.1 aspergilloosi, jota esiintyy yleisimmin immuunipuutteisilla henkilöillä, on merkittävä sairastuvuuden ja kuolleisuuden aiheuttaja tässä väestössä, ja kuolleisuus on jopa 90%.2,3 useita erilaisia aspergilloosi-infektioita esiintyy, mukaan lukien allerginen bronkopulmonaalinen aspergilloosi, allerginen Aspergillus-sinuiitti, aspergillooma, krooninen keuhkoaspergilloosi, ihon aspergilloosi ja invasiivinen aspergilloosi (IA). Suurin osa näistä infektioista johtuu Aspergillus fumigatuksesta, jota seuraavat Aspergillus flavus, Aspergillus niger ja Aspergillus terreus.Erityisesti 4-6 IA on yksi vaikeimmista aspergilloosi-infektioista, ja siihen liittyy korkea kuolleisuus.5
etiologia ja epidemiologia
IA: n yleisiä riskitekijöitä ovat hematopoieettiset kantasolusiirrot (HSCT), pitkittynyt ja vaikea neutropenia, hematologiset maligniteetit, pitkäaikainen kortikosteroidihoito ja HIV. Kuitenkin tietyt teho-immunokompetentit populaatiot, kuten potilaat, joilla on krooninen obstruktiivinen keuhkosairaus, vaikea maksasairaus tai kriittisiä sairauksia, jotka tilapäisesti häiritsevät immuunijärjestelmää, ovat myös lisääntynyt riski IA.5 IA: n insidenssiksi tyypillisessä teho-osastolla on ilmoitettu 0, 33-6, 9%, mikä on verrattavissa solid-elinsiirtopotilaiden INSIDENSSIIN.4, 5
aspergilloosi ei ole raportoitava infektio Yhdysvalloissa, koska se on harvinainen eikä sitä pidetä vakavana uhkana kansanterveydelle.6 Tämän vuoksi IA: n tarkkaa esiintyvyyttä ei ole dokumentoitu. Lisäksi raportoidut esiintymistiheydet voivat vaihdella huomattavasti, mikä viittaa siihen, että maantieteellä voi olla merkitystä.4 elinsiirtopotilaiden keskuudessa IA: n esiintyvyys vaihtelee, ja niillä on yhteisiä perussairauksia, kuten lymfooma ja leukemia.7 kiinteää elinsiirtoa saavilla potilailla IA: n esiintyvyys on suurempi keuhko – ja maksansiirtopotilailla (2, 4%-6% ja 1% – 8%, tässä järjestyksessä) kuin munuaisensiirtopotilailla (0, 1%-4% ja 0, 3% – 6%, tässä järjestyksessä).4 vaikutustenarvioinnin esiintyvyys HSCT-vastaanottajilla on vielä suurempi. Allogeenisten HSCT-vastaanottajien invaliditeetti on 2, 3-11%, Mikä on yli kaksinkertainen autologisilla HSCT-vastaanottajilla todettuun insidenssiin verrattuna (0, 5-4%).4 tapauskuolemien kokonaismääräksi on laskettu 58 prosenttia.7,8 kuitenkin, case-fatality rates of IA vaihtelevat riippuen perussairaudesta. Vuosina 1995-1999 tehdyssä systemaattisessa katsauksessa 53 tutkimusta KÄSITTÄNEIDEN tapausten kuolleisuus oli suurin potilailla, joilla oli aikaisemmin tehty luuydinsiirto (86, 7%) tai HIV/AIDS (85, 7%), ja pienin potilailla, joilla oli leukemia tai lymfooma (49, 3%).7
patogeneesi
fumigatus conidian (ilmassa leviävät itiöt) hengittämisen jälkeen hengitysteiden epiteelisolut ja alveolaariset makrofagit laukaisevat synnynnäisen immuunivasteen hengitettävää Aspergillus conidiaa vastaan. Nämä taudinaiheuttajat tunnistavat sitten isäntäsolujen reseptoreita, kuten beetaglukaanireseptori Dectin-1: n. Patogeenien ja reseptorien välinen vuorovaikutus provosoi kemokiineja ja sytokiineja sekä aktivoi ja värvää monosyyttejä ja neutrofiileja. Neutrofiilit kiinnittyvät sienihyphaeen ja degranuloituvat, jolloin sieni kuolee. Hyökkäyksen välittäjänä toimii nikotiiniamidiadeniinidinukleotidifosfaattioksidaasi. Neutropenian tapauksessa neutrofiileja ei ole saatavilla hyphalin tappamiseen ja sienikasvun säätelyyn, joten kasvava hyphae voi sitten levitä koko endoteelin solulinjaan.8
kliiniset oireet
keuhkot ovat yleisin IA-oire yhtymästä. Tämän seurauksena IA: n oireet ja kliiniset oireet ovat tyypillisesti keuhko-oireita. Eräässä tutkimuksessa Lee ja kollegat havaitsivat IA-oireita 36 potilaalla ja havaitsivat, että hemoptyysi oli yleisin kliininen ilmentymä (72%), jota seurasi yskä, hengenahdistus ja väsymys.9 tutkijat havaitsivat, että IA-oireet vaihtelivat oireettomasta massiiviseen (joskus kuolemaan johtavaan) hemoptyysiin ja oireiden alkamisnopeus vaihteli potilaan immuunijärjestelmän mukaan. Potilaat, joilla on jonkinasteista immunosuppressiota (esim., AIDS, kortikosteroidien käyttö, diabetes mellitus, alkoholismi) voi esiintyä nopeammin oireiden (ts.viikkojen eikä kuukausien).10 Cornillet ’ n ja kollegoiden tekemässä 6-vuotisessa tutkimuksessa kuume oli yleisin kliininen merkki IA-potilailla, joita esiintyi 85%: lla potilaista (n = 88); rintakipu oli myös yleistä.11 muita oireita ovat laihtuminen, hikoilu, ja anoreksia.10
diagnoosi
kudosviljely on tällä hetkellä kultakanta IA-diagnostiikassa.11 tällä menetelmällä saadaan Aspergillus spp: n lisäksi myös tarkempia hoitovaihtoehtoja herkkyystestauksen avulla. Kudosten hankkimisen invasiivisuus tekee viljelemisestä kuitenkin vähemmän toivottavaa. Koska kudosnäytteitä, bronchoalveolar huuhtelu (Bal) neste saatu ylä-ja alahengitysteiden voi palvella diagnoosin IA.12 vaikka BAL on turvallinen menetelmä, BAL-näytteitä käyttävän viljelmän kokonaisherkkyys on suhteellisen alhainen (arviolta 50%).13 verinäytteenotto on optimaalinen ei-invasiivinen diagnostinen lähestymistapa IA.12 Aspergillus spp: t eristetään kuitenkin harvoin verestä tavanomaisilla viljelytekniikoilla—minkä vuoksi ne ovat riippuvaisia kudosnäytteistä IA: n lopullisen diagnoosin varmistamiseksi.12 koska kulttuurien tulokset ovat yleisesti ottaen suhteellisen hitaita, vaikutustenarviointi on vakiintunut siihen mennessä, kun kulttuuri on positiivinen. Nämä haasteet ovat johtaneet diagnostisten menetelmien kehittämiseen, jotka ovat vähemmän invasiivisia ja nopeampia.
seerumin galaktomannaanimääritys on pikatesti, joka on hyväksytty epäiltyjen IA-tapausten diagnosointiin potilailla, joilla on hematologisia maligniteetteja tai HSCT-oireyhtymä.13 galaktomannaania, polysakkaridia, jota vapautuu Ruumiinnesteissä Aspergillus-kasvun aikana, voidaan havaita seerumi-ja BAL-näytteistä useita päiviä ennen kliinisten merkkien ja oireiden ilmaantumista.13 seerumin havaitseminen voi helpottaa tietyn diagnoosin tekemistä, kun taas BAL-nesteellä näyttää olevan suurempi herkkyys, mutta sitä on usein vaikeampi saada.12, 13 Meersseman ja kollegat raportoivat galaktomannaanin havaitsemisherkkyyden olevan 88% BALAL: lla ja 42% seerumilla, ja galaktomannaanin spesifisyys sekä BAL: lla että seerumilla oli 86%.14 positiivinen seerumitulos voi mahdollistaa sienilääkkeiden aloittamisen, kun taas negatiivinen tulos voi mahdollisesti estää kalliiden ja myrkyllisten sienilääkkeiden käytön.12 (1,3)-beeta-d-glukaanin mittaaminen verestä voi olla hyödyllinen myös IA: n seulontavälineenä. Vaikka galaktomannaanimääritys on spesifinen IA: lle, (1,3)-beeta-D-glukaanimäärityksellä voidaan havaita myös muita invasiivisia sienitauteja, mukaan lukien kandidiaasi, muut homepatogeenit ja Pneumocystis jiroveci.15
hoito
sienilääkkeet ovat edelleen IA: n hoidon tukipilari.2 komplikaatioiden ja huonojen hoitotulosten estämiseksi sienilääkkeet tulee aloittaa välittömästi potilailla, joilla on suuri IA-riski.2 Infectious Diseases Society of America (IDSA) suosittelee vorikonatsolin käyttöä invasiivisen keuhkoaspergilloosin ensisijaiseen hoitoon sekä muihin ilmenemismuotoihin, kuten sivuonteloiden aspergilloosi-infektioihin, keskushermoston aspergilloosiin ja krooniseen nekrotisoivaan keuhkoaspergilloosiin.2 jos ensisijainen hoito epäonnistuu, pelastushoitona voidaan käyttää amfoterisiini B: n (AMB), kaspofungiinin ja itrakonatsolin lipidiformulaatioita.2 IDSA: n ohjeissa suositellaan posakonatsolin käyttöä profylaksiaan myelodysplasiaa ja leukemiaa sairastavilla neutropeniapotilailla sekä allogeenista HSCT-hoitoa saavilla potilailla, joilla on käänteishyljintäsairaus (GVHD).2
empiirinen hoito
vorikonatsoli: satunnaistetussa, sokkouttamattomassa tutkimuksessa, jossa vorikonatsolia verrattiin AMB: hen, todettiin, että 52, 8% vorikonatsolipotilaista sai onnistuneen lopputuloksen (leesioiden täydellinen tai osittainen häviäminen radiologiassa).16 vorikonatsoliryhmässä elossaololuku oli myös suurempi kuin AMB-potilailla (70, 8% vs. 57.9%) ja vähemmän haittavaikutuksia (343 tapahtumaa vs. 421 tapahtumaa; P = .02), johtavat tutkijat päättelevät, että vorikonatsoli on parempi kuin AMB.16 IDSA: n ohjeissa (taulukko 1) suositeltua vorikonatsoliannosta tuettiin tässä tutkimuksessa.2 Vorikonatsolilla on haittavaikutusprofiili, johon kuuluvat ihon herkkyys ja altistuminen suoralle auringonvalolle, näköhäiriöt ja maksatoksisuus, joille on ominaista seerumin bilirubiinin ja maksaentsyymien nousu.2
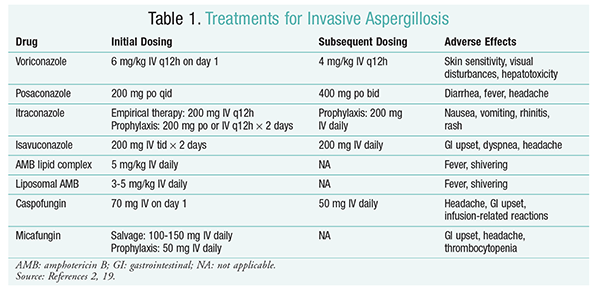
AMB: aiemmin amb-deoksikolaatti oli aspergilloosin hoidon standardi. Kuitenkin infuusioon liittyvät reaktiot (mukaan lukien kuume, jäykkyys, artralgiat, oksentelu ja bronkospasmit) ja munuaistoksisuus, joka johtaa mahdolliseen munuaisten vajaatoimintaan, ovat saaneet AMB: n jäämään pois suosiosta.2 Lisäksi atsotemiaa voi esiintyä, kun AMB-deoksikolaattia annetaan samanaikaisesti nefrotoksisten aineiden kanssa (esim.siklosporiini tai takrolimuusi).2 Tämän seurauksena IDSA suosittelee lipid complex formulaatioita vaihtoehtona, koska haittavaikutusten esiintyvyys on pienempi kuin deoksikolaatin formulaatiossa. Lisäksi Walshin ja hänen kollegoidensa tutkimuksessa, jossa AMB lipidikompleksia verrattiin kaspofungiiniin, onnistumisprosentit olivat samanlaiset (33, 7% AMB: llä ja 33, 9% kaspofungiinilla); siksi hoitosuosituksissa luetellaan sekä AMB lipid complex että kaspofungiini vorikonatsolin vaihtoehtoina.17
Ekinokandiinit (kaspofungiini, Mikafungiini, Anidulafungiini): vaikka kaspofungiini on hyväksytty IA-hoitoon, mikafungiini ja anidulafungiini eivät ole osoittautuneet tehokkaiksi IA: n primaarihoidossa, joten IDSA ei suosittele niitä.Kaspofungiini voi aiheuttaa histamiinin vapautumisen vuoksi päänsärkyä, ruoansulatuskanavan häiriöitä ja infuusioon liittyviä mahdollisia reaktioita.2
Isavukonatsoli: maaliskuussa 2015 FDA hyväksyi uuden toisen sukupolven triatsolin IA: lle. Isavukonatsolia on saatavana sekä oraaliliuoksena että laskimonsisäisenä liuoksena, ja se on tarkoitettu IA: n ja mukormykoosin hoitoon.ISAVUKONATSOLIN ja vorikonatsolin vertailussa SECURE-tutkimuksessa todettiin, että uusi lääkeaine toimi samalla tavalla kokonaiskuolleisuuden ja kokonaisvasteen suhteen hoidon lopussa. Ensisijainen päätetapahtuma kaikista syistä johtuva kuolleisuus päivään 42 mennessä oli 19% isavukonatsolilla ja 20% vorikonatsolilla.Isavukonatsolin ei kuitenkaan katsottu olevan inferior, koska tutkijat käyttivät 10%: n noninferioriteettimarginaalia (CI-7, 8-5, 7). Isavukonatsolilla oli vähemmän haittatapahtumia kuin vorikonatsolilla, erityisesti silmiin, ihoon ja maksa-ja sappijärjestelmään liittyviä tapahtumia.19 lisäksi isavukonatsolilla on suuri oraalinen biologinen hyötyosuus, mikä saa aikaan 1: 1-suhteen laskimonsisäisen ja suun kautta otettavan lääkemuodon välillä tapahtuvassa muuntumisessa.
Salvage Therapy
IDSA: n ohjeissa ei suositella yhdistelmähoitoa IA: n ensimmäiseen hoitoon. Sen sijaan salvage-hoitoa suositellaan vain, jos alkuhoidolla ei saavuteta kliinistä vastetta. Näin ollen tämä voi edellyttää toisen aineen lisäämistä tai siirtymistä toiseen lääkkeeseen. Posakonatsolia, itrakonatsolia, AMB: tä ja kaspofungiinia on tutkittu käytettäväksi pelastuslääkkeinä, ja niitä suositellaan IDSA: n suosituksissa. Walsh ja kollegat tutkivat posakonatsolin 800 mg: n vuorokausiannoksen tehoa ja turvallisuutta potilailla, jotka eivät sietäneet alkuperäistä sienilääkettä tai eivät reagoineet siihen.Kokonaisonnistumisprosentti posakonatsoliryhmässä oli 42% ja kontrolliryhmässä 26% (P = .006).Ng: n ja Denningin tekemässä tutkimuksessa todettiin 40%: n vaste, kun AMB: n lipidipohjaista formulaatiota käytettiin PELASTUSHOITONA potilailla, joilla oli HOITORESISTENTTI tai jotka eivät sietäneet aikaisempaa hoitoa.Kaspofungiinia tutkittiin myös pelastushoitona ei-vertailevassa monikeskustutkimuksessa potilailla, joille tavanomainen hoito ei tehonnut; suotuisa vaste saavutettiin 44, 6%: lla potilaista.23
estohoito
posakonatsoli: IDSA: n ohjeissa suositellaan posakonatsolin käyttöä IA: n estohoidossa. Tämä suositus perustuu kahteen satunnaistettuun, kontrolloituun monikeskustutkimukseen, joissa arvioitiin posakonatsolin profylaktista käyttöä neutropeniaa ja Käänteishyljintää sairastavilla potilailla.Ensimmäisessä tutkimuksessa posakonatsolia (3 × 200 mg/vrk) verrattiin flukonatsoliin (1 × 400 mg) tai itrakonatsoliin (2 × 200 mg). IA raportoitiin 1%: lla posakonatsoliryhmän potilaista ja 7%: lla flukonatsoli-ja itrakonatsoliryhmän potilaista (P <.001).Toisessa tutkimuksessa posakonatsolia verrattiin flukonatsoliin Käänteishyljintää sairastavien potilaiden profylaksiassa. IA oli harvinaisempi posakonatsoliryhmässä kuin flukonatsoliryhmässä (1, 0% vs. 5, 9%; P = .001).25
Mikafungiini: IDSA: n ohjeissa suositellaan mikafungiinia vaihtoehtona posakonatsolille, vaikka sitä ei ole hyväksytty IA: n ensilinjan profylaksiaan. Tämä suositus perustuu satunnaistettuun faasin III kaksoissokkotutkimukseen, johon osallistui 882 potilasta, jotka saivat mikafungiinia 50 mg laskimoon (1 mg / kg <50 kg) verrattuna flukonatsolia 400 mg: aan (8 mg/kg <50 kg). Teho määriteltiin todetun, todennäköisen tai epäillyn systeemisen sieni-infektion puuttumisena. Neutropeenisen vaiheen aikana mikafungiinin kokonaisteho oli parempi kuin flukonatsolin (80% mikafungiiniryhmässä vs. 73.5% flukonatsoliryhmässä; 95% luottamusväli, 0, 9% – 12%; P = .03).27
Conclusion
IA on vaikea sieni-infektio, jota esiintyy yleisimmin immuunipuutteisilla potilailla. Aspergilloosin diagnosoinnissa, hoidossa ja ehkäisyssä on käsiteltävä useita kysymyksiä. Diagnostiset kriteerit on määritelty huonosti, mikä tekee IA-diagnoosin haastavaksi. Suuren kuolonuhririskin vuoksi sienilääkitys on aloitettava nopeasti ja oikein ollakseen tehokas. Kriittisiä aukkoja on yhdistelmähoidon käytössä, varhaisen toteamisen välineissä ja potilasryhmissä, joille estolääkityksestä olisi eniten hyötyä.2 siksi on tärkeää, että farmaseutit ovat perillä kunkin antifungaalisen aineen ominaisuuksista, jotta he voivat parhaiten tehdä järkeviä terapeuttisia päätöksiä IA: n hoidossa. Koska sienilääkkeiden resistenssin riski on lisääntynyt, farmaseuteilla voi olla tärkeä rooli IA: n hallinnassa avustamalla haittavaikutusten minimoinnissa ja hallinnassa, tekemällä asianmukaisia annostussuosituksia ja seuraamalla sopivien sienilääkkeiden valintaa—jotka kaikki ovat kriittisiä IA: n hoidon optimoimiseksi.
1. Denning DW. Invasiivinen aspergilloosi. Clin Tartuttaa Tämän. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Treatment of aspergillosis: clinical practice guidelines of the Infectious Diseases Society of America. Clin Tartuttaa Tämän. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Keuhkoaspergilloosi: kliininen katsaus. EUR Respir Rev. 2011;20: 156-174.
4. Barnesin poliisi, Marr KA. Aspergilloosi: taudin, diagnoosin ja hoidon spektri. Tartuta Tämä Clin North Am. 2006; 20: 545-561,vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. invasiivinen aspergilloosi teho-osastolla. Ann NY Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. A statistical approach in human brain connectome of Parkinson disease in Ukraine people using Network Based Statistics. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergillosis case-fatality rate: systemaattinen katsaus kirjallisuuteen. Clin Tartuttaa Tämän. 2001;32:358-366.
8. Dagenais TR, Keller NP. Aspergillus fumigatuksen patogeneesi invasiivisessa aspergilloosissa. Clin Microbiol Rev. 2009;22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Keuhkoaspergillooman kliiniset oireet ja hoitotulokset. Korean J Intern Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Keuhkoaspergilloosin kliininen kirjo. Rintakehä. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona s, et al. Comparison of epidemiological, clinical, and biological features of invasiivinen aspergillosis in neutropenic and nonneutropenic patients: a 6-year survey. Clin Tartuttaa Tämän. 2006;43:577-584.
12. Ohjastaja B, Fredricks D, Leisenring W, et al. Aspergillus galactomannan enzyme immunomääritys ja kvantitatiivinen PCR invasiivisen aspergilloosin diagnosointiin bronkoalveolaarisella huuhtelunesteellä. J Clin Microbiol. 2004;42:5517-5522.
13. Vehnä LJ, Walsh TJ. Invasiivisen aspergilloosin diagnoosi galaktomannan antigenemian toteamisella entsyymi-immunomäärityksellä. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer a ym. Invasiivinen aspergilloosi kriittisesti sairailla potilailla, joilla ei ole maligniteettia. Am J Respir Crit Care Med. 2004;170:621-625.
15. Sherif R, Segal BH. Keuhkoaspergilloosi: kliininen esitys, diagnostiset testit, hoito ja komplikaatiot. Olen Pahoillani. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF ym. Vorikonatsoli vs. amfoterisiini B invasiivisen aspergilloosin primaarihoidossa. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Kaspofungiini vs. liposomaalinen amfoterisiini B empiirisessä sienilääkityksessä potilailla, joilla on jatkuva kuume ja neutropenia. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Mikafungiini (FK463) yksinään tai yhdessä muiden systeemisten sienilääkkeiden kanssa akuutin invasiivisen aspergilloosin hoitoon. J Tartuttaa. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavukonatsoli: uusi vaihtoehto invasiivisten sieni-infektioiden hoitoon. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavukonatsoli vs. vorikonatsoli aspergilluksen ja muiden rihmasienten (SECURE) aiheuttaman invasiivisen homesairauden primaarihoidossa: vaiheen 3 satunnaistetussa kontrolloidussa non-inferiority-tutkimuksessa. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF ym. Invasiivisen aspergilloosin hoito posakonatsolilla potilailla, joille tavanomainen hoito ei tehoa tai jotka eivät siedä sitä: ulkoisesti kontrolloitu tutkimus. Clin Tartuttaa Tämän. 2007;44:2-12.
22. Ng TT, Denning DW. Liposomaalinen amfoterisiini B (Ambisomi) hoito invasiivisissa sieni-infektioissa. Evaluation of United Kingdom compassionate use data. Arch Harjoittelija Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Kaspofungiinin teho ja turvallisuus invasiivisen aspergilloosin hoidossa potilailla, joille tavanomainen sienilääkitys ei ole tehonnut tai jotka eivät siedä sitä. Clin Tartuttaa Tämän. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Posakonatsoli vs. flukonatsoli tai itrakonatsoli estohoidossa neutropeniapotilailla. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.