US Pharm. 2016; 41 (4): HS15-HS20.
abstrakt: invasiv aspergillose (IA) er en sjælden, alvorlig svampeinfektion, der ofte påvirker immunkompromitterede patienter. Den nøjagtige forekomst af IA er ikke dokumenteret, og rapporterede incidensrater varierer meget. Nogle typiske risikofaktorer for IA inkluderer hæmatopoietiske stamcelletransplantationer, langvarig kortikosteroidbehandling, hæmatologiske maligniteter og HIV. Lungerne er det hyppigste sted for IA; følgelig er symptomer og kliniske manifestationer typisk pulmonale. På grund af den høje risiko for dødsfald skal IA-behandling med de relevante agenser påbegyndes så hurtigt som muligt. Hvis der ikke er nogen klinisk respons, skal der administreres bjærgningsterapi med andre acoler, echinocandiner eller amphotericin B lipidformuleringer.
aspergillose er en svampeinfektion forårsaget af Aspergillus, som omfatter en stor gruppe allestedsnærværende skimmelarter (spp), der oftest findes i nedbrydende vegetation.1 aspergillose, som oftest observeres hos immunkompromitterede personer, er en væsentlig årsag til sygelighed og dødelighed i denne population med dødelighed så høj som 90%.2,3 der findes flere typer aspergilloseinfektioner, herunder allergisk bronchopulmonal aspergillose, allergisk Aspergillus sinusitis, aspergilloma, kronisk pulmonal aspergillose, kutan aspergillose og invasiv aspergillose (ia). De fleste af disse infektioner er forårsaget af Aspergillus fumigatus, efterfulgt af Aspergillus flavus, Aspergillus niger og Aspergillus terreus.4-6 IA er især en af de mest alvorlige aspergilloseinfektioner, og den har en høj dødelighed.5
etiologi og epidemiologi
almindelige risikofaktorer for IA inkluderer hæmatopoietisk stamcelletransplantation (HSCT), langvarig og svær neutropeni, hæmatologiske maligniteter, langvarig kortikosteroidbehandling og HIV. Imidlertid er visse ICU-immunkompetente populationer, såsom patienter med kronisk obstruktiv lungesygdom, alvorlig leversygdom eller kritiske sygdomme, der midlertidigt forstyrrer immunsystemet, også i øget risiko for ia.5 forekomsten af IA i en typisk ICU rapporteres at være 0,33% til 6,9%, hvilket er sammenligneligt med forekomsten hos patienter med fast organtransplantation.4,5
aspergillose er ikke en rapporterbar infektion i USA, fordi den er usædvanlig og ikke betragtes som en alvorlig trussel mod folkesundheden.6 som følge heraf er den nøjagtige forekomst af IA ikke dokumenteret. Derudover kan rapporterede incidensrater variere betydeligt, hvilket tyder på, at geografi kan spille en rolle.4 blandt transplantationsmodtagere varierer forekomsten af IA med almindelige underliggende tilstande, herunder lymfom og leukæmi.7 blandt fast organtransplantationsmodtagere er forekomsten af IA højere hos lunge – og levertransplantationsmodtagere (henholdsvis 2,4% -6% og 1% -8%) end hos nyre-og hjertetransplantationsmodtagere (henholdsvis 0,1% -4% og 0,3% -6%).4 forekomsten af IA hos HSCT-modtagere er endnu højere. Allogene HSCT-modtagere har en ia-forekomst på 2,3% til 11%, hvilket er mere end det dobbelte af den observerede forekomst hos autologe HSCT-modtagere (0,5% -4%).4 den samlede dødsfaldsprocent er beregnet til 58%.7,8 tilfælde af dødsfald i IA varierer dog afhængigt af den underliggende tilstand. I en systematisk gennemgang af 53 undersøgelser fra 1995 til 1999 var dødeligheden hos IA-patienter højest hos patienter med en historie med knoglemarvstransplantationer (86,7%) eller HIV/AIDS (85,7%) og lavest hos patienter med leukæmi eller lymfom (49,3%).7
patogenese
efter indånding af en fumigatus conidia (luftbårne sporer) udløser respiratoriske epitelceller og alveolære makrofager medfødte immunresponser mod inhaleret Aspergillus conidia. Disse patogener genkender derefter receptorer på værtsceller, såsom beta-glucanreceptoren Dectin-1. Interaktionen mellem patogener og receptorer fremkalder kemokiner og cytokiner og aktiverer og rekrutterer monocytter og neutrofiler. Neutrofiler binder sig til svampehyfer og degranulerer, hvilket resulterer i svampedrab. Dette angreb medieres af nicotinamidadenindinukleotidphosphatoksidase. I tilfælde af neutropeni er neutrofiler ikke tilgængelige til hyphal drab og kontrol af svampevækst, så voksende hyfer kan derefter sprede sig gennem endotelcelleforingen.8
kliniske manifestationer
lungerne er det mest almindelige sted for IA. Følgelig er ia-symptomer og kliniske manifestationer typisk pulmonale. I en undersøgelse observerede Lee og kolleger ia-symptomer hos 36 patienter og fandt, at hæmoptyse var den mest almindelige kliniske manifestation (72%) efterfulgt af hoste, åndenød og træthed.9 efterforskerne bemærkede, at ia-symptomer varierede fra asymptomatisk til massiv hæmoptyse (undertiden dødelig), og hyppigheden af symptomdebut varierede baseret på patientens immunsystem. Patienter med en vis grad af immunsuppression (f. eks. Diabetes mellitus, alkoholisme) kan forekomme med hurtigere udvikling af symptomer (dvs.uger snarere end måneder).10 i en 6-årig undersøgelse foretaget af Cornillet og kolleger var feber det mest almindelige kliniske tegn hos IA-patienter, der blev præsenteret hos 85% af patienterne (n = 88); brystsmerter var også almindelige.11 yderligere symptomer omfatter vægttab, sved og anoreksi.10
diagnose
dyrkning af væv er i øjeblikket guldstandarden for diagnosen IA.11 Denne metode giver ikke kun Aspergillus spp, men definerer yderligere terapeutiske muligheder via følsomhedstest. Imidlertid gør invasiviteten ved at opnå væv dyrkning mindre ønskelig. I fravær af vævsprøver kan bronchoalveolær skylning (BAL) væske opnået fra de øvre og nedre luftveje tjene til at etablere diagnosen IA.12 selvom BAL er en sikker procedure, er den samlede følsomhed for kultur ved anvendelse af BAL-prøver relativt lav (estimeret til 50%).13 blodprøvetagning er den optimale ikke-invasive diagnostiske tilgang til ia.12 på trods af denne noninvasiveness isoleres Aspergillus spp imidlertid sjældent fra blod gennem konventionelle kulturteknikker—deraf afhængigheden af vævsprøver for at sikre en endelig diagnose af ia.12 Da resultater fra kulturer generelt er relativt langsomme, er IA veletableret, når kulturen er positiv. Disse udfordringer har resulteret i udviklingen af diagnostiske metoder, der er mindre invasive og hurtigere.
serum galactomannan-analysen er en hurtig test, der er godkendt til at diagnosticere mistænkte tilfælde af ia hos patienter med hæmatologiske maligniteter eller HSCTs.13 Galactomannan, et polysaccharid frigivet i kropsvæsker under Aspergillusvækst, kan påvises i serum-og BAL-prøver flere dage før kliniske tegn og symptomer vises.13 Serumdetektion kan lette etableringen af en specifik diagnose, hvorimod BAL-væske ser ud til at have en højere følsomhed, men ofte er sværere at opnå.12,13 Meersseman og kolleger rapporterede, at følsomheden af galactomannan-detektion var 88% for BAL versus 42% for serum, og specificiteten af galactomannan for både BAL og serum var 86%.14 et positivt serumresultat kan muliggøre initiering af antifungale midler, mens et negativt resultat potentielt kan forhindre brugen af dyre og giftige svampedræbende stoffer.12 måling af (1,3)-beta-D-glucan i blodet kan også være nyttigt som et screeningsværktøj til ia. Selvom galactomannan-analysen er specifik for ia, kan (1,3)-beta-D-glucan-analysen også påvise andre invasive svampesygdomme, herunder candidiasis, andre skimmelpatogener og Pneumocystis jiroveci.15
Ledelse
Antifungal behandling forbliver grundpillen i behandlingen af ia.2 for at forhindre komplikationer og dårlige resultater bør antifungal behandling påbegyndes straks hos patienter med høj risiko for ia.2 Infectious Diseases Society of America (IDSA) anbefaler brug af voriconasol til primær behandling af invasiv pulmonal aspergillose såvel som til andre manifestationer, såsom aspergilloseinfektioner i bihulerne, aspergillose i centralnervesystemet og kronisk nekrotiserende pulmonal aspergillose.2 hvis primær behandling mislykkes, kan lipidformuleringer af amphotericin B (AMB), caspofungin og itraconasol anvendes som bjærgningsterapi.2 IDSA-retningslinjerne anbefaler også brug af posaconasol til profylakse hos neutropeniske patienter med myelodysplasi og leukæmi såvel som hos allogene HSCT-modtagere med graft-versus-host-sygdom (GvHD).2
empirisk behandling
et randomiseret, ikke-blindet forsøg, der sammenlignede med AMB, viste, at 52,8% af patienterne oplevede vellykkede resultater (fuldstændig eller delvis opløsning af læsioner på radiologi).16 gruppen havde også en højere overlevelsesrate end AMB-patienter (70,8% vs. 57.9%) og færre bivirkninger (343 hændelser vs. 421 hændelser; P = .02), hvilket fører efterforskere til at konkludere, at amb er bedre end AMB.16 doseringen anbefalet af IDSA-retningslinjerne (tabel 1) blev understøttet i dette forsøg.2 Voriconasol har en bivirkningsprofil, der inkluderer hudfølsomhed med udsættelse for direkte sollys, synsforstyrrelser og hepatotoksicitet, der er kendetegnet ved en stigning i serumbilirubin og lever.2
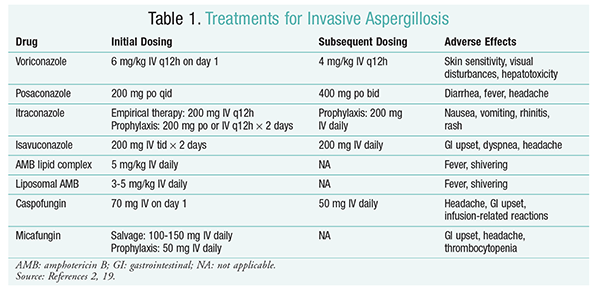
AMB: tidligere var AMB-deoksicholat standarden for pleje af aspergillose. Imidlertid har infusionsrelaterede reaktioner (inklusive feber, rigor, arthralgier, opkast og bronchospasmer) og nefrotoksicitet, der resulterer i potentiel nyresvigt, fået AMB til at falde ud af favør.2 derudover kan der forekomme acotæmi, når AMB-deoksicholat administreres sammen med nefrotoksiske midler (f.eks.2 som et resultat anbefaler IDSA lipidkompleksformuleringer som et alternativ, da forekomsten af bivirkninger er lavere end for deoksicholatformuleringen. Desuden var succesraterne i et forsøg fra Valsh og kolleger, der sammenlignede amb-lipidkompleks med caspofungin, ens (33,7% for AMB, 33,9% for caspofungin); derfor indeholder behandlingsretningslinjerne både AMB-lipidkompleks og caspofungin som alternativer til caspofungin.17
Echinocandiner (Caspofungin, Micafungin, Anidulafungin): selvom caspofungin er godkendt til IA-behandling, har micafungin og anidulafungin ikke vist sig effektive i den primære behandling af IA og anbefales derfor ikke af IDSA.18 Caspofungin kan forårsage hovedpine, gastrointestinal forstyrrelse og mulige infusionsrelaterede reaktioner på grund af histaminfrigivelse.2
i Marts 2015 godkendte FDA en ny anden generations triasol til IA. CRESEMBA er tilgængelig i både orale og IV opløsninger og er indiceret til behandling af IA og mucormycosis.19 i en sammenligning af sikker undersøgelse fastslog, at det nye middel udførte tilsvarende med hensyn til dødelighed af alle årsager og samlet respons ved afslutningen af behandlingen. Det primære endepunkt for all-cause mortalitet ved Dag 42 var 19% for isavacon og 20% for al-cause mortalitet ved Dag 42.20 imidlertid blev isavuconasol anset for ikke-ringere, da efterforskerne anvendte en margin på 10% uden mindretal (CI -7,8 til 5,7). Især hændelser, der involverede øjne, hud og hepatobiliært system.19 endelig har den høje orale biotilgængelighed, hvilket giver et forhold på 1: 1 i en omdannelse mellem IV og orale formuleringer.
Bjærgningsterapi
IDSA-retningslinjerne anbefaler ikke kombinationsbehandling til den indledende behandling af ia. I stedet anbefales bjærgningsterapi kun, hvis der ikke er nogen klinisk respons på indledende terapi. Derfor kan dette indebære at tilføje et andet middel eller skifte til en anden medicin. Caspofungin er blevet undersøgt til brug som bjærgningsterapi og anbefales af IDSA retningslinjer. 800 mg suspension dagligt hos patienter, der var intolerante eller ikke reagerede på det oprindelige antisvampemiddel.21 Den samlede succesrate var 42% for kontrolgruppen og 26% for kontrolgruppen (P = .006).21 en undersøgelse foretaget af NG og Denning viste en 40% responsrate, når en lipidbaseret formulering af AMB blev anvendt som bjærgningsterapi hos IA-patienter, der var ildfaste eller intolerante over for eksisterende terapi.22 Caspofungin blev også undersøgt som bjærgningsterapi i en ikke-komparativ multicenterundersøgelse af patienter, der var ildfaste over for konventionel terapi; et gunstigt respons forekom hos 44,6% af patienterne.23
profylakse
POSACONASOL: IDSA-retningslinjerne anbefaler brug af posaconasol til profylakse af ia. Denne anbefaling er baseret på to randomiserede, kontrollerede multicenterforsøg, der evaluerede den profylaktiske anvendelse af posaconasol hos patienter med neutropeni og GvHD.24,25 i det første forsøg blev der sammenlignet med 3 liter 200 mg/dag med 1 liter 400 mg eller 2 liter 200 mg. IA blev rapporteret hos 1% af patienterne i gruppen versus 7% af patienterne i gruppen (P <).001).26 i den anden undersøgelse sammenlignede man med GVHD for profylakse hos patienter med GvHD. IA var mindre hyppigt i gruppen end i gruppen (1, 0% vs. 5, 9%; P = .001).25
Micafungin: Selvom det ikke er godkendt til førstelinjeprofylakse af IA, anbefaler IDSA-retningslinjerne micafungin som et alternativ til posaconasol. Denne anbefaling er baseret på et randomiseret, dobbeltblindet fase III-forsøg med 882 patienter, der fik micafungin 50 mg IV (1 mg/kg hos patienter <50 kg) versus 400 mg (8 mg/kg hos patienter <50 kg). Effekt blev defineret som fravær af påvist, sandsynlig eller mistænkt systemisk svampeinfektion. I den neutropeniske fase var den samlede effekt af micafungin bedre end effekten af micafungin (80% for micafungin-gruppen vs. 73.5% for gruppen; 95% CI, 0,9% -12%; P = .03).27
konklusion
IA er en alvorlig svampeinfektion, der forekommer oftest hos immunkompromitterede patienter. Flere spørgsmål skal behandles i diagnosen, behandlingen og forebyggelsen af aspergillose. Diagnostiske kriterier er dårligt definerede, hvilket gør diagnosen ia udfordrende. På grund af den høje risiko for dødsfald skal antifungal behandling påbegyndes hurtigt og korrekt for at være effektiv. Der findes kritiske huller med hensyn til brugen af kombinationsterapi, værktøjer til tidlig påvisning og de patientpopulationer, hvor profylakse ville være mest gavnlig.2 Derfor er det vigtigt for farmaceuter at være vidende om hvert antimykotisk middels egenskaber for at være bedst rustet til at træffe sunde terapeutiske beslutninger i behandlingen af ia. I betragtning af den øgede risiko for antifungal resistens kan apotekere faktisk spille en vigtig rolle i styringen af ia ved at hjælpe med at minimere og håndtere bivirkninger, fremsætte passende doseringsanbefalinger og overvåge udvælgelsen af egnede antifungale midler—som alle er kritiske for at optimere terapi til ia.
1. Denning DV. Invasiv aspergillose. Clin Inficere Dis. 1998;26:781-803.
2. Jørgen Jørgensen, Jørgen Jørgensen, et al. Behandling af aspergillose: retningslinjer for klinisk praksis fra Infectious Diseases Society of America. Clin Inficere Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Pulmonal aspergillose: en klinisk gennemgang. EUR Respir Rev. 2011; 20: 156-174.
4. Barnes PD, Marr KA. Aspergillose: spektrum af sygdom, diagnose og behandling. Inficere Dis Clin North Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantseskaki F, Poulakou G, Armaganidis A. invasiv aspergillose i intensivafdelingen. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. En statistisk tilgang i menneskelig hjerneforbindelse af Parkinsons sygdom hos ældre, der bruger netværksbaseret statistik. Conf Proc IEEE Eng med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schrans J, Teutsch SM. Aspergillose tilfælde-dødelighed: systematisk gennemgang af litteraturen. Clin Inficere Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogenese af Aspergillus fumigatus i invasiv aspergillose. Clin Microbiol Rev. 2009; 22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Kliniske manifestationer og behandlingsresultater af pulmonal aspergillom. Koreansk J Praktikant Med. 2004;19:38-42.
10. Kosmidis C, Denning DV. Det kliniske spektrum af pulmonal aspergillose. Thorax. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Sammenligning af epidemiologiske, kliniske og biologiske træk ved invasiv aspergillose hos neutropeniske og nonneutropeniske patienter: en 6-årig undersøgelse. Clin Inficere Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring M, et al. Til diagnosticering af invasiv aspergillose med bronchoalveolær skyllevæske. J Clin Microbiol. 2004;42:5517-5522.
13. Hvede LJ, Valsh TJ. Diagnose af invasiv aspergillose ved galactomannan antigenemia detektion ved hjælp af et immunoassay. Eur J Clin Microbiol Inficerer Dis. 2008;27:245-251.
14. M, Vandecasteele SJ, Vilmer A, et al. Invasiv aspergillose hos kritisk syge patienter uden malignitet. Am J Respir Crit Pleje Med. 2004;170:621-625.
15. Sherif R, Segal BH. Pulmonal aspergillose: klinisk præsentation, diagnostiske tests, ledelse og komplikationer. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DV, Patterson TF, et al. Til primær behandling af invasiv aspergillose. N Engl J Med. 2002;347:408-415.
17. Jørgen Jørgensen, Jørgen Jørgensen, et al. Caspofungin versus liposomal amphotericin B til empirisk antifungal behandling hos patienter med vedvarende feber og neutropeni. N Engl J Med. 2004;351:1391-1402.
18. Denning DV, Marr KA, Lau masseødelæggelsesvåben, et al. Micafungin (FK463), alene eller i kombination med andre systemiske antifungale midler, til behandling af akut invasiv aspergillose. J Inficere. 2006;53:337-349.
19. Pettit NN, Carver PL. Diprol: en ny mulighed for håndtering af invasive svampeinfektioner. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Til primær behandling af invasiv skimmelsvamp forårsaget af Aspergillus og andre filamentøse svampe (SECURE): et fase 3, randomiseret kontrolleret, non-inferioritetsforsøg. Lancet. 2016;387:760-769.
21. TF, et al. Behandling af invasiv aspergillose hos patienter, der er ildfaste over for eller intolerante over for konventionel behandling: et eksternt kontrolleret forsøg. Clin Inficere Dis. 2007;44:2-12.
22. Ng TT, Denning DV. Liposomal amphotericin B (AmBisome) terapi ved invasive svampeinfektioner. Evaluering af data om medfølende brug i Det Forenede Kongerige. Arch Praktikant Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Effekt og sikkerhed af caspofungin til behandling af invasiv aspergillose hos patienter, der er ildfaste over for eller intolerante over for konventionel antifungal behandling. Clin Inficere Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Dj, et al. Hos patienter med neutropeni. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.