US Pharm. 2016;41(4):HS15-HS20.
ZUSAMMENFASSUNG: Invasive Aspergillose (IA) ist eine seltene, schwere Pilzinfektion, die häufig immungeschwächte Patienten betrifft. Die genaue Inzidenz von IA wurde nicht dokumentiert, und die gemeldeten Inzidenzraten variieren stark. Einige typische Risikofaktoren für IA sind hämatopoetische Stammzelltransplantationen, langfristige Kortikosteroidtherapie, hämatologische Malignome und HIV. Die Lunge ist die häufigste Stelle von IA; Folglich sind Symptome und klinische Manifestationen typischerweise pulmonal. Wegen des hohen Todesrisikos muss das IA-Management mit den entsprechenden Agenten so schnell wie möglich beginnen. Voriconazol ist die empirische Erstlinientherapie, die von den Richtlinien der Infectious Diseases Society of America empfohlen wird; Wenn kein klinisches Ansprechen vorliegt, sollte eine Salvage-Therapie mit anderen Azolen, Echinocandinen oder Amphotericin B-Lipidformulierungen verabreicht werden.
Aspergillose ist eine Pilzinfektion, die durch Aspergillus verursacht wird und eine große Gruppe von allgegenwärtigen Schimmelpilzarten (spp) umfasst, die am häufigsten in zersetzender Vegetation vorkommen.1 Aspergillose, die am häufigsten bei immungeschwächten Personen beobachtet wird, ist eine signifikante Ursache für Morbidität und Mortalität in dieser Population mit Sterblichkeitsraten von bis zu 90%.2,3 Es gibt verschiedene Arten von Aspergillose-Infektionen, darunter allergische bronchopulmonale Aspergillose, allergische Aspergillus-Sinusitis, Aspergillom, chronische pulmonale Aspergillose, kutane Aspergillose und invasive Aspergillose (IA). Die meisten dieser Infektionen werden durch Aspergillus fumigatus verursacht, gefolgt von Aspergillus flavus, Aspergillus niger und Aspergillus terreus.Insbesondere 4-6 IA ist eine der schwersten Aspergillose-Infektionen und weist eine hohe Sterblichkeitsrate auf.5
Ätiologie und Epidemiologie
Häufige Risikofaktoren für IA sind hämatopoetische Stammzelltransplantation (HSCT), verlängerte und schwere Neutropenie, hämatologische Malignome, langfristige Kortikosteroidtherapie und HIV. Bestimmte immunkompetente Populationen auf der Intensivstation, wie Patienten mit chronisch obstruktiver Lungenerkrankung, schwerer Lebererkrankung oder kritischen Krankheiten, die das Immunsystem vorübergehend stören, haben jedoch ebenfalls ein erhöhtes Risiko für IA.5 Die Inzidenz von IA auf einer typischen Intensivstation wird mit 0,33% bis 6,9% angegeben, was mit der Inzidenz bei Patienten mit Organtransplantationen vergleichbar ist.4,5
Aspergillose ist in den Vereinigten Staaten keine meldepflichtige Infektion, da sie ungewöhnlich ist und nicht als ernsthafte Bedrohung für die öffentliche Gesundheit angesehen wird.6 Infolgedessen wurde die genaue Inzidenz von IA nicht dokumentiert. Darüber hinaus können die gemeldeten Inzidenzraten erheblich variieren, was darauf hindeutet, dass die Geographie eine Rolle spielen kann.4 Unter den Transplantatempfängern variiert die Inzidenz von IA mit häufigen Grunderkrankungen wie Lymphom und Leukämie.7 Unter den Empfängern fester Organtransplantationen ist die Inzidenz von IA bei Empfängern von Lungen- und Lebertransplantationen höher (2,4% -6% bzw. 1% -8%) als bei Empfängern von Nieren- und Herztransplantationen (0,1% -4% bzw. 0,3% -6%).4 Die Inzidenz von IA bei HSCT-Empfängern ist noch höher. Allogene HSCT-Empfänger haben eine IA-Inzidenz von 2,3% bis 11%, was mehr als doppelt so hoch ist wie die beobachtete Inzidenzrate bei autologen HSCT-Empfängern (0,5% -4%).4 Die Gesamtfalltodesrate wurde mit 58% berechnet.7,8 Die Sterblichkeitsraten von IA variieren jedoch je nach Grunderkrankung. In einer systematischen Überprüfung von 53 Studien von 1995 bis 1999 war die Fall-Todesrate bei IA-Patienten bei Patienten mit Knochenmarktransplantationen in der Vorgeschichte (86,7%) oder HIV / AIDS (85,7%) am höchsten und am niedrigsten bei Patienten mit Leukämie oder Lymphom (49,3%).7
Pathogenese
Nach Inhalation einer Fumigatus conidia (Luftsporen) lösen respiratorische Epithelzellen und Alveolarmakrophagen angeborene Immunantworten gegen inhalierte Aspergillus conidia aus. Diese Krankheitserreger erkennen dann Rezeptoren auf Wirtszellen, wie den Beta-Glucan-Rezeptor Dectin-1. Die Interaktion zwischen Pathogenen und Rezeptoren provoziert Chemokine und Zytokine und aktiviert und rekrutiert Monozyten und Neutrophile. Neutrophile heften sich an Pilzhyphen und degranulieren, was zur Abtötung von Pilzen führt. Dieser Angriff wird durch Nikotinamidadenindinukleotidphosphatoxidase vermittelt. Im Falle einer Neutropenie stehen Neutrophile nicht für die Abtötung von Hyphen und die Kontrolle des Pilzwachstums zur Verfügung, so dass sich wachsende Hyphen dann in der Endothelzellauskleidung ausbreiten können.8
Klinische Manifestationen
Die Lunge ist die häufigste Stelle von IA. Folglich sind IA-Symptome und klinische Manifestationen typischerweise pulmonal. In einer Studie beobachteten Lee und Kollegen IA-Symptome bei 36 Patienten und stellten fest, dass Hämoptyse die häufigste klinische Manifestation war (72%), gefolgt von Husten, Atemnot und Müdigkeit.9 Die Forscher stellten fest, dass die IA-Symptome von asymptomatisch bis massiv reichten Hämoptyse (manchmal tödlich), und die Rate des Auftretens der Symptome variierte je nach Immunsystem des Patienten. Patienten mit einer gewissen Immunsuppression (z. B. AIDS, Kortikosteroidkonsum, Diabetes mellitus, Alkoholismus) kann eine schnellere Entwicklung der Symptome (d. H. Wochen statt Monate) aufweisen.10 In einer 6-Jahres-Umfrage, die von Cornillet und Kollegen durchgeführt wurde, war Fieber das häufigste klinische Zeichen bei IA-Patienten, das bei 85% der Patienten auftrat (n = 88); Brustschmerzen waren ebenfalls häufig.11 Zusätzliche Symptome sind Gewichtsverlust, Schweißausbrüche und Anorexie.10
Diagnose
Die Kultivierung von Gewebe ist derzeit der Goldstandard für die Diagnose von IA.11 Diese Methode liefert nicht nur Aspergillus spp., sondern definiert auch therapeutische Optionen über Empfindlichkeitstests. Die Invasivität der Gewinnung von Gewebe macht die Kultivierung jedoch weniger wünschenswert. In Abwesenheit von Gewebeproben kann bronchoalveoläre Lavage (BAL) -Flüssigkeit, die aus den oberen und unteren Atemwegen gewonnen wird, dazu dienen, die Diagnose von IA zu stellen.12 Obwohl BAL ein sicheres Verfahren ist, ist die Gesamtempfindlichkeit der Kultur unter Verwendung von BAL-Proben relativ gering (geschätzt auf 50%).13 Die Blutentnahme ist der optimale nichtinvasive diagnostische Ansatz für IA.12 Trotz dieser Nichtinvasivität, jedoch, Aspergillus spp werden selten durch herkömmliche Kulturtechniken aus Blut isoliert – daher die Abhängigkeit von Gewebeproben, um eine endgültige Diagnose von IA zu gewährleisten.12 Da die Ergebnisse von Kulturen insgesamt relativ langsam zu erhalten sind, ist die IA zu dem Zeitpunkt, zu dem die Kultur positiv ist, gut etabliert. Diese Herausforderungen haben zur Entwicklung von Diagnosemethoden geführt, die weniger invasiv und schneller sind.
Der Serum-Galactomannan-Assay ist ein Schnelltest, der zur Diagnose von Verdachtsfällen von IA bei Patienten mit hämatologischen Malignomen oder HSCTs zugelassen ist.13 Galactomannan, ein Polysaccharid, das während des Aspergillus-Wachstums in Körperflüssigkeiten freigesetzt wird, kann mehrere Tage vor Auftreten klinischer Anzeichen und Symptome in Serum- und BAL-Proben nachgewiesen werden.13 Der Serumnachweis kann die Feststellung einer spezifischen Diagnose erleichtern, während BAL-Flüssigkeit eine höhere Empfindlichkeit zu haben scheint, aber oft schwieriger zu erhalten ist.12,13 Meersseman und Kollegen berichteten, dass die Empfindlichkeit des Galactomannan-Nachweises 88% für BAL gegenüber 42% für Serum betrug, und die Spezifität von Galactomannan sowohl für BAL als auch für Serum betrug 86%.14 Ein positives Serumergebnis kann die Einleitung von Antimykotika ermöglichen, während ein negatives Ergebnis möglicherweise die Verwendung teurer und toxischer Antimykotika verhindern kann.12 Die Messung von (1,3) -beta-D-Glucan im Blut kann auch als Screening-Tool für IA nützlich sein. Obwohl der Galactomannan-Assay spezifisch für IA ist, kann der (1,3) -beta-D-glucan-Assay auch andere invasive Pilzkrankheiten wie Candidiasis, andere Schimmelpilzpathogene und Pneumocystis jiroveci nachweisen.15
Management
Die antimykotische Behandlung bleibt die Hauptstütze der Behandlung von IA.2 Um Komplikationen und schlechte Ergebnisse zu vermeiden, sollte bei Patienten mit hohem IA-Risiko sofort eine antimykotische Behandlung eingeleitet werden.2 Die Infectious Diseases Society of America (IDSA) empfiehlt die Verwendung von Voriconazol zur primären Behandlung von invasiver pulmonaler Aspergillose sowie für andere Manifestationen wie Aspergillose-Infektionen der Nebenhöhlen, Aspergillose des Zentralnervensystems und chronische nekrotisierende pulmonale Aspergillose.2 Wenn die Primärbehandlung fehlschlägt, können Lipidformulierungen von Amphotericin B (AMB), Caspofungin und Itraconazol als Salvage-Therapie verwendet werden.2 Die IDSA-Richtlinien empfehlen auch die Verwendung von Posaconazol zur Prophylaxe bei neutropenischen Patienten mit Myelodysplasie und Leukämie sowie bei allogenen HSCT-Empfängern mit Graft-versus-Host-Krankheit (GvHD).2
Empirische Behandlung
Voriconazol: Eine randomisierte, nicht verblindete Studie, in der Voriconazol mit AMB verglichen wurde, ergab, dass 52, 8% der Voriconazol-Patienten erfolgreiche Ergebnisse erzielten (vollständige oder teilweise Auflösung von Läsionen in der Radiologie).16 Die Voriconazol-Gruppe hatte auch eine höhere Überlebensrate als AMB-Patienten (70,8% vs. 57.9%) und weniger unerwünschte Ereignisse (343 Ereignisse vs. 421 Ereignisse; P = .02), was die Forscher zu dem Schluss brachte, dass Voriconazol AMB überlegen ist.16 Die in den IDSA-Richtlinien empfohlene Voriconazol-Dosierung (TABELLE 1) wurde in dieser Studie unterstützt.2 Voriconazol hat ein Nebenwirkungsprofil, das die Hautempfindlichkeit bei direkter Sonneneinstrahlung, Sehstörungen und Hepatotoxizität umfasst, die durch einen Anstieg des Serumbilirubins und der Leberenzyme gekennzeichnet sind.2
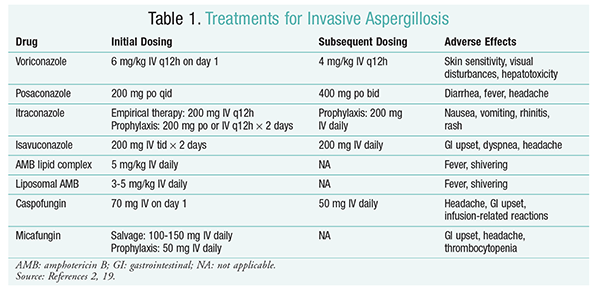
AMB: Zuvor war AMB-Desoxycholat der Standard der Behandlung von Aspergillose. Infusionsbedingte Reaktionen (einschließlich Fieber, Steifheit, Arthralgien, Erbrechen und Bronchospasmen) und Nephrotoxizität, die zu einem möglichen Nierenversagen führten, haben jedoch dazu geführt, dass AMB in Ungnade fiel.2 Zusätzlich kann eine Azotämie auftreten, wenn AMB-Desoxycholat gleichzeitig mit nephrotoxischen Mitteln (z. B. Cyclosporin oder Tacrolimus) verabreicht wird.2 Daher empfiehlt die IDSA als Alternative Lipidkomplexformulierungen, da die Inzidenz von Nebenwirkungen geringer ist als bei der Desoxycholatformulierung. Darüber hinaus waren in einer Studie von Walsh und Kollegen, die AMB Lipid Complex mit Caspofungin verglichen, die Erfolgsraten ähnlich (33,7% für AMB, 33,9% für Caspofungin); Daher listen die Behandlungsrichtlinien sowohl AMB Lipid Complex als auch Caspofungin als Alternativen zu Voriconazol auf.17
Echinocandine (Caspofungin, Micafungin, Anidulafungin): Obwohl Caspofungin für die IA-Therapie zugelassen wurde, haben sich Micafungin und Anidulafungin bei der primären Behandlung von IA nicht als wirksam erwiesen und werden daher von der IDSA nicht empfohlen.18 Caspofungin kann aufgrund der Histaminfreisetzung Kopfschmerzen, Magen-Darm-Störungen und mögliche infusionsbedingte Reaktionen verursachen.2
Isavuconazol: Im März 2015 genehmigte die FDA ein neuartiges Triazol der zweiten Generation für IA. Isavuconazol wird unter dem Handelsnamen Cresemba vertrieben und ist sowohl in oraler als auch in intravenöser Form erhältlich und zur Behandlung von IA und Mukormykose indiziert.19 In einem Vergleich von Isavuconazol und Voriconazol stellte die SECURE-Studie fest, dass das neue Mittel in Bezug auf die Gesamtmortalität und das Gesamtansprechen am Ende der Therapie eine ähnliche Leistung erbrachte. Der primäre Endpunkt der Gesamtmortalität am Tag 42 betrug 19% für Isavuconazol und 20% für Voriconazol.20 Isavuconazol wurde jedoch als nicht minderwertig eingestuft, da die Forscher eine Nichtunterlegenheitsspanne von 10% verwendeten (KI -7,8 bis 5,7). Isavuconazol hatte weniger unerwünschte Ereignisse als Voriconazol, insbesondere Ereignisse, die die Augen, die Haut und das hepatobiliäre System betrafen.19 Schließlich weist Isavuconazol eine hohe orale Bioverfügbarkeit auf, was ein Verhältnis von 1: 1 bei einer Umwandlung zwischen IV und oralen Formulierungen ergibt.
Salvage Therapy
Die IDSA-Richtlinien empfehlen keine Kombinationstherapie für die Erstbehandlung von IA. Stattdessen wird eine Salvage-Therapie nur empfohlen, wenn kein klinisches Ansprechen auf die Initialtherapie vorliegt. Folglich kann dies das Hinzufügen eines zweiten Mittels oder den Wechsel zu einem anderen Medikament beinhalten. Posaconazol, Itraconazol, AMB und Caspofungin wurden zur Verwendung als Bergungstherapie untersucht und werden von IDSA-Richtlinien empfohlen. Walsh und Kollegen untersuchten die Wirksamkeit und Sicherheit von Posaconazol 800 mg Suspension täglich bei Patienten, die intolerant waren oder nicht auf das anfängliche Antimykotikum ansprachen.21 Die Gesamterfolgsrate betrug 42% für die Posaconazol-Gruppe und 26% für die Kontrollgruppe (P = .006).21 Eine Studie von Ng und Denning zeigte eine Ansprechrate von 40%, wenn eine lipidbasierte Formulierung von AMB als Salvage-Therapie bei IA-Patienten verwendet wurde, die gegenüber einer bestehenden Therapie refraktär oder intolerant waren.22 Caspofungin wurde auch als Salvage-Therapie in einer nicht vergleichenden multizentrischen Studie an Patienten untersucht, die gegenüber einer konventionellen Therapie refraktär waren; Ein günstiges Ansprechen trat bei 44,6 % der Patienten auf.23
Prophylaxe
Posaconazol: Die IDSA-Richtlinien empfehlen die Verwendung von Posaconazol zur Prophylaxe von IA. Diese Empfehlung basiert auf zwei randomisierten, kontrollierten, multizentrischen Studien, in denen die prophylaktische Anwendung von Posaconazol bei Patienten mit Neutropenie und GvHD untersucht wurde.24,25 In der ersten Studie wurde Posaconazol (3 × 200 mg/Tag) mit Fluconazol (1 × 400 mg) oder Itraconazol (2 × 200 mg) verglichen. IA wurde bei 1% der Patienten in der Posaconazol-Gruppe gegenüber 7% der Patienten in der Fluconazol- und Itraconazol-Gruppe berichtet (P <.001).26 Die zweite Studie verglich Posaconazol mit Fluconazol zur Prophylaxe bei Patienten mit GvHD. IA war in der Posaconazol-Gruppe seltener als in der Fluconazol-Gruppe (1,0% vs. 5,9%; P = .001).25
Micafungin: Obwohl nicht für die Erstlinienprophylaxe von IA zugelassen, empfehlen die IDSA-Richtlinien Micafungin als Alternative zu Posaconazol. Diese Empfehlung basiert auf einer randomisierten, doppelblinden Phase-III-Studie mit 882 Patienten, die Micafungin 50 mg IV (1 mg / kg bei Patienten <50 kg) im Vergleich zu Fluconazol 400 mg (8 mg / kg bei Patienten < 50 kg) erhielten. Die Wirksamkeit wurde als Fehlen einer nachgewiesenen, wahrscheinlichen oder vermuteten systemischen Pilzinfektion definiert. Während der neutropenischen Phase war die Gesamtwirksamkeit von Micafungin der von Fluconazol überlegen (80% für die Micafungin-Gruppe gegenüber 73%.5% für die Fluconazol-Gruppe; 95% CI, 0,9%-12%; P = .03).27
Schlussfolgerung
IA ist eine schwere Pilzinfektion, die am häufigsten bei immungeschwächten Patienten auftritt. Bei der Diagnose, Behandlung und Vorbeugung von Aspergillose müssen mehrere Fragen beantwortet werden. Diagnosekriterien sind schlecht definiert, was die Diagnose von IA schwierig macht. Aufgrund des hohen Todesrisikos muss die antimykotische Therapie schnell und korrekt eingeleitet werden, um wirksam zu sein. Kritische Lücken bestehen in Bezug auf den Einsatz von Kombinationstherapie, Instrumente zur Früherkennung, und die Patientenpopulationen, in denen eine Prophylaxe am vorteilhaftesten wäre.2 Daher ist es wichtig, dass Apotheker über die Eigenschaften jedes Antimykotikums Bescheid wissen, um am besten gerüstet zu sein, um fundierte therapeutische Entscheidungen bei der Behandlung von IA zu treffen. In der Tat können Apotheker angesichts des erhöhten Risikos einer antimykotischen Resistenz eine wichtige Rolle bei der Behandlung von IA spielen, indem sie bei der Minimierung und Behandlung von Nebenwirkungen helfen, geeignete Dosierungsempfehlungen geben und die Auswahl geeigneter Antimykotika überwachen.
1. Denning DW. Invasive Aspergillose. Clin Infizieren Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Behandlung von Aspergillose: Richtlinien für die klinische Praxis der Infectious Diseases Society of America. Clin Infizieren Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Pulmonale Aspergillose: eine klinische Überprüfung. Eur Respir Rev. 2011;20:156-174.
4. Barnes PD, Marr KA. Aspergillose: Spektrum der Krankheit, Diagnose und Behandlung. Infizieren Sie Dis Clin North Am. 2006;20:545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. Invasive Aspergillose auf der Intensivstation. In: Ann N Y Acad Sci. 2012;1272:31-39.
6. In: Aarabi MH, Kamalian A, Mohajer B, et al. Ein statistischer Ansatz im menschlichen Gehirn Connectome der Parkinson-Krankheit bei älteren Menschen mit netzwerkbasierten Statistiken. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergillose-Fall-Todesrate: systematische Überprüfung der Literatur. Clin Infizieren Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Pathogenese von Aspergillus fumigatus bei invasiver Aspergillose. Clin Microbiol Rev. 2009;22:447-465.
9. Lee SH, Lee BJ, Jung DY, et al. Klinische Manifestationen und Behandlungsergebnisse des pulmonalen Aspergilloms. In: Korean J Intern Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Das klinische Spektrum der pulmonalen Aspergillose. Thorax. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Vergleich epidemiologischer, klinischer und biologischer Merkmale der invasiven Aspergillose bei neutropenischen und nicht-neutropenischen Patienten: eine 6-Jahres-Umfrage. Clin Infizieren Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Aspergillus galactomannan Enzymimmunoassay und quantitative PCR zur Diagnose von invasiver Aspergillose mit bronchoalveolärer Lavageflüssigkeit. In: J Clin Microbiol. 2004;42:5517-5522.
13. Weizen LJ, Walsh TJ. Diagnose der invasiven Aspergillose durch Galactomannan-Antigenämie-Nachweis unter Verwendung eines Enzymimmunoassays. In: Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Invasive Aspergillose bei kritisch kranken Patienten ohne Malignität. In: Am J Respir Crit Care Med. 2004;170:621-625.
15. Sherif R, Segal BH. Pulmonale Aspergillose: klinische Präsentation, diagnostische Tests, Management und Komplikationen. In: Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazol versus Amphotericin B zur Primärtherapie der invasiven Aspergillose. In: N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungin versus liposomales Amphotericin B zur empirischen antimykotischen Therapie bei Patienten mit anhaltendem Fieber und Neutropenie. In: N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungin (FK463) allein oder in Kombination mit anderen systemischen Antimykotika zur Behandlung der akuten invasiven Aspergillose. J infizieren. 2006;53:337-349.
19. Pettit NN, Schnitzer PL. Isavuconazol: eine neue Option für das Management von invasiven Pilzinfektionen. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazol versus Voriconazol zur Primärbehandlung invasiver Schimmelpilzerkrankungen durch Aspergillus und andere filamentöse Pilze (SECURE): eine randomisiert-kontrollierte Phase-3-Studie ohne Unterlegenheit. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et al. Behandlung der invasiven Aspergillose mit Posaconazol bei Patienten, die auf eine konventionelle Therapie nicht ansprechen oder diese nicht vertragen: eine extern kontrollierte Studie. Clin Infizieren Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Liposomales Amphotericin B (AmBisome) Therapie bei invasiven Pilzinfektionen. Auswertung von Compassionate Use-Daten aus Großbritannien. In: Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Wirksamkeit und Sicherheit von Caspofungin zur Behandlung der invasiven Aspergillose bei Patienten, die auf eine konventionelle antimykotische Therapie nicht ansprechen oder diese nicht vertragen. Clin Infizieren Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Posaconazol vs. Fluconazol oder Itraconazol Prophylaxe bei Patienten mit Neutropenie. In: N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.