US Pharm . 2016; 41(4):HS15-HS20.
streszczenie: inwazyjna aspergiloza (IA) jest rzadkim, ciężkim zakażeniem grzybiczym, często występującym u pacjentów z obniżoną odpornością. Dokładna częstość występowania IA nie została udokumentowana, a zgłaszane częstości występowania są bardzo zróżnicowane. Niektóre typowe czynniki ryzyka IA obejmują przeszczepy hematopoetycznych komórek macierzystych, długotrwałe leczenie kortykosteroidami, nowotwory hematologiczne i HIV. Płuca są najczęstszym miejscem IA; w związku z tym objawy i objawy kliniczne są zazwyczaj płucne. Ze względu na wysokie ryzyko śmiertelności, zarządzanie IA z odpowiednimi agentami musi rozpocząć się tak szybko, jak to możliwe. Worykonazol jest terapią empiryczną pierwszego rzutu zalecaną przez wytyczne Infectious Diseases Society of America; jeśli nie ma odpowiedzi klinicznej, należy zastosować terapię ratującą innymi preparatami azoli, echinokandyn lub amfoterycyny B.
aspergiloza jest zakażeniem grzybiczym wywołanym przez Aspergillus, który obejmuje dużą grupę wszechobecnych gatunków pleśni (spp) najczęściej występujących w rozkładającej się roślinności.1 aspergiloza, która najczęściej występuje u osób z obniżoną odpornością, jest istotną przyczyną zachorowalności i śmiertelności w tej populacji, przy współczynniku śmiertelności sięgającym 90%.2,3 istnieje kilka rodzajów zakażeń aspergilozą, w tym alergiczna aspergiloza oskrzelowo-płucna, alergiczne zapalenie zatok Aspergillus, aspergilloma, przewlekła aspergiloza płuc, aspergiloza skórna i inwazyjna aspergiloza (IA). Większość tych zakażeń jest wywoływana przez Aspergillus fumigatus, a następnie przez Aspergillus flavus, Aspergillus niger i Aspergillus terreus.W szczególności 4-6 IA jest jednym z najcięższych zakażeń aspergilozą i charakteryzuje się wysoką śmiertelnością.
etiologia i epidemiologia
do częstych czynników ryzyka IA należą przeszczep hematopoetycznych komórek macierzystych (HSCT), długotrwała i ciężka neutropenia, nowotwory złośliwe układu krwiotwórczego, długotrwałe leczenie kortykosteroidami i HIV. Jednak niektóre populacje OIOM-immunocompetent, takie jak pacjenci z przewlekłą obturacyjną chorobą płuc, ciężką chorobą wątroby lub chorobami krytycznymi, które tymczasowo zakłócają układ odpornościowy, są również narażone na zwiększone ryzyko IA.Częstość występowania IA w typowym oddziale intensywnej terapii wynosi 0, 33% do 6, 9%, co jest porównywalne z częstością występowania u pacjentów po przeszczepieniu narządów stałych.4,5
aspergiloza nie jest zgłaszaną infekcją w Stanach Zjednoczonych, ponieważ jest rzadkością i nie jest uważana za poważne zagrożenie dla zdrowia publicznego.W rezultacie dokładna częstość występowania IA nie została udokumentowana. Dodatkowo, zgłaszane wskaźniki zachorowalności mogą się znacznie różnić, co sugeruje, że geografia może odgrywać rolę.4 wśród biorców przeszczepów częstość występowania IA jest różna, z częstymi schorzeniami podstawowymi, w tym chłoniakiem i białaczką.U pacjentów po przeszczepieniu narządów stałych częstość występowania IA jest większa u pacjentów po przeszczepieniu płuc i wątroby (odpowiednio 2, 4% -6% i 1% -8%) niż u pacjentów po przeszczepieniu nerek i serca (odpowiednio 0, 1% -4% i 0, 3% -6%).Częstość występowania IA u biorców HSCT jest jeszcze wyższa. Allogeniczni biorcy HSCT mają częstość występowania IA od 2,3% do 11% , co jest ponad dwukrotnie większą niż obserwowana częstość występowania u autologicznych biorców HSCT (0,5% -4%).4 ogólny wskaźnik śmiertelności obliczono na 58%.7,8 jednakże wskaźniki śmiertelności w przypadku oceny oddziaływania różnią się w zależności od stanu podstawowego. W systematycznym przeglądzie 53 badań przeprowadzonych w latach 1995-1999 odsetek przypadków śmiertelnych u pacjentów z IA był najwyższy u pacjentów po przeszczepieniu szpiku kostnego w wywiadzie (86,7%) lub HIV/AIDS (85,7%) i najniższy u pacjentów z białaczką lub chłoniakiem (49,3%).7
patogeneza
po inhalacji fumigatus conidia (zarodników przenoszonych drogą powietrzną), komórki nabłonka dróg oddechowych i makrofagi pęcherzykowe wywołują wrodzoną odpowiedź immunologiczną przeciwko Wziewnemu Aspergillus conidia. Patogeny te następnie rozpoznają receptory na komórkach gospodarza, takie jak receptor beta-glukanu Dektyna-1. Interakcja między patogenami a receptorami wywołuje chemokiny i cytokiny oraz aktywuje i rekrutuje monocyty i neutrofile. Neutrofile przyłączają się do grzybicy i degranulatu, co prowadzi do zabijania grzybów. Atak ten jest pośredniczony przez oksydazę fosforanową dinukleotydu nikotynamidoadeninowego. W przypadku neutropenii neutrofile nie są dostępne do zabijania i kontroli wzrostu grzybów, więc rosnące strzępki mogą następnie rozprzestrzeniać się po wyściółce komórek śródbłonka.
objawy kliniczne
płuca są najczęstszym miejscem IA. W związku z tym objawy IA i objawy kliniczne są zazwyczaj płucne. W jednym z badań Lee i współpracownicy zaobserwowali objawy IA u 36 pacjentów i stwierdzili, że najczęstszym objawem klinicznym (72%) było krwioplucie, a następnie kaszel, duszność i zmęczenie.9 badacze zauważyli, że objawy IA wahały się od bezobjawowego do masywnego krwioplucia (czasami śmiertelnego), a częstość występowania objawów różniła się w zależności od układu odpornościowego pacjenta. Pacjenci z pewnym stopniem immunosupresji (np. AIDS, stosowanie kortykosteroidów, cukrzyca, alkoholizm) może wykazywać szybszy rozwój objawów (tj. tygodni, a nie miesięcy).10 W 6-letnim badaniu przeprowadzonym przez Cornillet i współpracowników gorączka była najczęstszym objawem klinicznym u pacjentów z IA, występującym u 85% pacjentów (n = 88); często występował również ból w klatce piersiowej.11 dodatkowe objawy to utrata masy ciała, poty i anoreksja.10
diagnoza
Hodowla tkanek jest obecnie złotym standardem w diagnostyce IA.Metoda ta nie tylko daje Aspergillus spp, ale dodatkowo definiuje możliwości terapeutyczne poprzez badanie wrażliwości. Jednak inwazyjność pozyskiwania tkanki sprawia, że hodowla jest mniej pożądana. W przypadku braku próbek tkanek, płukanie oskrzelowo-pęcherzykowe (BAL) płyn uzyskany z górnych i dolnych dróg oddechowych może służyć do ustalenia diagnozy IA.12 chociaż bal jest procedurą bezpieczną, ogólna czułość hodowli wykorzystujących próbki BAL jest stosunkowo niska (szacowana na 50%).13 pobieranie próbek krwi jest optymalnym nieinwazyjnym podejściem diagnostycznym dla IA.Pomimo tej nieinwazyjności, Aspergillus spp rzadko są izolowane z krwi za pomocą konwencjonalnych technik hodowli-stąd poleganie na próbkach tkanek w celu zapewnienia ostatecznej diagnozy IA.12 ponieważ wyniki uzyskane z kultur są stosunkowo powolne, aby uzyskać ogólne wyniki, IA jest dobrze ugruntowana do czasu, gdy kultura jest pozytywna. Wyzwania te doprowadziły do opracowania mniej inwazyjnych i szybszych metod diagnostycznych.
test galaktomannanu w surowicy jest szybkim testem zatwierdzonym do diagnozowania podejrzanych przypadków IA u pacjentów z nowotworami hematologicznymi lub HSCTs.13 Galaktomannan, polisacharyd uwalniany w płynach ustrojowych podczas wzrostu Aspergillusa, można wykryć w surowicy i próbkach BAL na kilka dni przed pojawieniem się klinicznych objawów.Wykrywanie w surowicy może ułatwić ustalenie konkretnej diagnozy, podczas gdy płyn BAL wydaje się mieć większą czułość, ale często jest trudniejszy do uzyskania.12,13 Meersseman i współpracownicy donosili, że czułość wykrywania galaktomannanu wynosiła 88% dla BAL w porównaniu z 42% dla surowicy, a swoistość galaktomannanu zarówno dla BAL, jak i surowicy wynosiła 86%.Dodatni wynik w surowicy może umożliwić rozpoczęcie stosowania leków przeciwgrzybiczych, podczas gdy wynik ujemny może potencjalnie zapobiec stosowaniu drogich i toksycznych leków przeciwgrzybiczych.Pomiar (1,3) – beta-D-glukanu we krwi może być również przydatny jako narzędzie przesiewowe dla IA. Chociaż test galaktomannanu jest specyficzny dla IA, test (1,3)-beta-D-glukanu może również wykrywać inne inwazyjne choroby grzybicze, w tym kandydozę, inne patogeny pleśni i Pneumocystis jiroveci.
Postępowanie
leczenie przeciwgrzybicze pozostaje podstawą leczenia IA.2 aby zapobiec powikłaniom i złym skutkom leczenia, należy natychmiast rozpocząć leczenie przeciwgrzybicze u pacjentów z wysokim ryzykiem IA.2 The Infectious Diseases Society of America (IDSA) zaleca stosowanie worykonazolu w pierwotnym leczeniu inwazyjnej aspergilozy płucnej, a także w innych objawach, takich jak aspergiloza infekcje zatok, aspergiloza ośrodkowego układu nerwowego i przewlekła nekrotyzująca aspergiloza płucna.2 jeśli leczenie pierwotne nie powiedzie się, jako leczenie ratunkowe można zastosować preparaty lipidowe amfoterycyny B (AMB), kaspofunginy i itrakonazolu.Wytyczne IDSA zalecają również stosowanie pozakonazolu w profilaktyce u pacjentów z neutropenią z mielodysplazją i białaczką, a także u allogenicznych biorców HSCT z chorobą przeszczep przeciwko gospodarzowi (GvHD).
leczenie empiryczne
worykonazol: randomizowane, nieoślepione badanie porównujące worykonazol z AMB wykazało, że 52, 8% pacjentów z worykonazolem odniosło sukces (całkowite lub częściowe ustąpienie zmian w radiologii).Grupa worykonazolu miała również wyższy wskaźnik przeżycia niż pacjenci z AMB (70,8% vs 57.9%) i mniej zdarzeń niepożądanych (343 zdarzenia w porównaniu do 421 zdarzeń; P = .02), co doprowadziło badaczy do wniosku, że worykonazol jest lepszy od AMB.W badaniu tym potwierdzono dawkowanie worykonazolu zalecane przez wytyczne IDSA (tabela 1).Profil działań niepożądanych worykonazolu obejmuje wrażliwość skóry z ekspozycją na bezpośrednie działanie promieni słonecznych, zaburzenia widzenia i hepatotoksyczność charakteryzującą się zwiększeniem stężenia bilirubiny w surowicy i aktywności enzymów wątrobowych.2
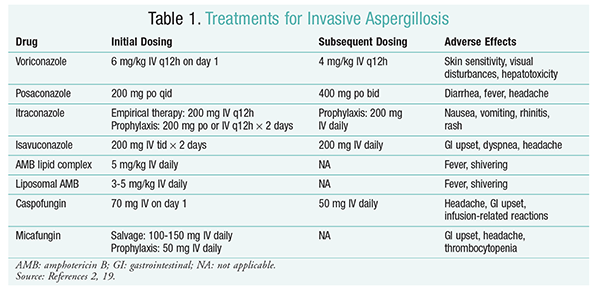
AMB: wcześniej deoksycholan AMB był standardem leczenia aspergilozy. Jednak reakcje związane z infuzją (w tym gorączka, dreszcze, bóle stawów, wymioty i skurcze oskrzeli) i nefrotoksyczność powodująca potencjalną niewydolność nerek spowodowały, że AMB wypada z pola widzenia.2 ponadto, azotemia może wystąpić, gdy dezoksycholan AMB jest podawany jednocześnie ze środkami nefrotoksycznymi (np. cyklosporyną lub takrolimusem).2 w rezultacie IDSA zaleca alternatywne preparaty złożone z lipidów, ponieważ częstość występowania działań niepożądanych jest niższa niż w przypadku preparatu dezoksycholanowego. Ponadto, w badaniu przeprowadzonym przez Walsha i współpracowników, w którym porównywano kompleks lipidowy AMB z kaspofunginą, wskaźniki sukcesu były podobne (33,7% dla AMB, 33,9% dla kaspofunginy); dlatego wytyczne dotyczące leczenia wymieniają zarówno kompleks lipidowy AMB, jak i kaspofunginę jako alternatywę dla worykonazolu.
Echinokandyny (Kaspofungina, Mykafungina, Anidulafungina): chociaż kaspofungina została zatwierdzona do leczenia IA, mykafungina i anidulafungina nie okazały się skuteczne w pierwotnym leczeniu IA i dlatego nie są zalecane przez IDSA.Kaspofungina może powodować bóle głowy, zaburzenia żołądkowo-jelitowe i możliwe reakcje związane z infuzją z powodu uwalniania histaminy.2
Isawukonazol: w marcu 2015 r. FDA zatwierdziła nowy triazol drugiej generacji dla IA. Isawukonazol, sprzedawany pod nazwą handlową Cresemba, jest dostępny w postaci roztworu doustnego i dożylnego i jest wskazany w leczeniu IA i mukormykozy.W porównaniu izawukonazolu i worykonazolu w badaniu SECURE stwierdzono, że nowy lek działał podobnie pod względem śmiertelności z dowolnej przyczyny i ogólnej odpowiedzi na leczenie pod koniec leczenia. Pierwszorzędowy punkt końcowy śmiertelności z dowolnej przyczyny do dnia 42 wynosił 19% dla izawukonazolu i 20% dla worykonazolu.Jednakże izawukonazol został uznany za nieinferior, ponieważ badacze zastosowali 10% margines nieinferiorności (CI – 7,8 do 5,7). U izawukonazolu wystąpiło mniej działań niepożądanych niż worykonazol, szczególnie dotyczących oczu, skóry i wątroby i dróg żółciowych.Wreszcie, izawukonazol ma wysoką biodostępność po podaniu doustnym, co daje stosunek 1: 1 w konwersji między preparatami dożylnymi i doustnymi.
leczenie ratunkowe
wytyczne IDSA nie zalecają leczenia skojarzonego w początkowym leczeniu IA. Zamiast tego terapia ratunkowa jest zalecana tylko wtedy, gdy nie ma odpowiedzi klinicznej na Leczenie początkowe. W związku z tym może to obejmować dodanie drugiego środka lub przejście na inny lek. Pozakonazol, itrakonazol, AMB i kaspofungina były badane pod kątem stosowania w leczeniu ratunkowym i są zalecane przez wytyczne IDSA. Walsh i współpracownicy badali skuteczność i bezpieczeństwo stosowania pozakonazolu w dawce 800 mg w zawiesinie na dobę u pacjentów, którzy nie tolerowali lub nie reagowali na początkowy lek przeciwgrzybiczy.Ogólny wskaźnik sukcesu wyniósł 42% w grupie leczonej pozakonazolem i 26% w grupie kontrolnej (P = .006).Badanie przeprowadzone przez Ng i Denninga wykazało 40% wskaźnik odpowiedzi, gdy AMB w postaci lipidów stosowano jako leczenie ratunkowe u pacjentów z IA, którzy byli oporni na leczenie lub nietolerancyjni wobec istniejącego leczenia.Kaspofunginę oceniano również jako leczenie ratunkowe w nieporównywalnym wieloośrodkowym badaniu z udziałem pacjentów opornych na leczenie konwencjonalne; korzystna odpowiedź wystąpiła u 44,6 % pacjentów.
profilaktyka
pozakonazol: wytyczne IDSA zalecają stosowanie pozakonazolu w profilaktyce IA. Zalecenie to opiera się na dwóch randomizowanych, kontrolowanych, wieloośrodkowych badaniach, w których oceniano profilaktyczne stosowanie pozakonazolu u pacjentów z neutropenią i GvHD.W pierwszym badaniu pozakonazol (3 × 200 mg/dobę) porównywano z flukonazolem (1 × 400 mg) lub itrakonazolem (2 × 200 mg). IA stwierdzono u 1% pacjentów w grupie leczonej pozakonazolem w porównaniu do 7% pacjentów w grupie leczonej flukonazolem i itrakonazolem (P <.001).W drugim badaniu porównywano pozakonazol z flukonazolem w profilaktyce u pacjentów z GvHD. IA występowała rzadziej w grupie leczonej pozakonazolem niż w grupie leczonej flukonazolem (1, 0% vs. 5, 9%; P = .001).25
Mykafungina: Chociaż nie zatwierdzono go do profilaktyki pierwszego rzutu IA, wytyczne IDSA zalecają stosowanie mykafunginy jako alternatywy dla pozakonazolu. Zalecenie to opiera się na randomizowanym, podwójnie ślepym badaniu III fazy z udziałem 882 pacjentów, którzy otrzymywali mykafunginę w dawce 50 mg IV. (1 mg/kg mc. u pacjentów <50 kg mc.) w porównaniu z flukonazolem w dawce 400 mg (8 mg/kg mc. u pacjentów <50 kg mc.). Skuteczność definiowano jako brak udowodnionego, prawdopodobnego lub podejrzewanego ogólnoustrojowego zakażenia grzybiczego. W fazie neutropenii ogólna skuteczność mykafunginy była większa niż flukonazolu (80% w grupie otrzymującej mykafunginę w porównaniu do 73.5% dla grupy leczonej flukonazolem; 95% CI, 0, 9% -12%; P = .03).
wniosek
IA jest ciężkim zakażeniem grzybiczym występującym najczęściej u pacjentów z obniżoną odpornością. W diagnostyce, leczeniu i zapobieganiu aspergilozie należy zająć się kilkoma pytaniami. Kryteria diagnostyczne są słabo zdefiniowane, co sprawia, że diagnoza IA jest trudna. Ze względu na wysokie ryzyko śmiertelności leczenie przeciwgrzybicze musi być rozpoczęte szybko i prawidłowo, aby było skuteczne. Istnieją krytyczne luki dotyczące stosowania terapii skojarzonej, narzędzi do wczesnego wykrywania oraz populacji pacjentów, u których profilaktyka byłaby najbardziej korzystna.2 dlatego ważne jest, aby farmaceuci mieli wiedzę na temat właściwości każdego środka przeciwgrzybiczego, aby być najlepiej przygotowanym do podejmowania rozsądnych decyzji terapeutycznych w leczeniu IA. Rzeczywiście, biorąc pod uwagę zwiększone ryzyko oporności przeciwgrzybiczej, farmaceuci mogą odgrywać ważną rolę w zarządzaniu IA, pomagając w minimalizacji i zarządzaniu niekorzystnymi skutkami, opracowując odpowiednie zalecenia dotyczące dawkowania i monitorując wybór odpowiednich środków przeciwgrzybiczych—z których wszystkie mają kluczowe znaczenie dla optymalizacji terapii dla IA.
1. Denning DW. Inwazyjna aspergiloza. Clin Infect Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Leczenie aspergilozy: wytyczne praktyki klinicznej Infectious Diseases Society of America. Clin Infect Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Aspergiloza płucna: przegląd kliniczny. Eur Respir Rev. 2011;20: 156-174.
4. Barnes PD, Marr KA. Aspergiloza: spektrum choroby, diagnoza, i leczenie. Zarazić Dis Clin North Am. 2006; 20: 545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. inwazyjna aspergiloza na oddziale intensywnej terapii. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian a, Mohajer B, et al. Podejście statystyczne w konektomie ludzkiego mózgu choroby Parkinsona u osób starszych z wykorzystaniem statystyk opartych na sieci. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergilosis case-fatality rate: systematic review of the literature. Clin Infect Dis. 2001;32:358-366.
8. Dagenais TR, Keller np. Patogeneza Aspergillus fumigatus w inwazyjnej aspergilozie. Clin Microbiol Rev. 2009;22: 447-465.
9. Lee SH, Lee BJ, Jung DY i in. Objawy kliniczne i wyniki leczenia aspergilloma płuc. Korean J Intern Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Spektrum kliniczne aspergilozy płucnej. Klatka piersiowa. 2015;70:270-277.
11. Cornillet a, Camus C, Nimubona s, et al. Porównanie epidemiologicznych, klinicznych i biologicznych cech inwazyjnej aspergilozy u pacjentów z neutropenią i nienieutropenią: badanie trwające 6 lat. Clin Infect Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Aspergillus galactomannan enzyme immunoassay i ilościowego PCR w diagnostyce inwazyjnej aspergilozy z płukania oskrzelowo-pęcherzykowego płynu. J Clin Microbiol. 2004;42:5517-5522.
13. Wheat LJ, Walsh TJ. Diagnostyka inwazyjnej aspergilozy poprzez wykrywanie antygenemii galaktomannanowej za pomocą enzymatycznego testu immunologicznego. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et al. Inwazyjna aspergiloza u pacjentów w stanie krytycznym bez nowotworu złośliwego. Am J Respir Crit Care Med. 2004;170:621-625.
15. Sherif R, Segal BH. Aspergiloza płucna: prezentacja kliniczna, testy diagnostyczne, postępowanie i powikłania. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Worykonazol w porównaniu z amfoterycyną B w leczeniu pierwotnym inwazyjnej aspergilozy. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR, et al. Kaspofungina w porównaniu z liposomalną amfoterycyną B w empirycznym leczeniu przeciwgrzybiczym u pacjentów z utrzymującą się gorączką i neutropenią. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Mykafungina (FK463), sama lub w skojarzeniu z innymi układowymi lekami przeciwgrzybiczymi, do leczenia ostrej inwazyjnej aspergilozy. Zarazić J. 2006;53:337-349.
19. Pettit NN, Carver PL. Izawukonazol: nowa opcja w leczeniu inwazyjnych zakażeń grzybiczych. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Izawukonazol w porównaniu z worykonazolem w pierwotnym leczeniu inwazyjnej pleśni wywołanej przez Aspergillus i inne grzyby nitkowate (SECURE): badanie III fazy, randomizowane, kontrolowane, o równoważności. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et al. Leczenie inwazyjnej aspergilozy pozakonazolem u pacjentów opornych na konwencjonalne leczenie lub nietolerujących konwencjonalnego leczenia: badanie kontrolowane zewnętrznie. Clin Infect Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Liposomalna terapia amfoterycyną B (AmBisome) w inwazyjnych zakażeniach grzybiczych. Ocena danych dotyczących korzystania ze współczucia w Wielkiej Brytanii. Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Skuteczność i bezpieczeństwo stosowania kaspofunginy w leczeniu inwazyjnej aspergilozy u pacjentów opornych lub nietolerujących konwencjonalnego leczenia przeciwgrzybiczego. Clin Infect Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et al. Pozakonazol vs. flukonazol lub itrakonazol profilaktyka u pacjentów z neutropenią. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.