米国Pharm。 2016;41(4):HS15-HS20.
要約:侵襲性アスペルギルス症(IA)は、免疫不全患者に一般的に影響を及ぼす稀で重篤な真菌感染症である。 IAの正確な発生率は文書化されておらず、報告されている発生率は大きく異なる。 IAのためのある典型的な危険率はhematopoietic幹細胞の移植、長期副腎皮質ホルモン療法、hematologic敵意およびHIVを含んでいます。 肺はIAの最も頻繁な部位であり、その結果、症状および臨床症状は典型的には肺である。 死亡のリスクが高いため、適切なエージェントとのIA管理はできるだけ早く開始する必要があります。 Voriconazoleはアメリカの指針の感染症の社会によって推薦される第一線の経験的療法です;臨床応答がなければ、他のアゾール、echinocandins、またはamphotericin Bの脂質の公式との救助療法
アスペルギルス症は、アスペルギルスによって引き起こされる真菌感染症であり、植生を分解する際に最も頻繁に見られるユビキタスカビ種(spp)の大1免疫不全の人で最も一般的に観察されるアスペルギルス症は、この集団における罹患率および死亡率の有意な原因であり、死亡率は90%と高い。2,3アレルギー性気管支肺アスペルギルス症、アレルギー性アスペルギルス副鼻腔炎、アスペルギローマ、慢性肺アスペルギルス症、皮膚アスペルギルス症、および侵襲性アスペルギルス症(IA)を含むいくつかのタイプのアスペルギルス症感染が存在する。 これらの感染症のほとんどは、Aspergillus fumigatusによって引き起こされ、Aspergillus flavus、Aspergillus niger、Aspergillus terreusが続きます。4-6IAは、特に、最も重度のアスペルギルス症感染症の一つであり、高い死亡率を有する。5
病因と疫学
IAの一般的な危険因子には、造血幹細胞移植(HSCT)、長期および重度の好中球減少症、血液悪性腫瘍、長期コルチコステロイド療法、HIVが含まれる。 しかし、慢性閉塞性肺疾患、重度の肝疾患、または一時的に免疫系を破壊する重大な病気を有する患者のような特定のICU免疫担当者集団もまた、IAのリ5典型的なICUにおけるIAの発生率は0.33%から6.9%であることが報告されており、これは固形臓器移植患者の発生率に匹敵する。4,5
アスペルギルス症は珍しく、公衆衛生への深刻な脅威とは考えられていないため、米国では報告可能な感染症ではありません。その結果、IAの正確な発生率は文書化されていない。 さらに、報告された発生率は大幅に変化する可能性があり、地理学が役割を果たす可能性があることを示唆している。4移植レシピエントの間で、iaの発生率はリンパ腫および白血病を含む共通の根本的な条件と、変わります。7固形臓器移植レシピエントのうち、IAの発生率は、肺および肝臓移植レシピエント(それぞれ2.4%-6%および1%-8%)で、腎臓および心臓移植レシピエント(それぞれ0.1%-4%および0.3%-6%)よりも高い。4HSCTレシピエントにおけるIAの発生率はさらに高い。 同種HSCTレシピエントは、自己HSCTレシピエント(0.5%-4%)で観察された発生率の倍以上である2.3%から11%のIA発生率を持っています。4全体的な症例死亡率は58%と計算されています。7,8しかし、IAの症例死亡率は、基礎となる状態に応じて変化する。 1995年から1999年までの53件の研究の系統的レビューでは、IA患者の症例死亡率は、骨髄移植(86.7%)またはHIV/AIDS(85.7%)の病歴を有する患者で最も高く、白血病またはリンパ腫(49.3%)の患者で最も低かった。7
病因
fumigatus分生子(空中胞子)の吸入後、呼吸上皮細胞および肺胞マクロファージは、吸入したAspergillus分生子に対する自然免疫応答を誘発する。 これらの病原体は、β-グルカン受容体Dectin-1などの宿主細胞上の受容体を認識する。 病原体と受容体との間の相互作用は、ケモカインおよびサイトカインを誘発し、単球および好中球を活性化および新兵する。 好中球は真菌の菌糸に付着し、脱顆粒し、真菌の死滅をもたらす。 この攻撃はニコチンアミドアデニンジヌクレオチドリン酸オキシダーゼによって媒介される。 好中球減少症の場合、好中球は菌糸の死滅および真菌の増殖の制御には利用できないため、増殖する菌糸は内皮細胞内層全体に広がる可能性がある。8
臨床症状
肺はIAの最も一般的な部位です。 その結果、I A症状および臨床症状は、典型的には肺である。 ある研究で、Leeたちは、36人の患者でIA症状を観察し、喀血が最も一般的な臨床症状(72%)であり、咳、息切れ、疲労が続いていることを見出した。研究者らは、IAの症状は無症候性から大量の喀血(時には致命的)までの範囲であり、症状の発症率は患者の免疫系に基づいて変化したことに留意した。 ある程度の免疫抑制を有する患者(例えば、、エイズ、コルチコステロイドの使用、糖尿病、アルコール依存症)は徴候のより急速な開発と示すかもしれません(すなわち、週よりもむしろ月)。10Cornilletらが実施した6年間の調査では、発熱はIA患者で最も一般的な臨床徴候であり、患者の85%(n=88)に現れた。11追加の症状には、体重減少、汗、および食欲不振が含まれます。10
診断
組織の培養は現在、IAの診断のための金本位です。11この方法はAspergillus sppをもたらすだけでなく、感受性試験を介して治療の選択肢をさらに定義します。 しかし、組織を得る侵襲性は、培養をより望ましくないものにする。 組織標本が存在しない場合、上気道および下気道から得られた気管支肺胞洗浄(BAL)流体は、IAの診断を確立するのに役立ち得る。12BALは安全な手順ですが、BAL試料を用いた培養の全体的な感度は比較的低い50%と推定されます。13血液サンプリングは、IAのための最適な非侵襲的診断アプローチです。12しかし、この非侵襲性にもかかわらず、アスペルギルス属は、従来の培養技術によって血液から単離されることはほとんどないため、IAの確定診断を確培養物からの結果は全体的に得るのが比較的遅いので、培養物が陽性である時までにI Aは十分に確立される。 これらの課題は、より侵襲性が低く、より迅速な診断方法の開発をもたらした。
血清ガラクトマンナンアッセイは、血液悪性腫瘍またはHSCTs患者におけるIAの疑いのある症例を診断するために承認された迅速な試験です。13ガラクトマンナン、アスペルギルスの成長の間に体液で解放される多糖類は臨床印および徴候が現われる数日前に血清およびBALの標本で検出するこ13血清検出は、特定の診断の確立を容易にすることができるが、BAL液はより高い感度を有するように見えるが、多くの場合、得ることが困難である。今回、12,13Meerssemanらは、ガラクトマンナンの検出感度がbalでは88%、血清では42%であり、balと血清の両方でガラクトマンナンの特異性が86%であったことを報告した。陽性の血清結果は、抗真菌剤の開始を可能にすることができるが、陰性結果は、高価で毒性のある抗真菌剤の使用を潜在的に防止することができる。12血液中の(1,3)-β-D-グルカンの測定は、IAのスクリーニングツールとしても有用であり得る。 Galactomannanの試金がIAのために特定であるが、(1,3)ベータDグルカンの試金はまたカンジダ症、他の型の病原体およびPneumocystis jiroveciを含む他の侵略的な菌類の病気を、検出で15
経験的治療
ボリコナゾール:ボリコナゾールとAMBを比較した無作為化非盲検試験では、ボリコナゾール患者の52.8%が成功した転帰(放射線学上の病変の完16ボリコナゾール群はまた、AMB患者よりも高い生存率を有していた(70.8%対57。9%)および有害事象が少ない(343事象対421事象;P=。02)、ボリコナゾールがAMBより優秀であることを結論する一流の調査官。16IDSAガイドライン(表1)によって推奨されるボリコナゾール投与量は、この試験で支持された。2ボリコナゾールは、直射日光への暴露による皮膚感受性、視覚障害、および血清ビリルビンおよび肝臓酵素の増加を特徴とする肝毒性を含む有害2
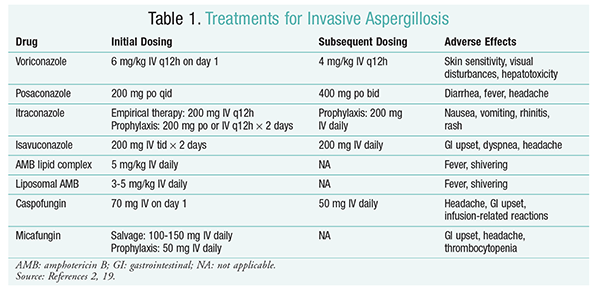
AMB:以前は、AMBデオキシコール酸はアスペルギルス症のケアの標準でした。 しかし、輸液に関連する反応(発熱、厳しさ、関節痛、嘔吐、気管支痙攣を含む)および腎毒性が起こり、腎不全の可能性があるため、AMBは支持を得られません。2さらに、ambデオキシコール酸が腎毒性剤(例えば、シクロスポリンまたはタクロリムス)と共投与されると、高窒素血症が起こることがある。その結果、副作用の発生率がデオキシコール酸製剤の発生率よりも低いため、IDSAは代替として脂質複合製剤を推奨している。 さらに、Walshらによる試験では、AMB脂質複合体とカスポファンギンを比較したが、成功率は類似していた(AMBでは33.7%、カスポファンギンでは33.9%);したがって、治療ガイ17
エキノカンジン(カスポファンギン、ミカフンギン、アニドゥラファンギン):カスポファンギンはIA療法のために承認されているが、ミカフンギンとアニドゥラファンギンはIAの一次治療において有効であることが証明されておらず、したがってIDSAによって推奨されていない。18カスポファンギンは、ヒスタミン放出のために頭痛、胃腸の不調、および輸液関連の反応の可能性がある。2
イサブコナゾール:2015年、FDAはIAのための新しい第二世代トリアゾールを承認しました。 商品名のCresembaの下で販売されて、isavuconazoleは口頭およびIV解決で利用でき、IAおよびmucormycosisの処置のために示されます。19イサブコナゾールとボリコナゾールの比較では、安全な研究では、新規薬剤が全原因死亡率および治療終了時の全体的な応答に関して同様に実行されたことが決定された。 42日目までの全原因死亡率の主要エンドポイントは、イサブコナゾールで19%、ボリコナゾールで20%であった。しかし、研究者が10%の非劣性マージンを使用したため、イサブコナゾールは非劣性とみなされた(CI-7.8〜5.7)。 イサブコナゾールはボリコナゾールよりも有害事象が少なく,特に眼,皮膚,肝胆道系を含む事象が多かった。最後に、isavuconazoleにIVと口頭公式間の転換の1:1の比率をもたらす高い口頭生物学的利用能があります。
サルベージ療法
IDSAガイドラインでは、IAの初期治療に対する併用療法は推奨されていません。 代わりに、サルベージ療法は、最初の治療に対する臨床的反応がない場合にのみ推奨される。 その結果、これは第2の薬剤を加えるか、または別の薬物に転換することを含むかもしれません。 Posaconazole、itraconazole、AMBおよびcaspofunginは救助療法として使用のために調査され、IDSAの指針によって推薦されます。 Walshたちは、最初の抗真菌剤に不耐性または無反応の患者を対象に、ポサコナゾール800mg懸濁液の有効性と安全性を1日1回調査した。21全体の成功率は、ポサコナゾール群で42%、対照群で26%であった(P=。006).NgとDenningによる研究では、既存の治療法に対して不応性または不耐性のIA患者において、脂質ベースのAMB製剤をサルベージ療法として使用した場合、40%の奏効率22カスポファンギンはまた、従来の治療に難治性であった患者の非比較多施設研究におけるサルベージ療法として検討された;良好な応答は、患者の44.6%23
予防
ポサコナゾール:IDSAガイドラインでは、IAの予防にポサコナゾールの使用を推奨しています。 この勧告は、好中球減少症およびGvHD患者におけるポサコナゾールの予防的使用を評価した二つの無作為化、対照、多施設試験に基づいています。24,25最初の試験は、ポサコナゾール(3×200mg/日)をフルコナゾール(1×400mg)またはイトラコナゾール(2×200mg)と比較した。 IAは、ポサコナゾール群の患者の1%に対して、フルコナゾールおよびイトラコナゾール群の患者の7%で報告された(P<。001).26第二の研究では、GvHD患者の予防のためにポサコナゾールとフルコナゾールを比較した。 IAは、フルコナゾール群よりもポサコナゾール群では頻度が低かった(1.0%対5.9%;P=。001).25
ミカフンギン: IAの第一線の予防法のために承認されないが、IDSAの指針はポサコナゾールに代わりとしてmicafunginを推薦します。 この勧告は、ミカフンギン50mg IV(患者で1mg/kg<50kg)対フルコナゾール400mg(患者で8mg/kg<50kg)を受けた882人の患者の無作為化、二重盲検、第III相試験に基づ 有効性は、証明された、可能性のある、または疑われる全身性真菌感染の欠如として定義された。 好中球減少期の間に、ミカフンギンの全体的な有効性は、フルコナゾールのそれよりも優れていた(ミカフンギン群の80%対73。フルコナゾール群では5%、95%CI、0.9%-12%、P=。03).27
結論
IAは、免疫不全患者で最も一般的に発生する重度の真菌感染症です。 アスペルギルス症の診断、治療、および予防には、いくつかの質問に対処する必要があります。 診断基準は不十分に定義されており、IAの診断は困難である。 死亡の危険性が高いため、抗真菌療法は効果的であるために迅速かつ正確に開始されなければならない。 併用療法の使用、早期発見のためのツール、および予防が最も有益である患者集団に関しては、重大なギャップが存在する。2したがって、薬剤師は、IAの治療において健全な治療上の決定を下すために最高の装備をするために、各抗真菌剤の特性について知識があることが 確かに、抗真菌抵抗性のリスクの増加を考えると、薬剤師は、副作用の最小化と管理を支援し、適切な投薬勧告を行い、適切な抗真菌剤の選択を監視するこ
1. デニングDW. 侵襲性アスペルギルス症。 クリニークDis. 1998;26:781-803.
2. Walsh TJ,Anaissie EJ,Denning DW,et al. アスペルギルス症の治療:アメリカ感染症学会の臨床実践ガイドライン。 クリニークDis. 2008;46:327-360.
3. Kousha M、Tadi R、Soubani AO。 肺アスペルギルス症:臨床レビュー。 Eur Respir Rev.2011;20:156-174。
4. バーンズ警察マー-カー アスペルギルス症:疾患、診断、および治療のスペクトル。 ディスクリンノースアムに感染します。 2006;20:545-561,vi.
5. Dimopoulos G、Frantzeskaki F、Poulakou G、Armaganidis a.集中治療室における侵襲性アスペルギルス症。 Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH,Kamalian A,Mohajer B,et al. ネットワークベースの統計を用いた高齢者におけるパーキンソン病のヒト脳コネクトームにおける統計的アプローチ。 コンフ-プロックIeee Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ,Schranz J,Teutsch SM. アスペルギルス症症例-死亡率:文献の系統的レビュー。 クリニークDis. 2001;32:358-366.
8. Dagenais TR,Keller NP. 侵襲性アスペルギルス症におけるアスペルギルス-フミガトゥスの病因。 Clin Microbiol Rev.2009;22:447-465.
9. Lee SH,Lee BJ,Jung DY,et al. 肺アスペルギローマの臨床症状および治療成績。 韓国のJインターンMed. 2004;19:38-42.
10. コスミディスC、デニングDW。 肺アスペルギルス症の臨床スペクトル。 胸郭 2015;70:270-277.
11. Cornillet A,Camus C,Nimubona S,et al. 好中球減少症および非神経減少症患者における侵襲性アスペルギルス症の疫学的、臨床的、および生物学的特徴の比較:6年間の調査。 クリニークDis. 2006;43:577-584.
12. Musher B,Fredricks D,Leisenring W,et al. 気管支肺胞洗浄液による侵襲性アスペルギルス症の診断のためのAspergillus galactomannan酵素免疫学的検定および定量的PCR。 Jクリン-ミクロビオール… 2004;42:5517-5522.
13. 小麦LJ、ウォルシュTJ。 酵素イムノアッセイを用いたガラクトマンナン抗原血症検出による侵襲性アスペルギルス症の診断。 ユーロ-J-クリニーク-ミクロビオルスコーニ-ディス… 2008;27:245-251.
14. Meersseman W,Vandecasteele SJ,Wilmer A,et al. 悪性腫瘍のない重症患者における侵襲性アスペルギルス症。 Am J Respir CritケアMed. 2004;170:621-625.
15. シェリフR、シーガルBH。 肺アスペルギルス症:臨床的提示、診断検査、管理および合併症。 カー-オピン-プルムMed. 2010:16:242-250.
16. Herbrecht R,Denning DW,Patterson TF,et al. 侵略的なアスペルギルス症の第一次療法のためのvoriconazole対amphotericin B。 N Engl J Med. 2002;347:408-415.
17. Walsh TJ,Teppler H,Donowitz GR,et al. 永続的な発熱および好中球減少症患者における経験的抗真菌療法のためのカスポファンギン対リポソームアンホテリシンB。 N Engl J Med. 2004;351:1391-1402.
18. Denning DW,Marr KA,Lau WM,et al. 単独でまたは激しく侵略的なアスペルギルス症の処置のための他の全身のantifungal代理店を伴ってMicafungin(FK463)、。 ジャニーズ事務所所属。 2006;53:337-349.
19. Pettit NN,Carver PL. イサブコナゾール: 侵襲性真菌感染症の管理のための新しいオプション。 “アン-ファーマシー” 2015;49:825-842.
20. Maertens JA,Raad II,Marr KA,et al. アスペルギルスおよび他の糸状菌によって引き起こされる侵略的な型の病気の第一次処置のためのvoriconazole対Isavuconazole(安全な):段階3、無作為化制御された、非劣等試験。 ランセット 2016;387:760-769.
21. Walsh TJ,Raad I,Patterson TF,et al. 従来の治療法に難治性または不耐性の患者におけるポサコナゾールによる侵襲性アスペルギルス症の治療:外部対照試験。 クリニークDis. 2007;44:2-12.
22. Ng TT、デニングDW。 侵略的な菌類伝染のLiposomal amphotericin B(AmBisome)療法。 英国のデータの評価。 アーチインターンメッド. 1995;155:1093-1098.
23. Maertens J,Raad I,Petrikkos G,et al. 従来の抗真菌療法に不応性または不耐性の患者における侵襲性アスペルギルス症の治療のためのカスポファンギンの有効性および安全性。 クリニークDis. 2004;39:1563-1571.
24. Cornely OA,Maertens J,Winston DJ,et al. 好中球減少症患者におけるポサコナゾール対フルコナゾールまたはイトラコナゾール予防。 N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.