US Pharm. 2016; 41(4):HS15-HS20.
ABSTRACT: L’aspergillosi invasiva (IA) è un’infezione fungina rara e grave che colpisce comunemente pazienti immunocompromessi. L’incidenza precisa di IA non è stata documentata e i tassi di incidenza segnalati variano ampiamente. Alcuni fattori di rischio tipici per IA includono trapianti di cellule staminali ematopoietiche, terapia corticosteroidea a lungo termine, neoplasie ematologiche e HIV. I polmoni sono il sito più frequente di IA; di conseguenza, i sintomi e le manifestazioni cliniche sono tipicamente polmonari. A causa dell’elevato rischio di mortalità, la gestione IA con gli agenti appropriati deve iniziare il più rapidamente possibile. Il voriconazolo è la terapia empirica di prima linea raccomandata dalle linee guida della Infectious Diseases Society of America; se non vi è alcuna risposta clinica, deve essere somministrata una terapia di salvataggio con altri azoli, echinocandine o formulazioni lipidiche di amfotericina B.
L’aspergillosi è un’infezione fungina causata da Aspergillus, che comprende un ampio gruppo di specie di muffe onnipresenti (spp) che si trovano più frequentemente nella vegetazione in decomposizione.1 L’aspergillosi, che è più comunemente osservata nelle persone immunocompromesse, è una causa significativa di morbilità e mortalità in questa popolazione, con tassi di mortalità fino al 90%.2,3 Esistono diversi tipi di infezioni da aspergillosi, tra cui aspergillosi broncopolmonare allergica, sinusite allergica aspergillus, aspergilloma, aspergillosi polmonare cronica, aspergillosi cutanea e aspergillosi invasiva (IA). La maggior parte di queste infezioni sono causate da Aspergillus fumigatus, seguito da Aspergillus flavus, Aspergillus niger e Aspergillus terreus.4-6 IA, in particolare, è una delle infezioni da aspergillosi più gravi e ha un alto tasso di mortalità.5
Eziologia ed epidemiologia
I fattori di rischio comuni per IA includono trapianto di cellule staminali ematopoietiche (HSCT), neutropenia prolungata e grave, neoplasie ematologiche, terapia corticosteroidea a lungo termine e HIV. Tuttavia, alcune popolazioni ICU-immunocompetenti, come i pazienti con malattia polmonare ostruttiva cronica, grave malattia del fegato o malattie critiche che interrompono temporaneamente il sistema immunitario, sono anche ad aumentato rischio di IA.5 L ‘incidenza di IA in una terapia intensiva tipica è stata riportata tra lo 0,33% e il 6,9%, che è paragonabile all’ incidenza nei pazienti sottoposti a trapianto di organi solidi.4,5
L’aspergillosi non è un’infezione segnalabile negli Stati Uniti perché è rara e non considerata una seria minaccia per la salute pubblica.6 Di conseguenza, l’incidenza esatta di IA non è stata documentata. Inoltre, i tassi di incidenza riportati possono variare in modo sostanziale, suggerendo che la geografia può svolgere un ruolo.4 Tra i destinatari del trapianto, l’incidenza di IA varia, con condizioni di base comuni tra cui linfoma e leucemia.7 Tra i pazienti sottoposti a trapianto di organi solidi, l ‘ incidenza di IA è più elevata nei pazienti sottoposti a trapianto di polmoni e fegato (2,4% -6% e 1% -8%, rispettivamente) che nei pazienti sottoposti a trapianto di rene e cuore (0,1% -4% e 0,3% -6%, rispettivamente).4 L’incidenza di IA nei pazienti trattati con HSCT è ancora più elevata. I riceventi di HSCT allogenico hanno un’incidenza IA del 2,3% – 11%, che è più del doppio del tasso di incidenza osservato nei riceventi autologi di HSCT (0,5% -4%).4 Il tasso di mortalità totale è stato calcolato pari al 58%.7,8 Tuttavia, i tassi di mortalità dei casi di IA variano a seconda della condizione sottostante. In una revisione sistematica di 53 studi dal 1995 al 1999, il tasso di mortalità nei pazienti con IA era più alto nei pazienti con una storia di trapianti di midollo osseo (86,7%) o HIV/AIDS (85,7%) e più basso nei pazienti con leucemia o linfoma (49,3%).7
Patogenesi
In seguito all’inalazione di un fumigatus conidia (spore disperse nell’aria), le cellule epiteliali respiratorie e i macrofagi alveolari innescano risposte immunitarie innate contro l’Aspergillus conidia inalato. Questi agenti patogeni quindi riconoscono i recettori sulle cellule ospiti, come il recettore beta-glucano Dectin-1. L’interazione tra agenti patogeni e recettori provoca chemochine e citochine e attiva e recluta monociti e neutrofili. I neutrofili si attaccano alleph fungine e degranulano, causando l’uccisione di funghi. Questo attacco è mediato dalla nicotinamide adenina dinucleotide fosfato ossidasi. Nel caso della neutropenia, i neutrofili non sono disponibili per l’uccisione delleph e il controllo della crescita fungina, quindi le growing crescenti possono diffondersi in tutto il rivestimento delle cellule endoteliali.8
Manifestazioni cliniche
I polmoni sono il sito più comune di IA. Di conseguenza, i sintomi IA e le manifestazioni cliniche sono tipicamente polmonari. In uno studio, Lee e colleghi hanno osservato i sintomi IA in 36 pazienti e hanno scoperto che l’emottisi era la manifestazione clinica più comune (72%), seguita da tosse, mancanza di respiro e affaticamento.9 I ricercatori hanno notato che i sintomi della IA variavano da asintomatici a emottisi massiva (a volte fatale) e il tasso di insorgenza dei sintomi variava in base al sistema immunitario del paziente. Pazienti con un certo grado di immunosoppressione (ad es., AIDS, uso del corticosteroide, diabete mellito, alcolismo) può presentare con lo sviluppo più rapido dei sintomi (cioè, settimane piuttosto che mesi).10 In un sondaggio di 6 anni condotto da Cornillet e colleghi, la febbre era il segno clinico più comune nei pazienti IA, presentandosi nell ‘ 85% dei pazienti (n = 88); anche il dolore toracico era comune.11 Ulteriori sintomi includono perdita di peso, sudorazione e anoressia.10
Diagnosi
La coltura del tessuto è attualmente il gold standard per la diagnosi di IA.11 Questo metodo non solo produce Aspergillus spp, ma definisce ulteriormente le opzioni terapeutiche tramite test di suscettibilità. Tuttavia, l’invasività dell’ottenimento del tessuto rende meno desiderabile la coltura. In assenza di campioni di tessuto, il liquido di lavaggio broncoalveolare (BAL) ottenuto dalle vie respiratorie superiori e inferiori può servire a stabilire la diagnosi di IA.12 Sebbene il BAL sia una procedura sicura, la sensibilità complessiva della coltura che utilizza campioni di BAL è relativamente bassa (stimata al 50%).13 Il prelievo di sangue è l’approccio diagnostico non invasivo ottimale per IA.12 Nonostante questa non invasività, tuttavia, gli Aspergillus spp sono raramente isolati dal sangue attraverso tecniche di coltura convenzionali-da qui la dipendenza da campioni di tessuto per garantire una diagnosi definitiva di IA.12 Poiché i risultati delle culture sono relativamente lenti da ottenere nel complesso, la IA è ben stabilita nel momento in cui la cultura è positiva. Queste sfide hanno portato allo sviluppo di metodi diagnostici meno invasivi e più rapidi.
Il test del galattomannano sierico è un test rapido approvato per diagnosticare casi sospetti di IA in pazienti con neoplasie ematologiche o HSCTS.13 Galattomannano, un polisaccaride rilasciato nei fluidi corporei durante la crescita di Aspergillus, può essere rilevato in campioni di siero e BAL diversi giorni prima che compaiano segni e sintomi clinici.13 Il rilevamento del siero può facilitare la definizione di una diagnosi specifica, mentre il fluido BAL sembra avere una sensibilità più elevata ma è spesso più difficile da ottenere.12,13 Meersseman e colleghi hanno riferito che la sensibilità del rilevamento del galattomannano è stata dell ‘88% per il BAL rispetto al 42% per il siero e la specificità del galattomannano sia per il BAL che per il siero è stata dell’ 86%.14 Un risultato positivo del siero può consentire l’inizio di agenti antifungini, mentre un risultato negativo può potenzialmente impedire l’uso di farmaci antifungini costosi e tossici.12 La misurazione di (1,3)-beta-D-glucano nel sangue può anche essere utile come strumento di screening per IA. Sebbene il test galattomannano sia specifico per IA, il test (1,3)-beta-D-glucano può anche rilevare altre malattie fungine invasive, tra cui candidosi, altri agenti patogeni della muffa e Pneumocystis jiroveci.15
Gestione
Il trattamento antifungino rimane il pilastro del trattamento di IA.2 Al fine di prevenire complicazioni e scarsi risultati, il trattamento antifungino deve essere iniziato immediatamente nei pazienti ad alto rischio di IA.2 La Infectious Diseases Society of America (IDSA) raccomanda l’uso di voriconazolo per il trattamento primario dell’aspergillosi polmonare invasiva, nonché per altre manifestazioni, come le infezioni da aspergillosi dei seni, l’aspergillosi del sistema nervoso centrale e l’aspergillosi polmonare necrotizzante cronica.2 Se il trattamento primario fallisce, le formulazioni lipidiche di amfotericina B (AMB), caspofungin e itraconazolo possono essere utilizzate come terapia di salvataggio.2 Le linee guida IDSA raccomandano anche l’uso di posaconazolo per la profilassi in pazienti neutropenici con mielodisplasia e leucemia, nonché in pazienti trattati con HSCT allogenico con malattia da trapianto contro ospite (GvHD).2
Trattamento empirico
Voriconazolo: uno studio randomizzato, non in cieco, che ha confrontato voriconazolo con AMB ha rilevato che il 52,8% dei pazienti con voriconazolo ha avuto esiti positivi (risoluzione completa o parziale delle lesioni in radiologia).Il gruppo trattato con voriconazolo aveva anche un tasso di sopravvivenza più elevato rispetto ai pazienti affetti da AMB (70,8% vs. 57.9%) e meno eventi avversi (343 eventi contro 421 eventi; P = .02), portando i ricercatori a concludere che voriconazolo è superiore a AMB.Il dosaggio di voriconazolo raccomandato dalle linee guida IDSA (TABELLA 1) è stato supportato in questo studio.2 Voriconazolo ha un profilo di effetto avverso che include sensibilità cutanea con esposizione alla luce solare diretta, disturbi visivi ed epatotossicità caratterizzata da un aumento della bilirubina sierica e degli enzimi epatici.2
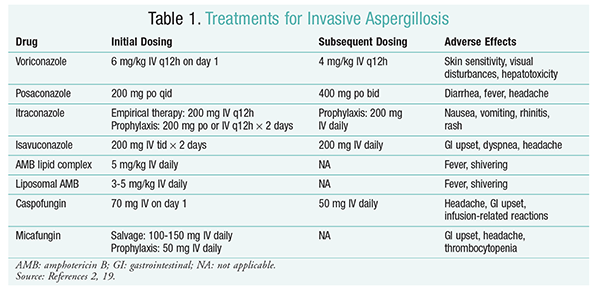
AMB: In precedenza, AMB deossicolato era lo standard di cura per l’aspergillosi. Tuttavia, reazioni correlate all’infusione (tra cui febbre, rigidità, artralgie, vomito e broncospasmi) e nefrotossicità con conseguente potenziale insufficienza renale hanno causato la caduta di AMB in disgrazia.2 Inoltre, l’azotemia può verificarsi quando AMB deossicolato è co-somministrato con agenti nefrotossici (ad esempio, ciclosporina o tacrolimus).2 Di conseguenza, l’IDSA raccomanda formulazioni complesse lipidiche come alternativa, poiché l’incidenza di effetti avversi è inferiore a quella della formulazione di desossicolato. Inoltre, in uno studio condotto da Walsh e colleghi che ha confrontato AMB lipid complex con caspofungin, i tassi di successo sono stati simili (33,7% per AMB, 33,9% per caspofungin); pertanto, le linee guida di trattamento elencano sia AMB lipid complex che caspofungin come alternative al voriconazolo.17
Echinocandine (Caspofungin, Micafungin, Anidulafungin): Sebbene caspofungin sia stato approvato per la terapia IA, micafungin e anidulafungin non si sono dimostrati efficaci nel trattamento primario della IA e pertanto non sono raccomandati dall’IDSA.Caspofungin può causare cefalea, disturbi gastrointestinali e possibili reazioni correlate all’infusione dovute al rilascio di istamina.2
Isavuconazolo: nel marzo 2015, la FDA ha approvato un nuovo triazolo di seconda generazione per IA. Commercializzato con il nome commerciale Cresemba, isavuconazolo è disponibile sia in soluzioni orali che IV ed è indicato per il trattamento di IA e mucormicosi.19 In un confronto tra isavuconazolo e voriconazolo, lo studio SECURE ha determinato che il nuovo agente si è comportato in modo simile per quanto riguarda la mortalità per tutte le cause e la risposta complessiva alla fine della terapia. L ‘ endpoint primario di mortalità per tutte le cause al giorno 42 era del 19% per isavuconazolo e del 20% per voriconazolo.20 Tuttavia, l’isavuconazolo è stato considerato non inferiore poiché gli investigatori hanno utilizzato un margine di noninferiorità del 10% (IC da -7,8 a 5,7). Isavuconazolo ha avuto meno eventi avversi di voriconazolo, in particolare eventi che hanno coinvolto gli occhi, la pelle e il sistema epatobiliare.19 Infine, l’isavuconazolo ha un’elevata biodisponibilità orale, producendo un rapporto 1:1 in una conversione tra formulazioni IV e orali.
Terapia di salvataggio
Le linee guida IDSA non raccomandano la terapia di combinazione per il trattamento iniziale di IA. Invece, la terapia di salvataggio è raccomandata solo se non c’è risposta clinica alla terapia iniziale. Di conseguenza, ciò può comportare l’aggiunta di un secondo agente o il passaggio a un altro farmaco. Posaconazolo, itraconazolo, AMB e caspofungin sono stati studiati per l’uso come terapia di salvataggio e sono raccomandati dalle linee guida IDSA. Walsh e colleghi hanno studiato l’efficacia e la sicurezza di posaconazolo 800 mg di sospensione al giorno in pazienti che erano intolleranti o non rispondenti all’agente antifungino iniziale.Il tasso di successo complessivo è stato del 42% per il gruppo posaconazolo e del 26% per il gruppo di controllo (P = .006).21 Uno studio di Ng e Denning ha dimostrato un tasso di risposta del 40% quando una formulazione lipidica di AMB è stata utilizzata come terapia di salvataggio in pazienti IA refrattari o intolleranti alla terapia esistente.Caspofungin è stato anche esaminato come terapia di salvataggio in uno studio multicentrico non comparativo su pazienti refrattari alla terapia convenzionale; una risposta favorevole si è verificata nel 44,6% dei pazienti.23
Profilassi
Posaconazolo: Le linee guida IDSA raccomandano l’uso di posaconazolo per la profilassi della IA. Questa raccomandazione si basa su due studi randomizzati, controllati, multicentrici che hanno valutato l’uso profilattico di posaconazolo in pazienti con neutropenia e GvHD.24,25 Il primo studio ha confrontato posaconazolo (3 × 200 mg / die) con fluconazolo (1 × 400 mg) o itraconazolo (2 × 200 mg). La IA è stata riportata nell ‘ 1% dei pazienti nel gruppo posaconazolo rispetto al 7% dei pazienti nei gruppi fluconazolo e itraconazolo (P <.001).Il secondo studio ha confrontato posaconazolo con fluconazolo per la profilassi in pazienti con GvHD. La IA era meno frequente nel gruppo posaconazolo che nel gruppo fluconazolo (1,0% vs. 5,9%; P = .001).25
Micafungina: Sebbene non sia approvato per la profilassi di prima linea della IA, le linee guida IDSA raccomandano micafungin come alternativa al posaconazolo. Questa raccomandazione si basa su uno studio randomizzato di fase III, in doppio cieco, condotto su 882 pazienti che hanno ricevuto micafungin 50 mg per via endovenosa (1 mg/kg in pazienti <50 kg) rispetto a fluconazolo 400 mg (8 mg / kg in pazienti < 50 kg). L’efficacia è stata definita come assenza di infezione fungina sistemica provata, probabile o sospetta. Durante la fase neutropenica, l’efficacia complessiva di micafungin è stata superiore a quella del fluconazolo (80% per il gruppo micafungin vs. 73.5% per il gruppo fluconazolo; 95% CI, 0,9% -12%; P = .03).27
Conclusione
IA è una grave infezione fungina che si verifica più comunemente nei pazienti immunocompromessi. Diverse domande devono essere affrontate nella diagnosi, nel trattamento e nella prevenzione dell’aspergillosi. I criteri diagnostici sono poco definiti, rendendo difficile la diagnosi di IA. A causa dell’elevato rischio di mortalità, la terapia antifungina deve essere iniziata rapidamente e correttamente per essere efficace. Esistono lacune critiche per quanto riguarda l’uso della terapia di combinazione, gli strumenti per la diagnosi precoce e le popolazioni di pazienti in cui la profilassi sarebbe più utile.2 Pertanto, è importante che i farmacisti siano informati sulle caratteristiche di ciascun agente antifungino per essere meglio attrezzati per prendere decisioni terapeutiche valide nel trattamento della IA. Infatti, dato l’aumento del rischio di resistenza antifungina, i farmacisti possono svolgere un ruolo importante nella gestione della IA assistendo nella minimizzazione e nella gestione degli effetti avversi, formulando raccomandazioni di dosaggio appropriate e monitorando la selezione di agenti antifungini adatti—tutti fondamentali per ottimizzare la terapia per IA.
1. Denning DW. Aspergillosi invasiva. Clin Infettare Dis. 1998;26:781-803.
2. Il sito utilizza cookie tecnici e di terze parti. Trattamento dell’aspergillosi: linee guida di pratica clinica della Infectious Diseases Society of America. Clin Infettare Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Aspergillosi polmonare: una revisione clinica. Eur Respir Rev. 2011;20:156-174.
4. POLIZIA di Barnes, Marr KA. Aspergillosi: spettro di malattia, diagnosi e trattamento. Infettare Dis Clin Nord Am. 2006; 20: 545-561,vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. aspergillosi invasiva nell’unità di terapia intensiva. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. Un approccio statistico nel cervello umano connectome della malattia di Parkinson negli anziani utilizzando statistiche basate sulla rete. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Caso di aspergillosi-tasso di mortalità: revisione sistematica della letteratura. Clin Infettare Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Patogenesi dell’Aspergillus fumigatus nell’aspergillosi invasiva. Clin Microbiol Rev. 2009;22:447-465.
9. I nostri servizi Manifestazioni cliniche ed esiti del trattamento dell’aspergilloma polmonare. Coreano J Stagista Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Lo spettro clinico dell’aspergillosi polmonare. Torace. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Confronto delle caratteristiche epidemiologiche, cliniche e biologiche dell’aspergillosi invasiva in pazienti neutropenici e non neutropenici: un sondaggio di 6 anni. Clin Infettare Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Aspergillus galactomannan enzyme immunoassay and quantitative PCR for diagnosis of invasive aspergillosis with bronchoalveolar lavage fluid. J Clin Microbiolo. 2004;42:5517-5522.
13. Grano LJ, Walsh TJ. Diagnosi di aspergillosi invasiva mediante rilevamento dell’antigenemia galattomannano mediante un saggio immunoenzimatico. Eur J Clin Microbiol Infettare Dis. 2008;27:245-251.
14. Il suo nome deriva dal greco Vand Aspergillosi invasiva in pazienti critici senza malignità. Am J Respir Crit Cura Med. 2004;170:621-625.
15. Sherif R, Segal BH. Aspergillosi polmonare: presentazione clinica, test diagnostici, gestione e complicanze. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazolo versus amfotericina B per la terapia primaria di aspergillosi invasiva. N Ingl J Med. 2002;347:408-415.
17. I nostri servizi sono sempre a portata di mano. Caspofungin versus amfotericina B liposomiale per terapia antifungina empirica in pazienti con febbre persistente e neutropenia. N Ingl J Med. 2004;351:1391-1402.
18. Il suo nome deriva dal greco antico. Micafungin (FK463), da solo o in combinazione con altri agenti antifungini sistemici, per il trattamento dell’aspergillosi invasiva acuta. J Infettare. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavuconazolo: una nuova opzione per la gestione delle infezioni fungine invasive. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazolo versus voriconazolo per il trattamento primario della malattia invasiva delle muffe causata da Aspergillus e altri funghi filamentosi (SECURE): uno studio di fase 3, controllato randomizzato, di non inferiorità. Lancet. 2016;387:760-769.
21. I nostri servizi sono a vostra disposizione. Trattamento dell’aspergillosi invasiva con posaconazolo in pazienti refrattari o intolleranti alla terapia convenzionale: uno studio controllato esternamente. Clin Infettare Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Terapia liposomiale con amfotericina B (AmBisoma) nelle infezioni fungine invasive. Valutazione dei dati sull’uso compassionevole del Regno Unito. Arch Stagista Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Efficacia e sicurezza di caspofungin per il trattamento dell’aspergillosi invasiva in pazienti refrattari o intolleranti alla terapia antifungina convenzionale. Clin Infettare Dis. 2004;39:1563-1571.
24. I nostri servizi sono a vostra disposizione. Posaconazolo vs. fluconazolo o itraconazolo profilassi in pazienti con neutropenia. N Ingl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.