US Pharm. 2016; 41(4): HS15-HS20.
RÉSUMÉ: L’aspergillose invasive (IA) est une infection fongique rare et grave affectant couramment les patients immunodéprimés. L’incidence précise de l’IA n’a pas été documentée et les taux d’incidence rapportés varient considérablement. Certains facteurs de risque typiques de l’IA comprennent les greffes de cellules souches hématopoïétiques, la corticothérapie à long terme, les tumeurs malignes hématologiques et le VIH. Les poumons sont le site le plus fréquent de l’IA; par conséquent, les symptômes et les manifestations cliniques sont généralement pulmonaires. En raison du risque élevé de décès, la gestion de l’IA avec les agents appropriés doit commencer le plus rapidement possible. Le voriconazole est le traitement empirique de première intention recommandé par les directives de l’Infectious Diseases Society of America; s’il n’y a pas de réponse clinique, un traitement de récupération avec d’autres formulations de lipides azoles, échinocandines ou amphotéricine B doit être administré.
L’aspergillose est une infection fongique causée par Aspergillus, qui comprend un grand groupe d’espèces de moisissures ubiquitaires (spp) les plus fréquemment trouvées dans la végétation en décomposition.1 L’aspergillose, qui est le plus souvent observée chez les personnes immunodéprimées, est une cause importante de morbidité et de mortalité dans cette population, avec des taux de mortalité pouvant atteindre 90%.2,3 Il existe plusieurs types d’infections à aspergillose, notamment l’aspergillose bronchopulmonaire allergique, la sinusite à aspergillus allergique, l’aspergillome, l’aspergillose pulmonaire chronique, l’aspergillose cutanée et l’aspergillose invasive (IA). La plupart de ces infections sont causées par Aspergillus fumigatus, suivi par Aspergillus flavus, Aspergillus niger et Aspergillus terreus.4-6 IA, en particulier, est l’une des infections d’aspergillose les plus graves et son taux de mortalité est élevé.5
Étiologie et épidémiologie
Les facteurs de risque courants de l’IA comprennent la greffe de cellules souches hématopoïétiques, la neutropénie prolongée et sévère, les tumeurs malignes hématologiques, la corticothérapie à long terme et le VIH. Cependant, certaines populations immunocompétentes en soins intensifs, telles que les patients atteints d’une maladie pulmonaire obstructive chronique, d’une maladie grave du foie ou de maladies graves qui perturbent temporairement le système immunitaire, courent également un risque accru d’IV.5 L’incidence de l’IA dans une unité de soins intensifs typique serait de 0,33% à 6,9%, ce qui est comparable à l’incidence chez les patients transplantés d’organes solides.4,5
L’aspergillose n’est pas une infection à déclaration obligatoire aux États-Unis car elle est rare et n’est pas considérée comme une menace sérieuse pour la santé publique.6 Par conséquent, l’incidence exacte de l’IA n’a pas été documentée. De plus, les taux d’incidence déclarés peuvent varier considérablement, ce qui suggère que la géographie peut jouer un rôle.4 Parmi les receveurs de greffe, l’incidence de l’IA varie, avec des affections sous-jacentes courantes, notamment le lymphome et la leucémie.7 Parmi les greffés d’organes solides, l’incidence de l’IA est plus élevée chez les greffés de poumons et de foie (2,4% -6% et 1% -8%, respectivement) que chez les greffés de reins et de cœur (0,1% -4% et 0,3% -6%, respectivement).4 L’incidence de l’IA chez les receveurs de TSHC est encore plus élevée. Les receveurs allogéniques de HSCT ont une incidence d’IA de 2,3% à 11%, ce qui est plus du double du taux d’incidence observé chez les receveurs autologues de HSCT (0,5% -4%).4 Le taux global de létalité a été calculé à 58 %.7,8 Cependant, les taux de létalité de l’IA varient en fonction de la condition sous-jacente. Dans une revue systématique de 53 études de 1995 à 1999, le taux de létalité chez les patients atteints d’IV était le plus élevé chez les patients ayant des antécédents de greffe de moelle osseuse (86,7%) ou de VIH / SIDA (85,7%) et le plus faible chez les patients atteints de leucémie ou de lymphome (49,3%).7
Pathogenèse
Suite à l’inhalation d’une conidie fumigateuse (spores aéroportées), les cellules épithéliales respiratoires et les macrophages alvéolaires déclenchent des réponses immunitaires innées contre les conidies Aspergillus inhalées. Ces agents pathogènes reconnaissent alors des récepteurs sur les cellules hôtes, tels que le récepteur du bêta-glucane Dectin-1. L’interaction entre les agents pathogènes et les récepteurs provoque des chimiokines et des cytokines et active et recrute des monocytes et des neutrophiles. Les neutrophiles se fixent aux hyphes fongiques et se dégranulent, entraînant la destruction fongique. Cette attaque est médiée par la nicotinamide adénine dinucléotide phosphate oxydase. Dans le cas de la neutropénie, les neutrophiles ne sont pas disponibles pour la destruction des hyphes et le contrôle de la croissance fongique, de sorte que les hyphes en croissance peuvent ensuite se propager dans toute la muqueuse des cellules endothéliales.8
Manifestations cliniques
Les poumons sont le site le plus fréquent de l’IA. Par conséquent, les symptômes et les manifestations cliniques de l’IA sont généralement pulmonaires. Dans une étude, Lee et ses collègues ont observé des symptômes d’IA chez 36 patients et ont constaté que l’hémoptysie était la manifestation clinique la plus fréquente (72%), suivie de la toux, de l’essoufflement et de la fatigue.9 Les enquêteurs ont noté que les symptômes de l’IA allaient d’une hémoptysie asymptomatique à une hémoptysie massive (parfois mortelle), et que le taux d’apparition des symptômes variait en fonction du système immunitaire du patient. Patients présentant un certain degré d’immunosuppression (p. ex., le SIDA, l’utilisation de corticostéroïdes, le diabète sucré, l’alcoolisme) peuvent présenter un développement plus rapide des symptômes (c’est-à-dire des semaines plutôt que des mois).10 Dans une enquête de 6 ans menée par Cornillet et ses collègues, la fièvre était le signe clinique le plus fréquent chez les patients atteints d’IA, se présentant chez 85% des patients (n = 88); des douleurs thoraciques étaient également fréquentes.11 Autres symptômes comprennent la perte de poids, les sueurs et l’anorexie.10
Diagnostic
La culture des tissus est actuellement l’étalon-or pour le diagnostic de l’IA.11 Cette méthode donne non seulement Aspergillus spp, mais définit également des options thérapeutiques via des tests de sensibilité. Cependant, le caractère invasif de l’obtention de tissus rend la culture moins souhaitable. En l’absence d’échantillons de tissus, le liquide de lavage broncho-alvéolaire (BAL) obtenu à partir des voies respiratoires supérieures et inférieures peut servir à établir le diagnostic d’IA.12 Bien que le BAL soit une procédure sûre, la sensibilité globale de la culture utilisant des spécimens de BAL est relativement faible (estimée à 50 %).13 L’échantillonnage sanguin est l’approche diagnostique non invasive optimale pour l’IA.12 Malgré ce caractère non invasif, cependant, Aspergillus spp sont rarement isolés du sang par des techniques de culture conventionnelles — d’où le recours à des échantillons de tissus pour obtenir un diagnostic définitif d’IA.12 Étant donné que les résultats des cultures sont relativement lents à obtenir dans l’ensemble, l’IA est bien établie au moment où la culture est positive. Ces défis ont entraîné le développement de méthodes de diagnostic moins invasives et plus rapides.
Le dosage sérique du galactomannane est un test rapide approuvé pour diagnostiquer les cas suspects d’IA chez les patients présentant des tumeurs malignes hématologiques ou des CSH.13 Le galactomannane, un polysaccharide libéré dans les fluides corporels pendant la croissance d’Aspergillus, peut être détecté dans les échantillons de sérum et de BAL plusieurs jours avant l’apparition des signes et symptômes cliniques.13 La détection sérique peut faciliter l’établissement d’un diagnostic spécifique, alors que le liquide BAL semble avoir une sensibilité plus élevée mais est souvent plus difficile à obtenir.12,13 Meersseman et ses collègues ont rapporté que la sensibilité de la détection du galactomannane était de 88% pour le BAL contre 42% pour le sérum, et que la spécificité du galactomannane pour le BAL et le sérum était de 86%.14 Un résultat sérique positif peut permettre l’initiation d’agents antifongiques, alors qu’un résultat négatif peut potentiellement empêcher l’utilisation de médicaments antifongiques coûteux et toxiques.12 La mesure du (1,3)-bêta-D-glucane dans le sang peut également être utile comme outil de dépistage de l’IA. Bien que le dosage du galactomannane soit spécifique à l’IA, le dosage du (1,3)-bêta-D-glucane peut également détecter d’autres maladies fongiques invasives, notamment la candidose, d’autres agents pathogènes des moisissures et le Pneumocystis jiroveci.15
Prise en charge
Le traitement antifongique reste le pilier du traitement de l’IA.2 Afin de prévenir les complications et les résultats médiocres, un traitement antifongique doit être instauré immédiatement chez les patients présentant un risque élevé d’IA.2 L’Infectious Diseases Society of America (IDSA) recommande l’utilisation du voriconazole pour le traitement primaire de l’aspergillose pulmonaire invasive, ainsi que pour d’autres manifestations, telles que les infections d’aspergillose des sinus, l’aspergillose du système nerveux central et l’aspergillose pulmonaire nécrosante chronique.2 Si le traitement primaire échoue, des formulations lipidiques d’amphotéricine B (AMB), de caspofungine et d’itraconazole peuvent être utilisées comme traitement de récupération.2 Les lignes directrices de l’IDSA recommandent également l’utilisation du posaconazole pour la prophylaxie chez les patients neutropéniques atteints de myélodysplasie et de leucémie, ainsi que chez les receveurs allogéniques de HSCT présentant une maladie du greffon contre l’hôte (GvHD).2
Traitement empirique
Voriconazole: Un essai randomisé et non aveugle comparant le voriconazole à l’AMB a révélé que 52,8% des patients atteints de voriconazole avaient des résultats positifs (résolution complète ou partielle des lésions en radiologie).16 Le groupe voriconazole avait également un taux de survie plus élevé que les patients atteints d’AMB (70,8 % contre 57.9 %) et moins d’événements indésirables (343 événements contre 421 événements; P =.02), conduisant les chercheurs à conclure que le voriconazole est supérieur à l’AMB.16 La posologie du voriconazole recommandée par les lignes directrices de l’IDSA (TABLEAU 1) a été étayée dans cet essai.2 Le voriconazole présente un profil d’effets indésirables qui comprend une sensibilité cutanée en cas d’exposition directe au soleil, des troubles visuels et une hépatotoxicité caractérisée par une augmentation de la bilirubine sérique et des enzymes hépatiques.2
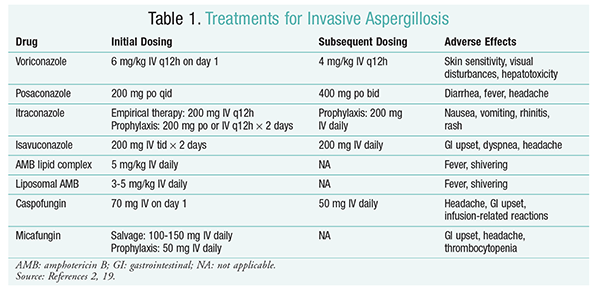
AMB: Auparavant, le désoxycholate d’AMB était la norme de soins pour l’aspergillose. Cependant, des réactions liées à la perfusion (y compris de la fièvre, des rigueurs, des arthralgies, des vomissements et des bronchospasmes) et une néphrotoxicité entraînant une insuffisance rénale potentielle ont entraîné une chute de l’AMB.2 De plus, une azotémie peut survenir lorsque le désoxycholate d’AMB est administré conjointement avec des agents néphrotoxiques (par exemple, la cyclosporine ou le tacrolimus).2 En conséquence, l’IDSA recommande des formulations complexes lipidiques comme alternative, car l’incidence des effets indésirables est inférieure à celle de la formulation de désoxycholate. De plus, dans un essai mené par Walsh et ses collègues qui a comparé le complexe lipidique d’AMB à la caspofungine, les taux de réussite étaient similaires (33,7% pour l’AMB, 33,9% pour la caspofungine); par conséquent, les directives de traitement énumèrent à la fois le complexe lipidique d’AMB et la caspofungine comme alternatives au voriconazole.17
Échinocandines (Caspofungine, Micafungine, Anidulafungine): Bien que la caspofungine ait été approuvée pour le traitement de l’IA, la micafungine et l’anidulafungine ne se sont pas révélées efficaces dans le traitement primaire de l’IA et ne sont donc pas recommandées par l’IDSA.18 La caspofungine peut provoquer des maux de tête, des troubles gastro-intestinaux et d’éventuelles réactions liées à la perfusion en raison de la libération d’histamine.2
Isavuconazole: En mars 2015, la FDA a approuvé un nouveau triazole de deuxième génération pour l’IA. Commercialisé sous le nom commercial Cresemba, l’isavuconazole est disponible en solutions orales et intraveineuses et est indiqué pour le traitement de l’IA et de la mucormycose.19 En comparant l’isavuconazole et le voriconazole, l’étude SECURE a déterminé que le nouvel agent fonctionnait de la même manière en ce qui concerne la mortalité toutes causes confondues et la réponse globale à la fin du traitement. Le critère d’évaluation principal de la mortalité toutes causes confondues au jour 42 était de 19 % pour l’isavuconazole et de 20 % pour le voriconazole.20 Cependant, l’isavuconazole a été jugé non infériorité puisque les enquêteurs ont utilisé une marge de non-infériorité de 10% (IC -7,8 à 5,7). L’isavuconazole a présenté moins d’événements indésirables que le voriconazole, en particulier des événements impliquant les yeux, la peau et le système hépatobiliaire.19 Enfin, l’isavuconazole a une biodisponibilité orale élevée, ce qui donne un rapport de 1: 1 dans une conversion entre les formulations IV et orales.
Thérapie de récupération
Les lignes directrices de l’IDSA ne recommandent pas la thérapie combinée pour le traitement initial de l’IA. Au lieu de cela, un traitement de récupération n’est recommandé que s’il n’y a pas de réponse clinique au traitement initial. Par conséquent, cela peut impliquer l’ajout d’un deuxième agent ou le passage à un autre médicament. Le posaconazole, l’itraconazole, l’AMB et la caspofungine ont été étudiés pour être utilisés comme traitement de récupération et sont recommandés par les directives de l’IDSA. Walsh et ses collègues ont étudié l’efficacité et l’innocuité de la suspension quotidienne de posaconazole à 800 mg chez les patients intolérants ou ne répondant pas à l’antifongique initial.21 Le taux de réussite global était de 42 % pour le groupe posaconazole et de 26 % pour le groupe témoin (P =.006).21 Une étude menée par Ng et Denning a démontré un taux de réponse de 40% lorsqu’une formulation à base de lipides d’AMB était utilisée comme traitement de récupération chez des patients atteints d’IA réfractaires ou intolérants au traitement existant.22 La caspofungine a également été examinée en tant que traitement de récupération dans une étude multicentrique non comparative de patients réfractaires au traitement conventionnel; une réponse favorable est survenue chez 44,6% des patients.23
Prophylaxie
Posaconazole: Les lignes directrices de l’IDSA recommandent l’utilisation du posaconazole pour la prophylaxie de l’IA. Cette recommandation est basée sur deux essais randomisés, contrôlés et multicentriques qui ont évalué l’utilisation prophylactique du posaconazole chez des patients atteints de neutropénie et de GvHD.24,25 Le premier essai a comparé le posaconazole (3 × 200 mg / jour) avec le fluconazole (1 × 400 mg) ou l’itraconazole (2 × 200 mg). Une IA a été rapportée chez 1% des patients du groupe posaconazole contre 7 % des patients des groupes fluconazole et itraconazole (P <.001).26 La deuxième étude a comparé le posaconazole au fluconazole pour la prophylaxie chez les patients atteints de GvHD. L’IA était moins fréquente dans le groupe posaconazole que dans le groupe fluconazole (1,0 % vs 5,9 %; P =.001).25
Micafungine: Bien que non approuvé pour la prophylaxie de première intention de l’IA, les lignes directrices de l’IDSA recommandent la micafungine comme alternative au posaconazole. Cette recommandation est basée sur un essai randomisé de phase III en double aveugle mené auprès de 882 patients ayant reçu 50 mg de micafungine IV (1 mg / kg chez les patients < 50 kg) contre 400 mg de fluconazole (8 mg / kg chez les patients < 50 kg). L’efficacité a été définie comme l’absence d’infection fongique systémique prouvée, probable ou suspectée. Pendant la phase neutropénique, l’efficacité globale de la micafungine était supérieure à celle du fluconazole (80 % pour le groupe micafungine vs 73.5% pour le groupe fluconazole; IC à 95%, 0,9% -12%; P =.03).27
Conclusion
L’IA est une infection fongique grave qui survient le plus souvent chez les patients immunodéprimés. Plusieurs questions doivent être abordées dans le diagnostic, le traitement et la prévention de l’aspergillose. Les critères diagnostiques sont mal définis, ce qui rend le diagnostic de l’IA difficile. En raison du risque élevé de mortalité, le traitement antifongique doit être initié rapidement et correctement pour être efficace. Des lacunes critiques existent en ce qui concerne l’utilisation de la thérapie combinée, les outils de détection précoce et les populations de patients chez qui la prophylaxie serait la plus bénéfique.2 Par conséquent, il est important que les pharmaciens connaissent bien les caractéristiques de chaque antifongique afin d’être les mieux équipés pour prendre des décisions thérapeutiques judicieuses dans le traitement de l’IA. En effet, compte tenu du risque accru de résistance antifongique, les pharmaciens peuvent jouer un rôle important dans la prise en charge de l’IA en aidant à minimiser et à gérer les effets indésirables, en formulant des recommandations de dosage appropriées et en surveillant la sélection d’agents antifongiques appropriés — tous essentiels à l’optimisation du traitement de l’IA.
1. Denning DW. Aspergillose invasive. Clin Infecte Dis. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et coll. Traitement de l’aspergillose: directives de pratique clinique de la Infectious Diseases Society of America. Clin Infecte Dis. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Aspergillose pulmonaire: un examen clinique. Eur Respir Rév. 2011; 20:156-174.
4. La POLICE de Barnes, Marr KA. Aspergillose: spectre de la maladie, diagnostic et traitement. Infecter Dis Clin North Am. 2006; 20:545-561, vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. aspergillose invasive dans l’unité de soins intensifs. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B, et al. A statistical approach in human brain connectome of Parkinson disease in elderly people using Network Based Statistics. Conf Proc IEEE Eng Med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Taux de mortalité par aspergillose: revue systématique de la littérature. Clin Infecte Dis. 2001;32:358-366.
8. Dagenais TR, Keller NP. Pathogenèse de l’Aspergillus fumigatus dans l’aspergillose invasive. Clin Microbiol Rev. 2009; 22:447-465.
9. Lee SH, Lee BJ, Jung DY, et coll. Manifestations cliniques et résultats du traitement de l’aspergillome pulmonaire. Stagiaire J Coréen Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. Le spectre clinique de l’aspergillose pulmonaire. Thorax. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S, et al. Comparaison des caractéristiques épidémiologiques, cliniques et biologiques de l’aspergillose invasive chez les patients neutropéniques et non neureutropéniques: une enquête de 6 ans. Clin Infecte Dis. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Immunoessai enzymatique Aspergillus galactomannan et PCR quantitative pour le diagnostic de l’aspergillose invasive avec liquide de lavage broncho-alvéolaire. J Clin Microbiol. 2004;42:5517-5522.
13. Blé LJ, Walsh TJ. Diagnostic de l’aspergillose invasive par détection de l’antigénémie par galactomannane à l’aide d’un dosage immunologique enzymatique. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. Meersseman W, Vandecasteele SJ, Wilmer A, et coll. Aspergillose invasive chez les patients gravement malades sans tumeur maligne. Am J Respir Crit Soins Med. 2004;170:621-625.
15. Sherif R, Segal BH. Aspergillose pulmonaire: présentation clinique, tests diagnostiques, prise en charge et complications. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Le voriconazole contre l’amphotéricine B pour le traitement primaire de l’aspergillose invasive. En anglais J Med. 2002;347:408-415.
17. Il s’agit de l’un des principaux facteurs de risque de la maladie de Parkinson. Caspofungine versus amphotéricine liposomale B pour un traitement antifongique empirique chez les patients présentant une fièvre persistante et une neutropénie. En anglais J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM, et al. Micafungine (FK463), seule ou en association avec d’autres antifongiques systémiques, pour le traitement de l’aspergillose invasive aiguë. J’infecte. 2006;53:337-349.
19. Pettit NN, Carver PL. Isavuconazole: une nouvelle option pour la prise en charge des infections fongiques invasives. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA, et al. Isavuconazole contre voriconazole pour le traitement primaire de la moisissure invasive causée par Aspergillus et d’autres champignons filamenteux (SECURE): un essai de phase 3, contrôlé randomisé, sans infériorité. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF, et coll. Traitement de l’aspergillose invasive par le posaconazole chez les patients réfractaires ou intolérants au traitement conventionnel: un essai contrôlé à l’extérieur. Clin Infecte Dis. 2007;44:2-12.
22. Ng TT, Denning DW. Traitement par amphotéricine B liposomale (AmBisome) dans les infections fongiques invasives. Evaluation of United Kingdom compassionate use data. Arch Intern Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G, et al. Efficacité et innocuité de la caspofungine pour le traitement de l’aspergillose invasive chez les patients réfractaires ou intolérants au traitement antifongique conventionnel. Clin Infecte Dis. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ, et coll. Prophylaxie du posaconazole par rapport au fluconazole ou à l’itraconazole chez les patients atteints de neutropénie. En anglais J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.