US Pharm. 2016;41(4): HS15-HS20.
absztrakt: az invazív aspergillosis (IA) ritka, súlyos gombás fertőzés, amely általában immunhiányos betegeket érint. Az IA pontos előfordulási gyakoriságát nem dokumentálták, és a jelentett előfordulási arányok nagyon eltérőek. Az IA néhány tipikus kockázati tényezője a hematopoietikus őssejt-transzplantáció, a hosszú távú kortikoszteroid terápia, a hematológiai rosszindulatú daganatok és a HIV. A tüdő az IA leggyakoribb helye; következésképpen a tünetek és a klinikai tünetek jellemzően tüdők. A halálozás magas kockázata miatt az IA kezelését a megfelelő szerekkel a lehető leggyorsabban meg kell kezdeni. A vorikonazol az Amerikai Fertőző Betegségek Társaságának irányelvei által ajánlott első vonalbeli empirikus terápia; ha nincs klinikai válasz, akkor más azolokkal, echinocandinokkal vagy amfotericin B lipidkészítményekkel végzett mentési terápiát kell beadni.
az Aspergillosis az Aspergillus által okozott gombás fertőzés, amely a bomló növényzetben leggyakrabban előforduló mindenütt jelen lévő penészfajok (spp) nagy csoportját tartalmazza.1 az Aspergillosis, amely leggyakrabban immunhiányos személyeknél figyelhető meg, ebben a populációban a morbiditás és mortalitás jelentős oka, a halálozási arány akár 90% is lehet.2,3 az aspergillosis fertőzéseknek több típusa létezik, köztük allergiás bronchopulmonalis aspergillosis, allergiás Aspergillus sinusitis, aspergilloma, krónikus pulmonalis aspergillosis, cutan aspergillosis és invazív aspergillosis (ia). Ezeknek a fertőzéseknek a többségét az Aspergillus fumigatus okozza, amelyet az Aspergillus flavus, az Aspergillus niger és az Aspergillus terreus követ.Különösen a 4-6 IA az egyik legsúlyosabb aspergillosis fertőzés, magas a halálozási aránya.5
etiológia és epidemiológia
az IA gyakori kockázati tényezői közé tartozik a hematopoietikus őssejt-transzplantáció (HSCT), a hosszan tartó és súlyos neutropenia, a hematológiai rosszindulatú daganatok, a hosszú távú kortikoszteroid-kezelés és a HIV. Bizonyos ICU-immunkompetens populációk, például krónikus obstruktív tüdőbetegségben szenvedő betegek, súlyos májbetegség vagy kritikus betegségek, amelyek ideiglenesen megzavarják az immunrendszert, szintén fokozott kockázatnak vannak kitéve az IA szempontjából.5 az IA előfordulási gyakorisága egy tipikus intenzív osztályon a jelentések szerint 0,33 – 6,9%, ami összehasonlítható a szilárd szervátültetett betegek előfordulási gyakoriságával.4,5
az Aspergillosis nem jelentendő fertőzés az Egyesült Államokban, mivel nem gyakori, és nem tekinthető súlyos közegészségügyi veszélynek.6 ennek eredményeként az IA pontos előfordulását nem dokumentálták. Ezenkívül a jelentett előfordulási arányok jelentősen eltérhetnek, ami arra utal, hogy a földrajz szerepet játszhat.4 a transzplantált betegek körében az IA előfordulási gyakorisága változó, közös alapbetegségekkel, beleértve a limfómát és a leukémiát.7 a szilárd szervátültetésen átesett betegek körében az IA incidenciája magasabb a tüdő-és májátültetésen átesett betegeknél (sorrendben 2,4% -6% és 1% -8%), mint a vese – és szívátültetésen átesett betegeknél (sorrendben 0,1% -4% és 0,3% -6%).4 az IA előfordulási gyakorisága a HSCT-recipienseknél még magasabb. Az allogén HSCT-recipiensek ia incidenciája 2,3 – 11%, ami több mint kétszerese az autológ HSCT-recipienseknél megfigyelt incidenciának (0,5% -4%).4 a teljes halálozási arányt 58%-ra számították.7,8 az IA eset-halálozási aránya azonban a mögöttes állapottól függően változik. 53 vizsgálat szisztematikus áttekintésében 1995-től 1999-ig az IA-betegek esetében a halálozási arány a legmagasabb volt azoknál a betegeknél, akiknek kórtörténetében csontvelő-átültetés (86,7%) vagy HIV/AIDS (85,7%), a legalacsonyabb pedig leukémiában vagy limfómában szenvedő betegeknél (49,3%).7
patogenezis
a fumigatus conidia (levegőben terjedő spórák) belélegzése után a légzőszervi hámsejtek és az alveoláris makrofágok veleszületett immunválaszt váltanak ki az inhalált Aspergillus conidia ellen. Ezek a kórokozók ezután felismerik a gazdasejtek receptorait, például a béta-glükán receptor Dectin-1-et. A kórokozók és receptorok közötti kölcsönhatás kemokineket és citokineket vált ki, és aktiválja és toborozza a monocitákat és a neutrofileket. A neutrofilek kötődnek a gombás hifákhoz és degranulálódnak, ami gombás pusztulást eredményez. Ezt a rohamot a nikotinamid-adenin-dinukleotid-foszfát-oxidáz közvetíti. Neutropenia esetén a neutrofilek nem állnak rendelkezésre a hyphal elpusztítására és a gomba növekedésének szabályozására, így a növekvő hyphae átterjedhet az endothel sejtbélésében.8
klinikai tünetek
a tüdő az IA leggyakoribb helye. Következésképpen az IA tünetei és klinikai megnyilvánulásai jellemzően tüdők. Az egyik vizsgálatban Lee és munkatársai 36 betegnél figyelték meg az IA tüneteit, és megállapították, hogy a hemoptysis volt a leggyakoribb klinikai megnyilvánulás (72%), amelyet köhögés, légszomj és fáradtság követett.9 A kutatók megjegyezték, hogy az IA tünetei a tünetmentestől a masszív hemoptysisig terjedtek (néha halálos kimenetelűek), és a tünetek megjelenésének aránya a beteg immunrendszerétől függően változott. Bizonyos fokú immunszuppresszióban szenvedő betegek (pl., AIDS, kortikoszteroidok használata, diabetes mellitus, alkoholizmus) a tünetek gyorsabb fejlődésével (azaz hetekkel, nem pedig hónapokkal) jelentkezhetnek.10 egy Cornillet és munkatársai által végzett 6 éves felmérésben a láz volt a leggyakoribb klinikai tünet az IA betegeknél, a betegek 85% – ánál (n = 88); a mellkasi fájdalom is gyakori volt.11 további tünetek közé tartozik a fogyás, izzadás és anorexia.10
diagnózis
a szövetek tenyésztése jelenleg az IA diagnózisának arany standardja.11 Ez a módszer nemcsak Aspergillus spp-t eredményez, hanem érzékenységi teszttel tovább határozza meg a terápiás lehetőségeket. A szövet megszerzésének invazivitása azonban kevésbé kívánatossá teszi a tenyésztést. Szövetminták hiányában a felső és alsó légutakból nyert bronchoalveoláris mosófolyadék (BAL) folyadék szolgálhat az IA diagnózisának megállapításához.12 bár a BAL biztonságos eljárás, a bal mintákat használó tenyészetek általános érzékenysége viszonylag alacsony (becslések szerint 50%).13 a vérmintavétel az optimális nem invazív diagnosztikai megközelítés az IA számára.12 ennek a nem invazív jellegnek ellenére azonban az Aspergillus spp—t ritkán izolálják a vérből hagyományos tenyésztési technikákkal-ezért a szövetmintákra támaszkodnak az IA végleges diagnózisának biztosítása érdekében.12 mivel a tenyészetekből származó eredmények összességében viszonylag lassan érhetők el, a hatásvizsgálat már jól megalapozott, mire a tenyészet pozitívvá válik. Ezek a kihívások olyan diagnosztikai módszerek kifejlesztését eredményezték, amelyek kevésbé invazívak és gyorsabbak.
a szérum galaktomannán assay egy gyors teszt, amelyet jóváhagytak az IA gyanús eseteinek diagnosztizálására hematológiai rosszindulatú daganatokban vagy HSCTs-ben szenvedő betegeknél.13 A galaktomannán, az Aspergillus növekedése során testnedvekben felszabaduló poliszacharid a szérumban és a BAL mintákban néhány nappal a klinikai tünetek megjelenése előtt kimutatható.13 A szérum kimutatása megkönnyítheti a specifikus diagnózis felállítását, míg a BAL folyadék nagyobb érzékenységgel rendelkezik, de gyakran nehezebb megszerezni.12,13 Meersseman és munkatársai arról számoltak be, hogy a galaktomannán-kimutatás érzékenysége 88% volt a BAL esetében, szemben a szérum 42% – ával, és a galaktomannán specificitása mind a BAL, mind a szérum esetében 86% volt.14 a pozitív szérumeredmény lehetővé teheti a gombaellenes szerek alkalmazását, míg a negatív eredmény potenciálisan megakadályozhatja a drága és mérgező gombaellenes gyógyszerek alkalmazását.12 az (1,3)-béta-D-glükán mérése a vérben szintén hasznos lehet az IA szűrési eszközeként. Bár a galaktomannán-vizsgálat specifikus az IA-ra, az (1,3)-béta-D-glükán-vizsgálat más invazív gombabetegségeket is képes kimutatni, beleértve a candidiasist, más penészkórokozókat és a Pneumocystis jiroveci-t.15
menedzsment
a gombaellenes kezelés továbbra is az IA kezelésének alapja.2 a szövődmények és a rossz eredmények megelőzése érdekében azonnal gombaellenes kezelést kell kezdeni azoknál a betegeknél, akiknél magas az IA kockázata.2 Az Amerikai Fertőző Betegségek Társasága (IDSA) a vorikonazol alkalmazását javasolja az invazív pulmonalis aspergillosis elsődleges kezelésére, valamint más megnyilvánulásokra, mint például az aspergillosis az orrmelléküregek fertőzései, a központi idegrendszer aspergillosisés krónikus nekrotizáló pulmonalis aspergillosis.2 ha az elsődleges kezelés sikertelen, az amfotericin B (AMB), a kaszpofungin és az itrakonazol lipidkészítményei alkalmazhatók megmentő terápiaként.2 az IDSA irányelvei szintén javasolják a pozakonazol alkalmazását myelodysplasiában és leukémiában szenvedő neutropéniás betegek, valamint graft-versus-host betegségben (GvHD) szenvedő allogén HSCT-recipiensek profilaxisában.2
empirikus kezelés
vorikonazol: egy randomizált, nem vak vizsgálat, amely a vorikonazolt az AMB-vel hasonlította össze, azt találta, hogy a vorikonazollal kezelt betegek 52,8% – a tapasztalt sikeres eredményt (a radiológiai elváltozások teljes vagy részleges megszűnése).16 a vorikonazol-csoportban is magasabb volt a túlélési arány, mint az AMB-ben szenvedő betegeknél (70,8% vs.57.9%) és kevesebb nemkívánatos esemény (343 esemény vs. 421 esemény; P = .02), a nyomozók arra a következtetésre jutottak, hogy a vorikonazol jobb, mint az AMB.16 ebben a vizsgálatban az IDSA Irányelvek (1.táblázat) által javasolt vorikonazol adagolást támogatták.2 A Vorikonazolnak van egy káros hatás Profilja, amely magában foglalja a bőr érzékenységét közvetlen napfénynek való kitettséggel, látászavarokat és hepatotoxicitást, melyet a szérum bilirubin és a májenzimek emelkedése jellemez.2
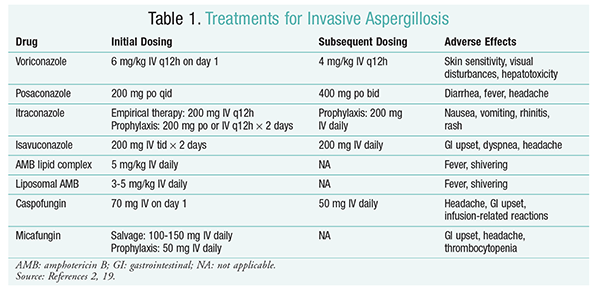
AMB: korábban az AMB dezoxikolát volt az aspergillosis kezelésének standardja. Az infúzióval kapcsolatos reakciók (beleértve a lázat, a hidegrázást, az arthralgiát, a hányást és a hörgőgörcsöket) és a potenciális veseelégtelenséget eredményező nephrotoxicitás miatt az AMB nem részesült előnyben.2 ezenkívül azotémia fordulhat elő, ha az AMB dezoxikolátot nefrotoxikus szerekkel (pl. ciklosporinnal vagy takrolimusszal) együtt adják.2 Ennek eredményeként az IDSA alternatívaként lipid komplex készítményeket javasol, mivel a káros hatások előfordulása alacsonyabb, mint a dezoxikolát-készítmény esetében. Ezenkívül Walsh és kollégái által végzett vizsgálatban, amelyben az AMB lipid komplexet kaszpofunginnal hasonlították össze, a sikerességi arányok hasonlóak voltak (33,7% az AMB, 33,9% a kaszpofungin esetében); ezért a kezelési irányelvek mind az AMB lipid komplexet, mind a kaszpofungint felsorolják a vorikonazol alternatívájaként.17
echinokandinok (kaszpofungin, mikafungin, Anidulafungin): bár a kaszpofungint jóváhagyták az IA kezelésére, a mikafungin és az anidulafungin nem bizonyult hatékonynak az IA elsődleges kezelésében, ezért az IDSA nem javasolja őket.18 a kaszpofungin a hisztamin felszabadulása miatt fejfájást, gyomor-bélrendszeri zavarokat és lehetséges infúziós reakciókat okozhat.2
Izavukonazol: 2015 márciusában az FDA jóváhagyta az új második generációs triazolt az IA számára. A Cresemba kereskedelmi néven forgalmazott izavukonazol mind orális, mind intravénás oldatokban kapható, és az IA és a mucormycosis kezelésére javallt.19 az isavukonazol és a vorikonazol összehasonlításában a SECURE vizsgálat megállapította, hogy az új szer hasonlóan teljesített a kezelés végén az összmortalitás és az általános válasz tekintetében. Az összmortalitás elsődleges végpontja a 42.napra 19% volt az izavukonazol és 20% a vorikonazol esetében.20 az izavukonazolt azonban nem alacsonyabbnak ítélték, mivel a kutatók 10% – os nem alacsonyabbrendűségi különbözetet (CI-7,8-5,7) alkalmaztak. Az izavukonazolnak kevesebb mellékhatása volt, mint a vorikonazolnak, különösen a szemet, a bőrt és a hepatobiliáris rendszert érintő események.19 végül, az izavukonazol magas orális biohasznosulással rendelkezik, ami 1:1 arányt eredményez az intravénás és az orális készítmények közötti konverzióban.
mentési terápia
az IDSA irányelvei nem javasolják a kombinációs terápiát az IA kezdeti kezelésére. Ehelyett a mentési terápia csak akkor ajánlott, ha a kezdeti terápiára nincs klinikai válasz. Következésképpen ez magában foglalhatja egy második szer hozzáadását vagy egy másik gyógyszerre való áttérést. A pozakonazolt, az itrakonazolt, az AMB-t és a kaszpofungint salvage terápiaként vizsgálták, és az IDSA irányelvei ajánlják őket. Walsh és munkatársai a napi 800 mg pozakonazol szuszpenzió hatásosságát és biztonságosságát vizsgálták olyan betegeknél, akik nem tolerálták vagy nem reagáltak a kezdeti gombaellenes szerre.21 a teljes sikerarány 42% volt a pozakonazollal kezelt csoportban és 26% a kontrollcsoportban (P = .006).21 egy Ng és Denning által végzett vizsgálat 40% – os válaszarányt mutatott ki, amikor az AMB lipid alapú gyógyszerformáját alkalmazták mentő terápiaként olyan IA-s betegeknél, akik refrakter vagy intoleránsak voltak a meglévő terápiával szemben.22 a Kaszpofungint mentő terápiaként is vizsgálták egy nem összehasonlító multicentrikus vizsgálatban, amelyben a hagyományos terápiára refrakter betegek vettek részt; kedvező válasz a betegek 44, 6% – ánál fordult elő.23
profilaxis
pozakonazol: az IDSA irányelvek a pozakonazol alkalmazását javasolják az IA megelőzésére. Ez az ajánlás két randomizált, kontrollos, multicentrikus vizsgálaton alapul, amelyek a pozakonazol profilaktikus alkalmazását értékelték neutropeniában és GvHD-ban szenvedő betegeknél.24,25 az első vizsgálatban a pozakonazolt (3 600 mg/nap) hasonlították össze flukonazollal (1 400 mg / nap) vagy itrakonazollal (2 200 mg / nap). IA-t a pozakonazol-csoportban a betegek 1% – ánál jelentettek, szemben a flukonazol-és itrakonazol-csoportban a betegek 7% – ával (P <.001).26 a második vizsgálatban a pozakonazolt flukonazollal hasonlították össze profilaxis céljából GvHD-s betegeknél. Az IA ritkábban fordult elő a pozakonazol-csoportban, mint a flukonazol-csoportban (1,0% vs .5,9%; P=.001).25
mikafungin: Bár nem engedélyezték az IA első vonalbeli profilaxisát, az IDSA irányelvek a mikafungint javasolják a pozakonazol alternatívájaként. Ez az ajánlás egy randomizált, kettős-vak, fázis III vizsgálaton alapul, amelyben 882 beteg vett részt, akik 50 mg mikafungint kaptak IV. (1 mg/kg <50 kg betegeknél), szemben a 400 mg flukonazollal (8 mg / kg <50 kg betegeknél). A hatásosságot a bizonyított, valószínű vagy feltételezett szisztémás gombás fertőzés hiányaként határozták meg. A neutropeniás fázisban a mikafungin teljes hatásossága jobb volt, mint a flukonazolé (80% a mikafungin csoportban vs.73.5% A flukonazol-csoportban; 95% CI, 0,9%-12%; P = .03).27
következtetés
az IA súlyos gombás fertőzés, amely leggyakrabban immunhiányos betegeknél fordul elő. Számos kérdést kell kezelni az aspergillosis diagnózisában, kezelésében és megelőzésében. A diagnosztikai kritériumok rosszul vannak meghatározva, így az IA diagnózisa kihívást jelent. A halálozás magas kockázata miatt a gombaellenes kezelést gyorsan és helyesen kell megkezdeni annak érdekében, hogy hatékony legyen. Kritikus hiányosságok vannak a kombinációs terápia, a korai felismerés eszközei, valamint a betegpopulációk, akiknél a profilaxis lenne a legelőnyösebb.2 ezért fontos, hogy a gyógyszerészek tájékozottak legyenek az egyes gombaellenes szerek jellemzőiről annak érdekében, hogy a legjobban felkészüljenek arra, hogy megalapozott terápiás döntéseket hozzanak az IA kezelésében. Valójában, tekintettel a gombaellenes rezisztencia fokozott kockázatára, a gyógyszerészek fontos szerepet játszhatnak az IA kezelésében azáltal, hogy segítenek a káros hatások minimalizálásában és kezelésében, megfelelő adagolási ajánlásokat tesznek, és figyelemmel kísérik a megfelelő gombaellenes szerek kiválasztását—amelyek mindegyike kritikus fontosságú az IA terápiájának optimalizálása szempontjából.
1. Denning DW. Invazív aspergillosis. Clin Megfertőzi Dis-T. 1998;26:781-803.
2. Walsh TJ, Anaissie EJ, Denning DW, et al. Aspergillosis kezelése: az Amerikai Fertőző Betegségek Társaságának klinikai gyakorlati irányelvei. Clin Megfertőzi Dis-T. 2008;46:327-360.
3. Kousha M, Tadi R, Soubani AO. Pulmonalis aspergillosis: klinikai áttekintés. Eur Respir Rev. 2011;20:156-174.
4. Barnes rendőrség, Marr KA. Aspergillosis: a betegség, a diagnózis és a kezelés spektruma. Infect Dis Clin Észak Am. 2006;20: 545-561,vi.
5. Dimopoulos G, Frantzeskaki F, Poulakou G, Armaganidis A. invazív aspergillosis az intenzív osztályon. Ann N Y Acad Sci. 2012;1272:31-39.
6. Aarabi MH, Kamalian A, Mohajer B és mtsai. Statisztikai megközelítés az idős emberek Parkinson-kórjának emberi agyi konnektomjában hálózati alapú statisztikák felhasználásával. Conf Proc IEEE Eng med Biol Soc. 2015;2015:4310-4313.
7. Lin SJ, Schranz J, Teutsch SM. Aspergillosis eset-halálozási arány: az irodalom szisztematikus áttekintése. Clin Megfertőzi Dis-T. 2001;32:358-366.
8. Dagenais TR, Keller NP. Az Aspergillus fumigatus patogenezise invazív aspergillosisban. Clin Microbiol Rev. 2009;22: 447-465.
9. Lee SH, Lee BJ, Jung DY, et al. A pulmonalis aspergilloma klinikai megnyilvánulásai és kezelési eredményei. Koreai J Gyakornok Med. 2004;19:38-42.
10. Kosmidis C, Denning DW. A pulmonalis aspergillosis klinikai spektruma. Mellkas. 2015;70:270-277.
11. Cornillet A, Camus C, Nimubona S és mtsai. Az invasiv aspergillosis epidemiológiai, klinikai és biológiai jellemzőinek összehasonlítása neutropeniás és nonneutropeniás betegeknél: 6 éves felmérés. Clin Megfertőzi Dis-T. 2006;43:577-584.
12. Musher B, Fredricks D, Leisenring W, et al. Aspergillus galaktomannán enzim immunoassay és kvantitatív PCR az invazív aspergillosis diagnosztizálására bronchoalveoláris mosófolyadékkal. J Clin Mikrobiol. 2004;42:5517-5522.
13. Búza LJ, Walsh TJ. Az invazív aspergillosis diagnosztizálása galaktomannán antigenémia kimutatásával enzim immunoassay alkalmazásával. Eur J Clin Microbiol Infect Dis. 2008;27:245-251.
14. W, Vandecasteele SJ, Wilmer A, et al. Invazív aspergillosis rosszindulatú daganat nélküli kritikus betegeknél. Am J Respir Crit Care Med. 2004;170:621-625.
15. Serif R, Segal BH. Pulmonalis aspergillosis: klinikai megjelenés, diagnosztikai tesztek, kezelés és szövődmények. Curr Opin Pulm Med. 2010:16:242-250.
16. Herbrecht R, Denning DW, Patterson TF, et al. Vorikonazol vs. amfotericin B az invazív aspergillosis primer terápiájában. N Engl J Med. 2002;347:408-415.
17. Walsh TJ, Teppler H, Donowitz GR és mtsai. Kaszpofungin versus liposzomális amfotericin B empirikus gombaellenes terápiában tartós lázban és neutropeniában szenvedő betegeknél. N Engl J Med. 2004;351:1391-1402.
18. Denning DW, Marr KA, Lau WM és mtsai. Mikafungin (FK463), önmagában vagy más szisztémás gombaellenes szerekkel kombinálva, akut invazív aspergillosis kezelésére. J Megfertőzni. 2006;53:337-349.
19. Pettit NN, Carver pl. Izavukonazol: új lehetőség az invazív gombás fertőzések kezelésére. Ann Pharmacother. 2015;49:825-842.
20. Maertens JA, Raad II, Marr KA és mtsai. Isavukonazol versus vorikonazol az Aspergillus és más fonalas gombák által okozott invazív penészbetegség elsődleges kezelésére (biztonságos): 3. fázisú, randomizált, kontrollos, non-inferioritási vizsgálat. Lancet. 2016;387:760-769.
21. Walsh TJ, Raad I, Patterson TF és mtsai. Invazív aspergillosis kezelése pozakonazollal olyan betegeknél, akik nem reagálnak a hagyományos terápiára vagy nem tolerálják azt: külsőleg kontrollált vizsgálat. Clin Megfertőzi Dis-T. 2007;44:2-12.
22. Ng TT, Denning DW. Liposzómás amfotericin B (AmBisome) terápia invazív gombás fertőzésekben. Az Egyesült Királyság együttérző Felhasználási adatainak értékelése. Arch Gyakornok Med. 1995;155:1093-1098.
23. Maertens J, Raad I, Petrikkos G és mtsai. A kaszpofungin hatásossága és biztonságossága invazív aspergillosis kezelésében olyan betegeknél, akik nem reagálnak a hagyományos gombaellenes kezelésre vagy nem tolerálják azt. Clin Megfertőzi Dis-T. 2004;39:1563-1571.
24. Cornely OA, Maertens J, Winston DJ és mtsai. Pozakonazol vs. flukonazol vagy itrakonazol profilaxis neutropeniában szenvedő betegeknél. N Engl J Med. 2007;356:348-359.
25. Ullmann AJ, Lipton JH, Vesole DH, et al. Posaconazole or fluconazole for prophylaxis in severe graft-versus-host disease. N Engl J Med. 2007;356:335-347.
26. Cornely OA, Maertens J, Winston DJ, et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia. N Engl J Med. 2007;356:348-359.
27. van Burik JA, Ratanatharathorn V, Stepan DE, et al. Micafungin versus fluconazole for prophylaxis against invasive fungal infections during neutropenia in patients undergoing hematopoietic stem cell transplantation. Clin Infect Dis. 2004;39:1407-1416.